抗中性粒细胞胞浆抗体相关性肥厚性硬脊膜炎1例报告并文献复习
云宗金, 徐鹏程,宋 斌,丁新苑
肥厚性硬脊膜炎(hypertrophic spinal pachymeningitis,HSP)是一种罕见的慢性炎性纤维化疾病,其发病与免疫密切相关。常见病因包括:特发性、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎、IgG4抗体相关性疾病等[1]。HSP是ANCA相关性神经系统损害的罕见表现形式。现报道1例我院诊治的ANCA相关性HSP病例,并通过文献检索,总结分析ANCA相关性HSP的临床和影像学特点,提高大家对该病的认识,减少误诊误治。
1 资料和方法
1.1 病例资料 患者,女性,77岁,系“进行性腰痛3 y,行走困难3 m”于2018年12月30日入住我院骨科。患者3 y前开始无明显诱因出现腰背部疼痛,活动后加重,休息后可缓解,无明显游走及放射,无明显活动受限,未诊治。3 m前症状进行性加重,日常活动明显受限,无法长距离行走。期间曾至多家医院就诊,行胸腰椎MRI检查示胸12椎体压缩变扁,胸腰段后凸畸形,后方硬膜囊受压,多节段椎间盘突出伴椎管不同程度狭窄;椎管内未见明显占位及狭窄。均给予消炎镇痛等对症治疗,症状无改善,逐渐出现双下肢麻木、无力。我院骨科门诊拟“脊柱后凸畸形、骨质疏松症”收住,病程中患者精神尚可,饮食睡眠正常,大小便正常,近期体重未见明显变化。查体:颅神经阴性,双上肢肌力、肌张力、腱反射正常,右下肢肌力4级,左下肢肌力4+级,双下肢肌张力正常,双下肢腱反射亢进,双侧病理征阳性。入院后完善检查:血沉69(mm/H)↑;C反应蛋白 6.17(mg/L)↑;血常规示红细胞计数3.38×1012/L,血红蛋白107g/L↓;止凝血功能示纤维蛋白原4.34 g/L↑,D-二聚体2.32 μg/ml↑,FDP 10.11 μg/ml↑;尿常规示隐血(+);肝肾功能、电解质、血糖血脂、女性肿瘤标志物、免疫9项、粪便常规+隐血未见明显异常。头部+颈椎+腰椎MR平扫:(1)脑萎缩;(2)C4/5、C5/6及C6/C7椎间盘突出;颈椎退行性变;(3)T12椎体楔形变;L4/5及L5/S1椎间盘突出;腰椎退行性变。入院后予以减轻水肿、营养神经、补钙、止痛等治疗。住院期间患者双下肢麻木、无力进行性加重,瘫痪明显伴尿潴留。请我科会诊,结合外院胸椎MRI考虑T9-12椎管内及脊髓异常信号,建议增强(见图1A、1B)。胸椎MRI增强示T8-L2水平脊膜异常信号及增厚,考虑炎性病变(见图1C)。结合病史,考虑肥厚性硬脊膜炎,转入我科进一步治疗。完善ANA16项:抗核抗体阳性,核颗粒型,滴度1∶100;ANCA检测:p-ANCA阳性,c-ANCA阴性。行腰椎穿刺检查未见脑脊液流出,考虑与椎管梗阻有关。排除其他感染性疾病后予以甲泼尼龙1000 mg qd×3 d→500 mg qd×3 d→250 mg qd×3d,后改为口服强的松50 mg/d逐渐减量,至20 mg/d维持,同时予以甲钴胺、胞磷胆碱等营养神经,卡马西平、加巴喷丁、度洛西汀止痛等治疗,患者双下肢麻木、无力逐渐好转。出院后继续口服强的松逐渐减量。
2019-02-28复查胸椎MRI增强示T8-L2水平脊膜异常信号及增厚,考虑炎性病变如肥厚性脊膜炎,较前片相比,范围缩小;胸椎退行性变,T12椎体呈楔形改变(见图1D)。2019-03-22血沉25(mm/H)↑;2019-06-05复查胸椎MRI增强示T8-L2水平脊膜异常信号及增厚,较前脊膜强化范围缩小,脊髓增粗;胸椎退行性变(见图1E、F)。与2月28日比较见新发强化病灶,提示病情反复,建议继续激素维持,定期复查,必要时加用免疫抑制剂。
1.2 方法 通过中国知网和万方医学网检索关键词“肥厚性硬脊膜炎”和“抗中性粒细胞胞浆抗体或ANCA”;通过Pubmed检索关键词“Hypertrophic Spinal Pachymeningitis”和“anti-neutrophil cytoplasmic antibody或ANCA”,收集2000年1月1日-2019年5月31日所有相关文献报告,再从中筛选出ANCA相关性HSP患者14例(其中国内报告3例),结合本例共15例。采用描述性统计分析该病的流行病学特点、临床表现、MRI特征、治疗及预后情况。
2 结 果
2.1 临床表现 ANCA相关性HSP患者中女性更多见(男性3例,女性12例),男女比例1∶4。受累年龄范围26岁~77岁,平均58岁,50岁以上患者13例(86.7%)。以HSP为首发症状的患者11例(73.3%)。平均发病时间1 m~3 y,多数慢性病程,逐渐加重。
首发症状表现为:颈胸部或腰背部疼痛(80%),截瘫(73.3%),单纯肢体麻木(6.7%),发热(33.3%),尿潴留(6.7%),束带感(6.7%)。早期以受累脊柱部位疼痛为主要表现,可短时间内出现肢体麻木、无力,也可多年缓慢逐渐进展,可出现脊髓半切综合征表现,晚期出现脊髓横贯性损害(见表1)。
2.2 实验室检查 文献报告提及的实验室检查结果中均出现血沉增快、C反应蛋白升高、脑脊液蛋白升高。脑脊液细胞数多数轻度升高(均小于100×106/L),单核为主,亦可正常。ANCA检查中10例p-ANCA阳性(66.7%),3例c-ANCA阳性(20%),两者均阳性1例,1例ANCA指标未细分(见表1)。
2.3 影像学表现 肥厚的硬脊膜在MRI上多呈T1WI等信号,T2WI低信号。所有患者均可见明显强化。全脊柱均可受累,其中胸段受累患者11例(73.3%),颈段受累患者7例(46.7%),腰骶段受累患者3例(20%)。受累硬脊膜范围超过 5个椎体及以上患者12例(80%)。呈连续性条索状强化者14例(93.3%),1例呈结节状强化(6.7%),1例可见两个节段性强化。增强MRI显示,背侧硬脊膜明显增厚者6例(40%),腹侧增厚明显者3例(20%),2例均匀增厚。
2.4 治疗和预后 15例患者中有5例患者行手术治疗,2例患者术后未立即予以糖皮质激素治疗,病情在半年内复发加重,后予以激素治疗后好转。11例患者行糖皮质激素治疗联合免疫抑制剂治疗,4例患者仅予以糖皮质激素治疗,总体预后均可。1例患者在激素减量治疗期间复发(见表1)。
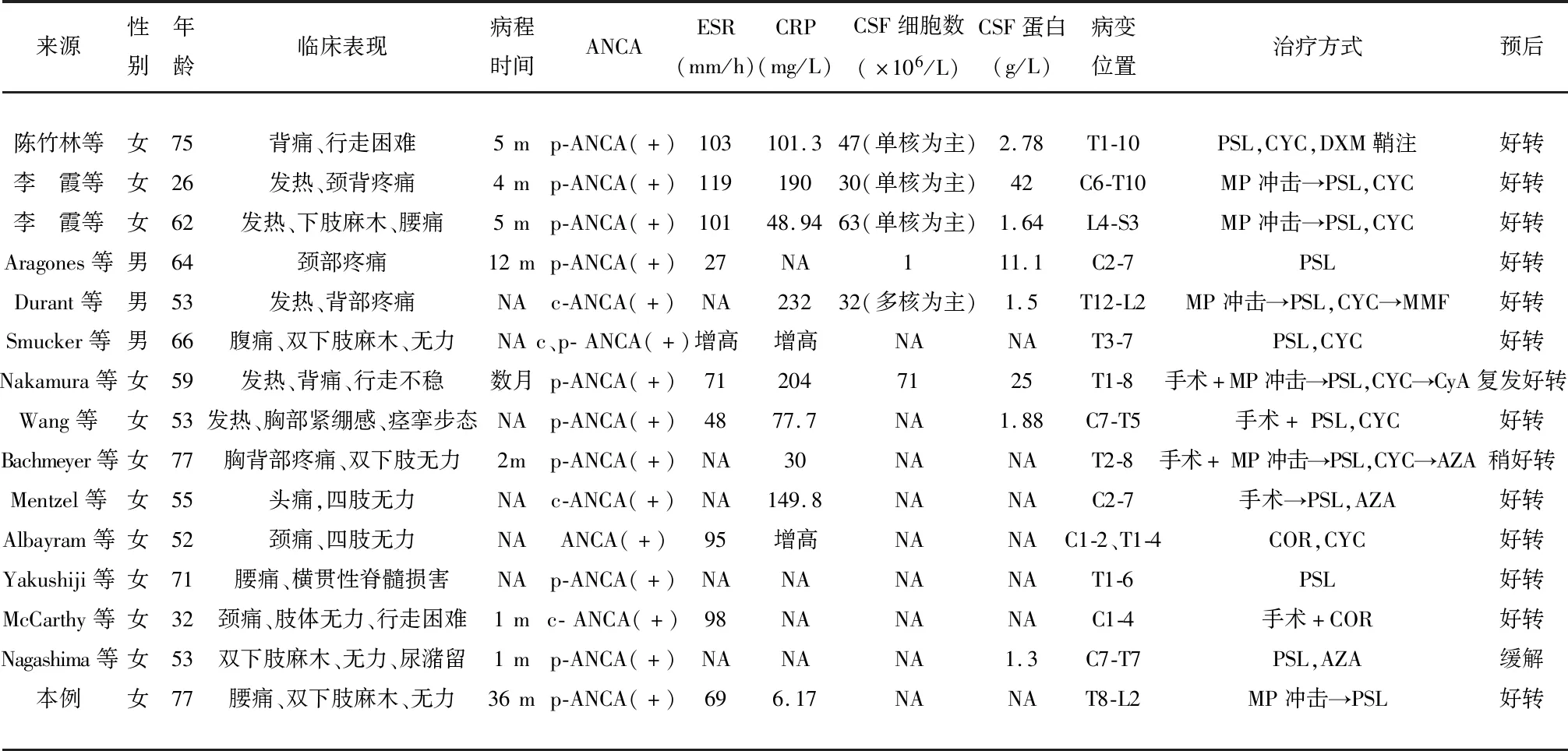
表1 既往和此次报道的ANCA相关性HSP病例回顾
注:ANCA-抗中性粒细胞胞浆抗体;ESR-血沉;CRP-C反应蛋白;CSF-脑脊液;NA-未获得;PSL-泼尼松;CYC-环磷酰胺;DXM-地塞米松;MP-甲基强的松龙;MMF-霉酚酸酯;CyA-环孢素;AZA-硫唑嘌呤;COR-皮质类固醇激素
3 讨 论
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎(ANCA-associated vasculitis,AAV)是一种可累及全身多系统的自身免疫性疾病,主要病理特征是小血管壁炎症和纤维素样坏死,主要累及小血管(如实质内小动脉、毛细血管和小静脉),无明显免疫复合物沉积[2]。目前AAV主要包括肉芽肿性多血管炎、显微镜下多血管炎及嗜酸性肉芽肿性多血管炎[3]。AAV可累及肺部、肾脏、皮肤、胃肠道及神经等多个系统,其中神经系统病变是除呼吸系统和肾脏之外AAV最常见的临床表现之一,甚至在部分患者中可作为首发症状[4]。在AAV相关的神经系统病变中以周围神经病、缺血性、出血性、癫痫和脑病为常见,肥厚性硬膜炎(Hypertrophic Pachymeningitis,HP)是AAV引起神经系统损害的少见形式[5]。
HP是一种以硬脑膜和(或)硬脊膜炎性纤维化和增厚为特征的少见疾病,以肥厚性硬脑膜炎最为多见,HSP少见。1869年Charcot和Joffroy首次描述了HSP,但由于少见,病例报告很少。其特征在于硬脊膜的肥厚性炎症和从局部疼痛到脊髓病的临床症状。Yonekawa等[6]研究发现,HP疾病中特发性最常见,其次为ANCA相关性HP,IgG4相关性少见。本研究发现ANCA相关性HSP患者女性多见,男女比例1∶4,平均年龄在58岁,多数呈慢性病程,进行性加重。与Yonekawa等研究的结果相一致。与之明显不同的是,Winkel等[7]报告IgG4相关性HSP中男性患者多见(男女比例2.2∶1),平均发病年龄48岁。
本研究发现ANCA相关性HSP患者中首发症状为神经系统表现的占73.3%,临床症状以局部疼痛或根痛、神经根或脊髓受压为主要表现,出现发热等全身症状占33%。张仲迎等[4]调查发现以神经系统表现为首发症状的ANCA相关性血管炎确诊时间最长,预后与确诊时间长短有关。本研究统计的相关文献显示从出现症状到诊断的时间不等,短则1 m,长者数年,诊断较困难。对于HSP的发病过程,Charcot和Joffroy描述了3个阶段:第一阶段是疼痛(局部或根性);第二阶段有神经根压迫的临床症状;第三阶段的特征是脊髓压迫。但本研究显示多数患者进展缓慢,3个阶段存在部分重叠,也有少数患者进展迅速,短时间内出现截瘫等脊髓横贯性损害的表现。
本研究发现ANCA相关性HSP患者全身炎症指标(如血沉、C反应蛋白等)不同程度的升高,脑脊液蛋白升高明显,有核细胞数轻度升高或正常,单核为主,提示颅内及椎管内炎症性病变。ANCA检查中以p-ANCA(+)最为多见。Li等[8]调查发现在中国人群中显微镜下多血管炎具有惊人的优势,p-ANCA比c-ANCA更常见。本研究的结果与其一致,提示虽然ANCA相关性HSP是AAV的少见类型,但其主要特点不变。与其不同的是,IgG4相关性HSP 中仅有22%患者血清IgG4(+),多数患者依赖于组织病理学检查才能明确诊断[7]。
MRI是目前最有效的影像学检查方法,增厚的硬脊膜在常规MRI平扫上表现为T1WI等或低信号,T2WI低信号[9]。增强MRI可见明显强化,多呈条索状,背侧硬脊膜较腹侧增厚明显[10]。胸段受累最常见,其次是颈段、腰骶段。受累病变节段较长,通常超过5个椎体节段,脊髓有不同程度的受压甚至变性[11]。本研究统计的影像学表现与上述表现相同,提示MRI检查仅能辅助HSP的诊断,无法鉴别不同病因。因此对于影像学考虑HSP患者应常规行ANCA、IgG4检测进一步明确病因。目前关于HSP的治疗尚未形成指南共识[12],对于ANCA相关性HSP多使用AAV的治疗方案,主张糖皮质激素联合免疫抑制剂治疗,多数预后良好。本文分析认为手术治疗虽然短期内能够缓解临床症状,但容易复发,术后仍应糖皮质激素联合免疫抑制剂治疗。
当脊柱外科或神经科医生接诊脊髓压迫症患者时,需要警惕HSP。当老年女性伴随有血沉增快、C反应蛋白升高等其他表现时需要考虑有无ANCA相关性HSP可能。进一步的ANCA 检测及MRI增强检查有助于诊断,避免误诊误治。
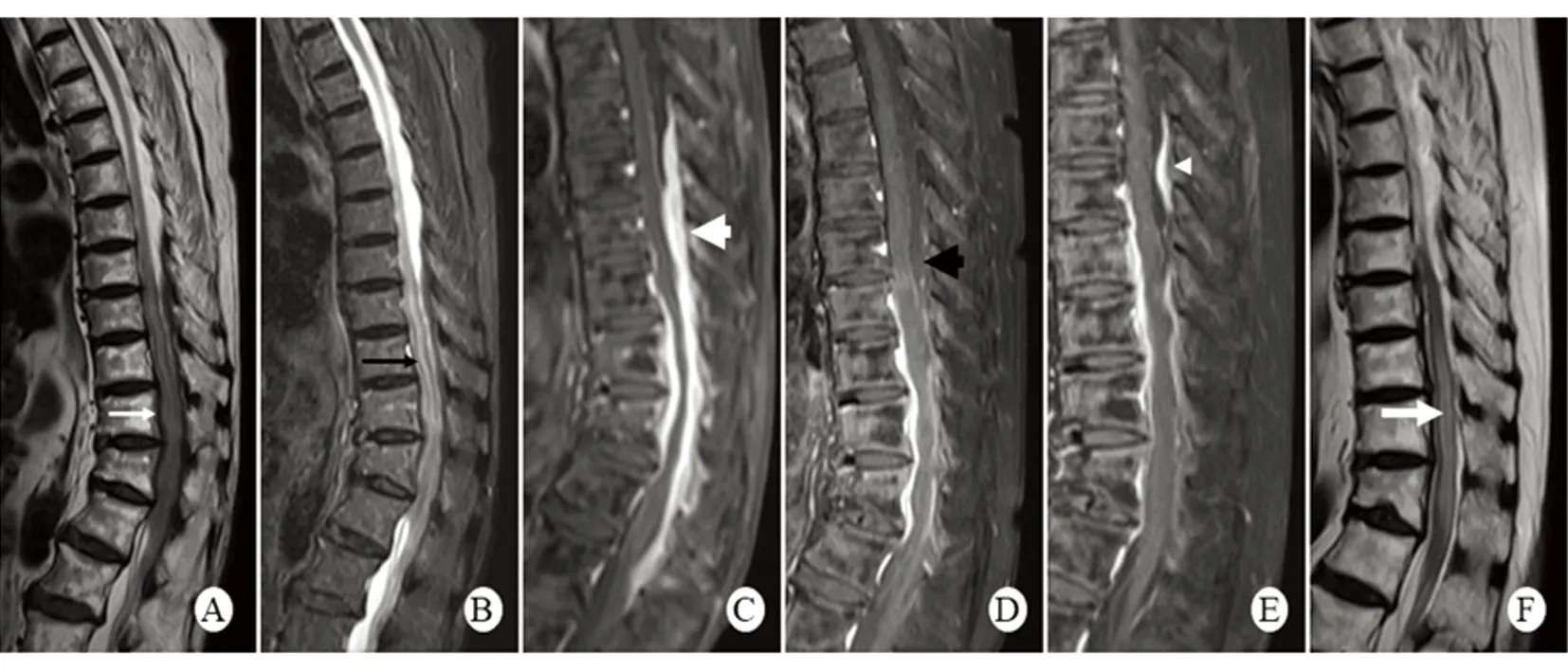
图A和B显示入院时椎管内短T2异常信号物质填充(白色细箭头),脊髓内稍长T2异常信号(黑色细箭头);图C增强可见脊膜强化明显(白色粗箭头),脊髓受压变细;图D显示2月28日复查胸椎MRI增强见脊膜强化较前明显减轻(黑色粗箭头);图E和图F显示6月5日复查胸椎MR平扫+增强见脊膜强化较前减轻,较2月28日出现新发强化病灶(白色小三角),脊髓受压变性(白色粗箭头)
图1 患者入院时及后续复查胸椎MRI表现

