影响无症状糖尿病周围神经病变神经传导速度的相关因素分析
宋欢欢,杨 赞,周建国,符大勇
胰岛素相对或绝对分泌不足、以及作用缺陷是导致糖尿病(diabetes mellitus,DM)发生的原因,作为一种代谢性疾病,可引起多系统多器官损害,尤其是神经系统。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)可导致患者出现肢体疼痛、无力、麻木等感觉异常症状,尤以夜间为著,严重影响患者生活质量[1],由于其具有发病隐匿及神经损害不可逆的特征,所以早发现、早干预及早治疗与患者临床治疗效果及预后密切相关。本研究通过利用神经传导速度(nerve conduction velocity,NCV)检测早期无周围神经损害症状的2型糖尿病(Type 2 diabetes mellitus,2DM)患者,发现无症状糖尿病周围神经病变(asymptomatic diabetic peripheral neuropathy,ADPN),并分析影响NCV异常改变的相关因素,报道如下。
1 资料与方法
1.1 研究对象 收集2016年12月-2018年3月经南京中医药大学连云港附属医院糖尿病科收治入院的T2DM患者79例作为研究对象,男58例,女21例,年龄25~81岁(53.33±13.17)岁。入组标准:(1)符合《中国2型糖尿病防治指南(2017版)》中的T2DM诊断标准[2];(2)确诊T2DM病程≤60 m;(3)患者未出现周围神经损害的相关症状及体征。排除标准:(1)恶性肿瘤导致的神经损害;(2)酒精中毒、急慢性感染、营养障碍导致的周围神经损害;(3)遗传性及其他严重代谢疾病导致的周围神经损害。根据NCV检测分为NCV正常组(45例)与NCV异常组(34例)。
1.2 仪器与方法 (1)NCV检测:应用美国Nicolet公司8通道EDX肌电图/诱发电位仪,受检患者在恒温、安静的屏蔽室内,选取上、下肢运动、感觉神经各一条,包括正中神经、尺神经、腓总神经、腓肠神经。记录参数:运动传导速度(motor nerve conduction velocity,MNCV)、感觉传导速度(sensory nerve conduction velocity,SNCV)、复合肌肉动作电位(compound muscle action potential,CMAP)波幅、感觉神经动作电位(sensory nerve action potential,SNAP)波幅。(2)临床资料:年龄、性别、病程、吸烟及饮酒史,测量入院当天的身高、体重、腰围计算体质指数(BMI)、指尖随机血糖、收缩压及舒张压(患者卧床测量右臂肱动脉血压3次,每次间隔5 min,记录平均值)。(3)生化检查项目:三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、空腹血糖(FPG)、糖化血红蛋白。NCV检测异常的诊断标准:结合本肌电图室正常参考值(±2 sd),符合任意一条为神经异常:(1)MNCV、SNCV<正常值-2 sd;(2)CMAP波幅、SNAP波幅<正常值-2 sd,有2条不同肢体、不同神经异常即为NCV检测异常[3]。
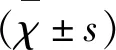
2 结 果
2.1 经NCV检测分组比较结果 NCV异常组与NCV正常组比较显示正中神经、尺神经CMAP波幅降低不显著P>0.05;腓总神经CMAP波幅降低P<0.05,正中神经、尺神经、腓总神经MNCV减慢P<0.05;正中神经、尺神经、腓肠神经SNCV减慢、SNAP波幅降低<0.05(见表1、表2)。
2.2 影响NCV异常的单因素变量分析结果 NCV正常组与异常组临床资料中年龄、病程、腰围、BMI、FBG、HbA1c、随机血糖组间差异有统计学意义(P<0.05);但在性别、吸烟饮酒史、SBP、DBP、TC、TG、LDL-C组间差异无统计学意义(P>0.05)(见表3)。
2.3 二元Logistic回归分析结果 通过单因素分析年龄、病程、腰围、BMI、FBG、HbA1c、随机血糖为危险因素及自变量,NCV是否异常为因变量,显示病程、BMI、HbA1c是导致ADPN中NCV异常的独立危险因素(P<0.05)(见表4)。
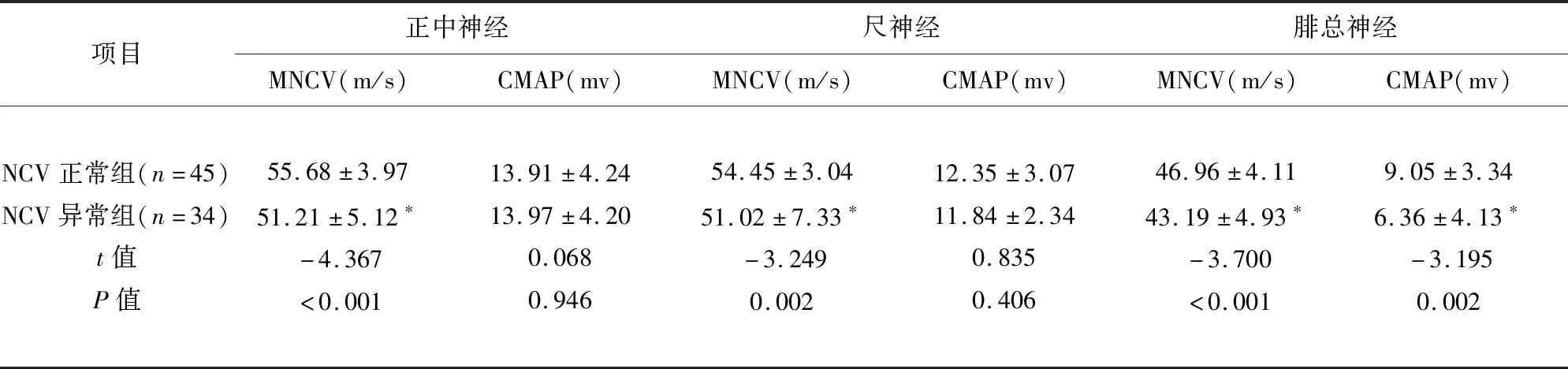
表1 NCV正常组与NCV异常组运动神经比较结果
与NCV正常组比较*P<0.05,为差异有统计学意义
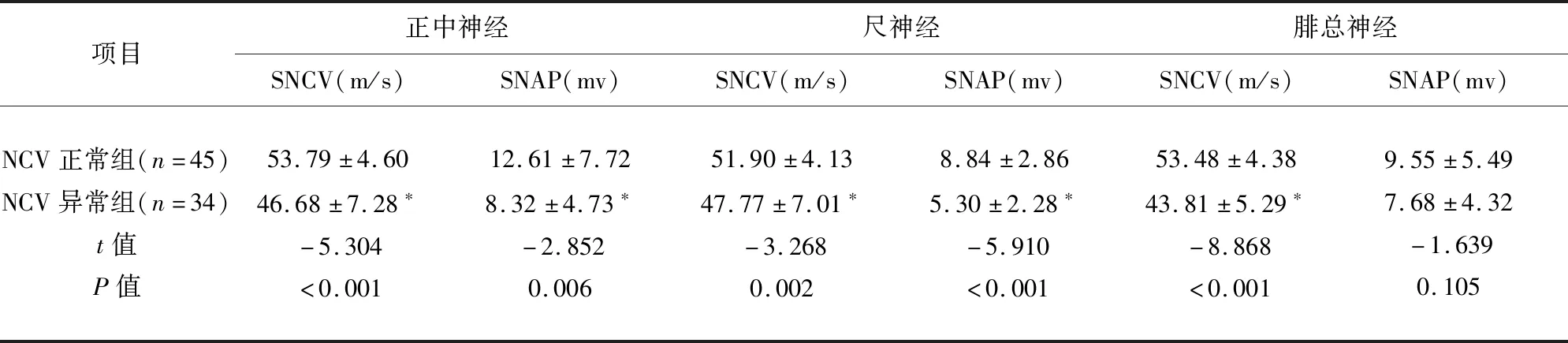
表2 NCV正常组与NCV异常组感觉神经比较结果
与NCV正常组比较*P<0.05,为差异有统计学意义
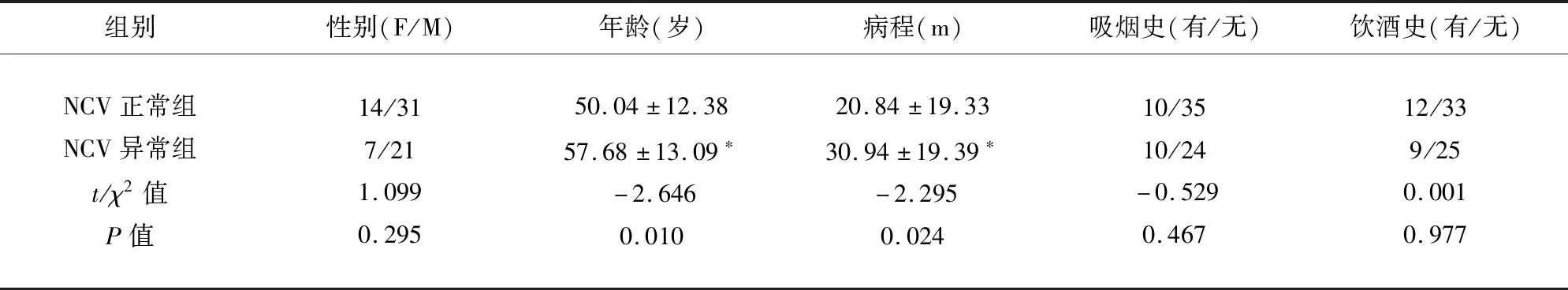
表3 NCV正常组与NCV异常组一般临床资料比较结果
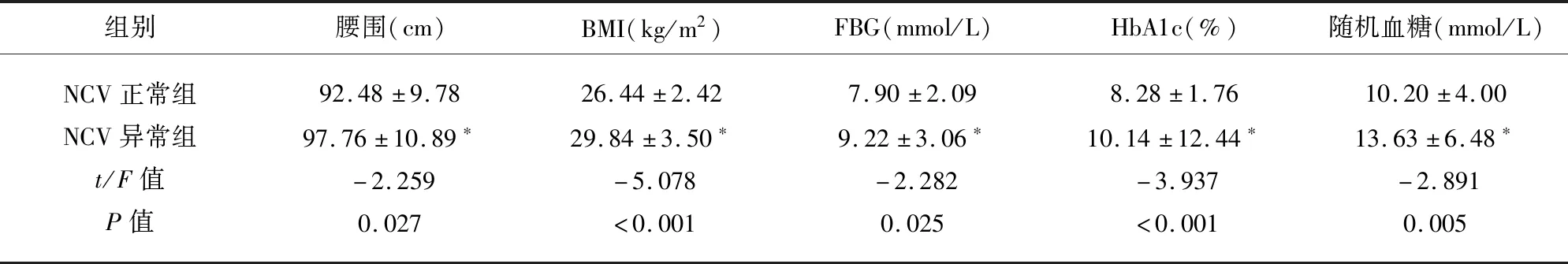
组别腰围(cm)BMI(kg/m2)FBG(mmol/L)HbA1c(%)随机血糖(mmol/L)NCV正常组NCV异常组t/F值P值92.48±9.7897.76±10.89∗-2.2590.02726.44±2.4229.84±3.50∗-5.078<0.0017.90±2.099.22±3.06∗-2.2820.0258.28±1.7610.14±12.44∗-3.937<0.00110.20±4.0013.63±6.48∗-2.8910.005
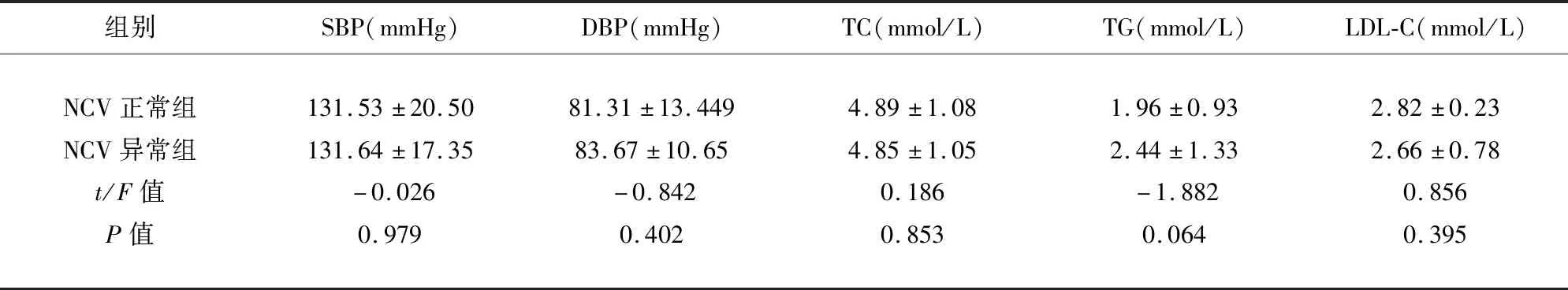
组别SBP(mmHg)DBP(mmHg)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)NCV正常组NCV异常组t/F值P值131.53±20.50131.64±17.35-0.0260.97981.31±13.44983.67±10.65-0.8420.4024.89±1.084.85±1.050.1860.8531.96±0.932.44±1.33-1.8820.0642.82±0.232.66±0.780.8560.395
与NCV正常组比较*P<0.05,为差异有统计学意义
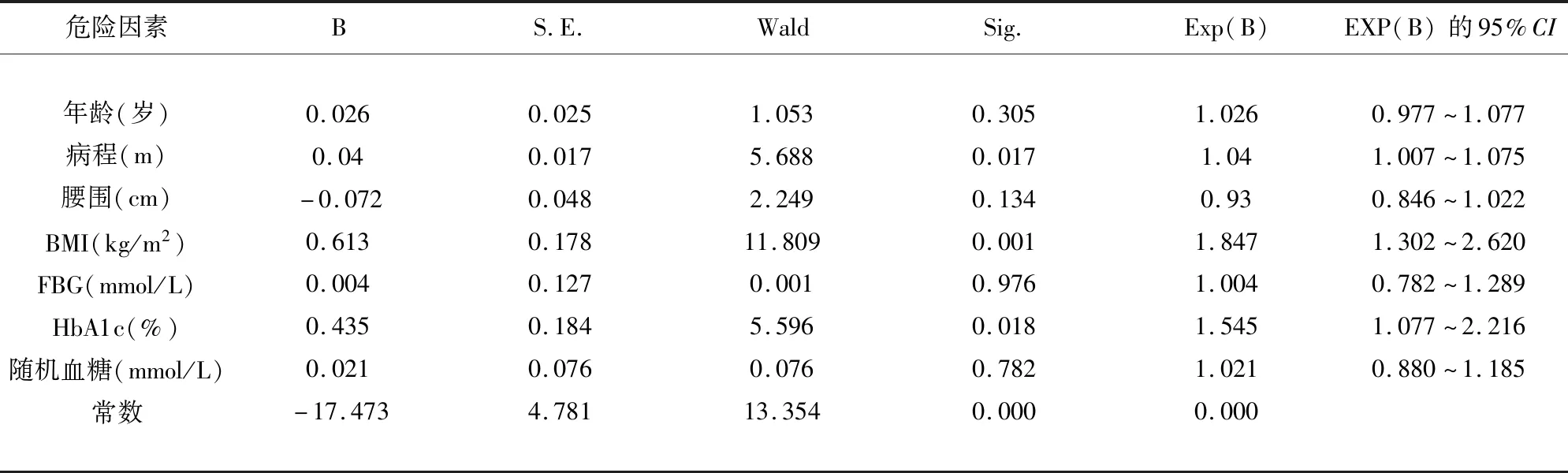
表4 二元Logistic回归分析结果
3 讨 论
DPN是DM神经病变中最为常见的类型,由于其临床症状及体征表现多样,且进行性加重,严重影响患者的生活质量[4]。目前,对于DPN的检测方法繁多,其中NCV检测主要用于周围神经远端(运动、感觉神经)的检测,是诊断DPN的“金标准”[5]。在早期DPN患者未出现相应周围神经损害的临床症状和体征时,可仅表现为NCV检测异常[2],由于DPN患者一旦出现临床症状和体征,其神经损害将难以恢复。所以通过NCV检测技术早期发现ADPN并分析其影响因素,使患者能够早期采取相应治疗措施,更好地预防和延缓ADPN的发生。
目前,DPN的发生机制由多种原因共同参与所导致,包括:氧化应激引发自由基损伤、多元醇通路代谢异常、微循环障碍所致缺血缺氧等[6]。本研究通过分析NCV异常组与NCV正常组患者的一般资料及生化指标发现:年龄、病程、腰围、BMI、FBG、HbA1c、随机血糖有统计学差异,同时显示病程、BMI、HbA1c是导致ADPN中NCV异常的独立危险因素。FBG、随机血糖、HbA1c水平增高说明患者处于高糖状态,既往研究亦证实高血糖是DPN的重要危险因素[1],这与本次研究ADPN的危险因素结果相符。机体长期处于高糖状态,神经纤维发生肿胀、变性甚至坏死,导致神经脱髓鞘,从而影响NCV检测值[7]。FBG、随机血糖、HbA1c在两组间比较有统计学差异,但只有HbA1c是ADPN的独立危险因素,分析原因可能为:FBG及随机血糖是反映一个时间点的血糖,而HbA1c主要反映机体在3个月内的血糖情况,也可间接反映患者8~12 w内血糖的调控的稳定性,HbA1c为血液中血红蛋白与血糖结合的产物,其可以改变细胞的含氧量,HbA1c的增加会导致细胞组织缺氧加剧神经损伤[8]。所以要做到长期有效并且平稳的控制血糖,才能延缓神经的损伤。
既往研究[9]显示DPN在DM病程>5 y的发生率较高,本研究选取病程≤60个月的T2DM患者,仍然得出病程是发生ADPN的独立危险因素,随着病程的延长,NCV检测神经异常数也随之增加。分析原因为:随着病程的延长,血糖控制的难度加大,主要是由于胰岛功能随病程而衰退,即B细胞功能呈进行性损害,同时数量也随之减少所致。患者体内糖代谢异常越显著,产生并发症的可能性就越大。另外,有研究[10]发现随着DM病程的延长,神经细胞在数量上也有一定程度的减少,机体神经损害的程度有所加重,将进一步发展为DPN,这与本研究数据相一致。本研究结果也显示腰围与BMI单因素分析均有统计学意义,且BMI为独立危险因素。
综上所述,对于无周围神经损害的T2DM患者应该定期做NCV检测,筛查是否存在ADPN,为临床早期诊疗提供依据。同时为防止ADPN的发生,需保持长期血糖平稳,以及采取正确的生活方式,通过控制饮食、适当锻炼等控制BMI值。本次研究病例较少,且未能追踪NCV检测异常的患者在相应治疗后的NCV改变,有待于进一步随访研究。

