细胞测温技术及其在药物研发中的应用前景
何伟男,严森,顾宁
(东南大学生物科学与医学工程学院,江苏省生物材料与器件重点实验室,江苏 南京 210000)
细胞是生命体结构和功能最基本的单位,可分为原核细胞与真核细胞两大类[1-2]。以真核细胞为例,细胞核负责合成和储存DNA[3]。内质网负责合成和运输蛋白质[4]。线粒体和植物中的叶绿体主要负责产生细胞能量,通过控制水解三磷酸腺苷 (ATP) 来释放能量[5],其中部分有ATP参与的生化反应会引起线粒体跨膜电势的改变,这与细胞内热的产生密切相关[6-7]。适宜的温度是细胞生存和发展最基本的条件,由于细胞内各种生化反应的不断进行,细胞温度时刻发生变化[8]。细胞的增殖、分化、代谢活动以及病理变化都会引起细胞温度的波动[9-11]。洞察活细胞温度变化不仅有助于了解细胞的各种生理活动,而且能够促进疾病诊断和药物研发技术的发展。本文从基于发光式细胞测温和非发光式细胞测温两方面对细胞测温技术进行研究,并对其在药物研发中的应用进行了展望。
1 细胞温度
细胞温度在生命活动中起着重要的作用,这使得细胞测温技术成为前沿研究课题。细胞温度相关的研究已经逐渐深入到众多生命科学研究领域,如图1所示,近些年所发表的细胞温度研究的论文涉及了生物化学、生物技术、生理学、药理学等研究,体现了温度在细胞生物研究领域的重要性。由于细胞的复杂特性,如何在微纳尺度上实现准确稳定的温度测量,成为目前亟待解决的问题[12]。1994年Kallerhoff团队[13]通过微量热量计检测了细胞群体的温度变化,通过产热功率的大小成功地区分出正常组织和癌症组织。然而不同的组织之间,细胞的形态功能不同,甚至在同一组织中,细胞与细胞之间仍然存在差异 (物质组成差异、结构功能差异、基因表达差异、应急响应模式差异等)。对于细胞群体的分析往往忽略了细胞之间的差异性,进而导致结果的准确性较差。Paulik等[14]利用红外热成像技术对单个细胞的产热过程进行了检测,但由于细胞的不均匀性和极小尺寸导致红外热像仪无法获取有效的信息。

图1 细胞测温应用领域 (数据来源:Web of Science)
以单个细胞作为研究对象,能够帮助研究者更好地了解细胞之间的差异性,掌握细胞群体中某些特殊的细胞功能。随着单细胞分析技术的发展,细胞形貌、行为动作、信号转导、物理性质等均成为研究的热门。细胞作为研究对象具有以下特点:细胞体积小 (直径为10~20 μm)、信号微弱、细胞内环境复杂多变以及细胞状态敏感等。因此,细胞测温技术需要满足高灵敏性、高时空分辨率以及抗干扰能力等要求[15]。随着纳米技术的发展,涌现出许多新型有效的测温技术,包括有机荧光团、量子点、微纳热电偶和一些复合材料等[16-19](见图2),Bai课题组[8]和Brites课题组[15]也分别做过细胞测温技术方面的综述。在先进技术的支持下,细胞温度的变化规律逐渐被掌握,尤其是在细胞受到外界刺激时 (光热刺激[20-22]、药物刺激[23-24]、离子浓度变化[22,25]等) 产生的温度变化,有望为药物研发提供新的研究途径。
图2 细胞测温技术
2 细胞测温技术
2.1 发光式细胞测温 光学成像技术一直是探究生物组织和细胞的有力手段,发光式细胞温度计与现有的成像技术结合使细胞测温成为可能。非侵入式和不需要接触测量的优点使其在特定场合得到广泛使用。随着纳米技术的发展,荧光探针的尺寸已经达到纳米尺度。发光式测温方法可以通过测温探针的荧光强度、最大发射波长或者荧光寿命变化将细胞温度实时反映出来[15,26],具有很好的空间分辨率、温度分辨率以及数据收集能力。虽然荧光探针在稳定性以及准确性上存在局限,但近年来一直是活细胞热成像的研究重点。
1941年有机荧光团被发现存在与温度有关的特性[27],Huang等[28]以DyLight549荧光团作为温度计,对靶向于表达TPRV1的细胞膜上特定蛋白的纳米颗粒进行温度监控,在射频磁场的作用下,MnFe2O4磁性纳米颗粒在短短15 s的时间内温度升高了15 ℃。监测DyLight549荧光团发现,细胞通道的局部产热触发了神经元的动作电位,从而激活了细胞的某种行为。该方法有望在不损伤细胞的同时操控细胞行为,为远程细胞诊疗提供一种新途径。Suzuki等[25]利用填充热敏荧光染料 (Eu-TTA) 的微玻璃管检测了单个HeLa细胞的产热,单个HeLa细胞在离子霉素的刺激下导致细胞内外钙离子浓度变化,从而引起细胞温度的改变。实验中通过毒胡萝卜素抑制了细胞Ca2+-ATPases的功能,添加离子霉素刺激胞内钙离子流动后,观察到细胞温度升高被抑制,这说明在细胞产热的级联过程中,Ca2+浓度以及Ca2+-ATPases起着关键作用,证实药物刺激会导致细胞温度发生变化。随着荧光探针深入到亚细胞水平上,部分细胞器的温度传感器也被设计出来。Homma课题组[29]设计了由两种罗丹明染料 (Rhodamine B和CS NIR dye) 组成的温度探针 (Mito-RTP),探针结合了二者的优点,能够融入到细胞的线粒体中,同时不受细胞生理环境的干扰。由于Rhodamine B染料的荧光强度对温度变化有可逆的响应,而CS NIR dye的荧光强度是恒定的,所以通过检测这两种染料荧光强度的比值变化,可以实时检测线粒体的温度情况。Arai团队[30]开发了一种选择性靶向内质网的荧光温度计 (ER thermo yellow),温度灵敏度达到3.9%/℃。该温度计避免了聚集问题,可以均匀的将目标细胞器染色,并通过改变细胞外部介质的温度,验证了结合ER thermo yellow的HeLa细胞的温度敏感性。对于靶向细胞器的药物来说,通过观察温度变化评估药物作用效果不失为一种新的观察视角。Uchiyama团队[31]致力于研发用于细胞温度检测的荧光探针,2011年首次向外公布了单个细胞的温度图谱 (见图3)。通过荧光寿命成像显微镜,基于荧光聚合物温度计的空间分辨率达到200 nm,温度分辨率在0.18~0.58 ℃之间。观测单个COS细胞温度发现,细胞核与中心体的温度明显高于细胞质,说明同一个细胞内不同的细胞器之间存在着各自的温度特性。
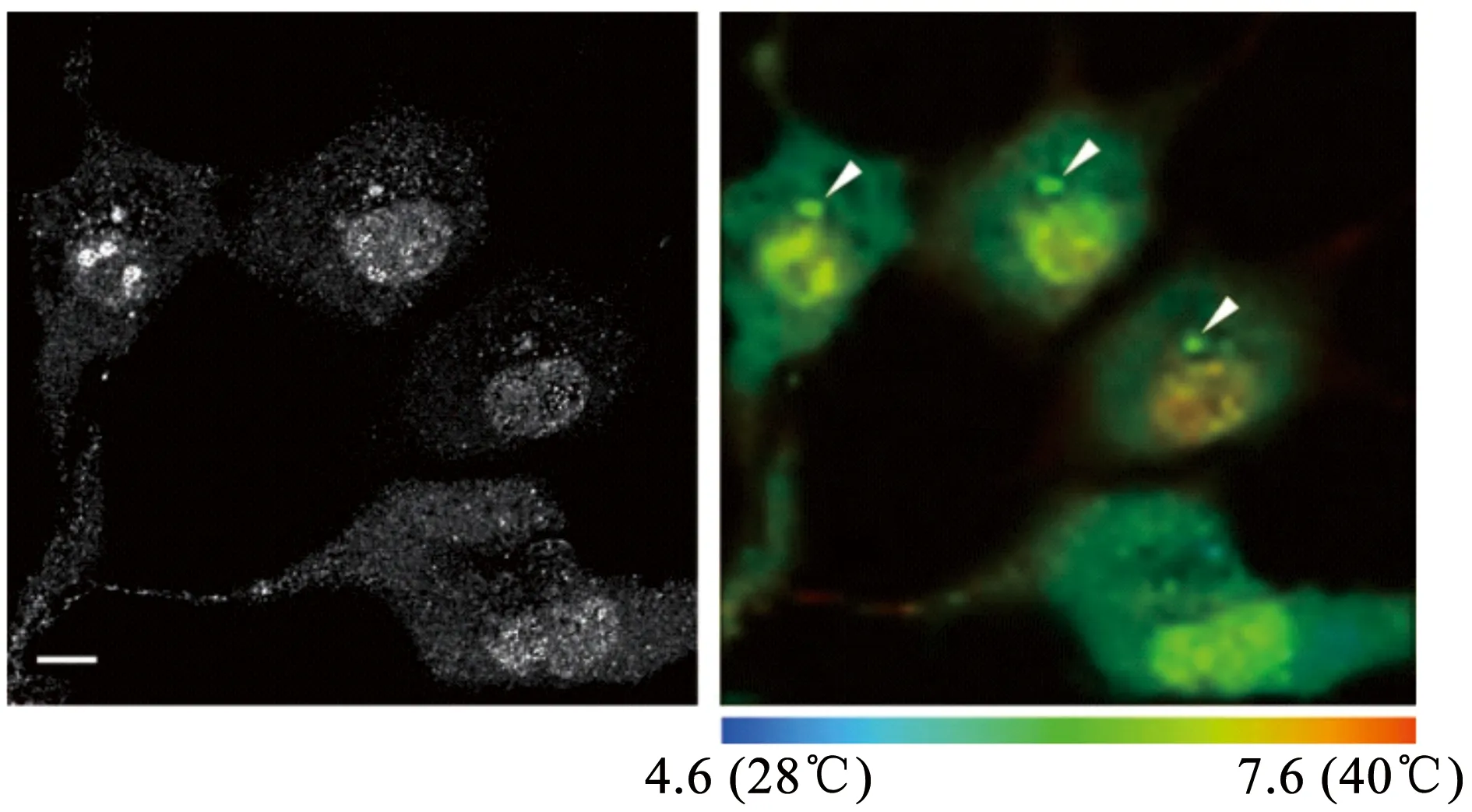
图3 单细胞温度图谱
材料本身与温度相关的特性可用于细胞温度测量。通过光强变化以及发射峰位移,量子点能够准确地反映温度波动。例如Yang等[21]利用量子点的光致发光光谱绘制了Ca2+刺激和冷休克后NIH/3T3细胞内的热产生,实现了对细胞内部不均匀温度的直接观察,有利于实时掌握细胞内信号调控的进程。在双光子激发下,硒化镉 (CdSe) 量子点发射光的温度灵敏度更高,热成像质量更好,Maestro等[32]成功应用于单个HeLa细胞的温度测量。与量子点不同,纳米级金属团簇的荧光寿命在生理范围内会随着温度的变化而变化。纳米金属团簇拥有更小的尺寸、良好的生物相容性以及较高的温度敏感性,同样也被认为是一种优良的荧光温度计[33],常见的主要有金纳米团簇[34]、铜纳米团簇[35]等。Shang团队[34]将脂酸包裹的金纳米团簇 (AuNCs) 通过内吞作用导入到HeLa细胞中,当改变细胞周围环境温度时,来自HeLa细胞内部的AuNCs产生了600~1 000 ns的荧光寿命,并且随着温度的升高,荧光寿命明显降低。基于生物分子如蛋白质[36]和DNA[37-38]的温度计,能够准确地嵌入到细胞内部。Donner等[36]将绿色荧光蛋白 (GFP) 作为温度纳米探针,在转染GFP的癌细胞上进行了测试,利用细胞周围的金纳米棒加热细胞,检测荧光偏振各向异性,实现了温度的实时表征。这种方法为分子生物学的诊断与治疗提供了非侵入式的有效工具。
2.2 非发光式细胞测温 本节主要介绍微纳尺度下的温度测量工具,其温度特性与发光无直接关系。1986年,Williams和Wickramasinghe发明了一种超高空间分辨率的测温设备,被称为扫描热显微镜[39]。扫描热探针在扫描隧道显微镜以及原子力显微镜的平台上得以发挥作用,基于热电效应及其它物理性质的微纳探针可用于检测物体表面的温度。Sadat等[40]基于原子力显微镜 (AFM),利用镀铂的AFM悬臂创建点接触热电偶,将接触点电压值与局部温度联系起来,拥有小于100 nm的空间分辨率和10 mK的温度分辨率。Haeberle等[41]改进AFM的悬梁臂,采用焦耳加热的电阻器提高热导率测量中的分辨率,通过对脂质体、人体毛发和胶原样品的热导率测定,证实了该方法的可行性。随着气相沉积以及光刻技术的发展,一些传统的温度计实现了纳米尺度的温度观测。普通K型热电偶的热电系数在0.04 mV·℃-1左右,而利用聚焦离子束辅助气相沉积技术制备的纳米金属热电偶则具有超高的热电系数[42],对钨铂纳米金属结表征,其热电系数为5.4 mV·℃-1,这证实了微纳热电偶作为细胞测温工具的潜力。Wang等[23]通过电化学腐蚀法将钨棒腐蚀出纳米级别的针尖,利用有机溶剂四氢呋喃溶解聚氨酯,包裹在腐蚀后的钨棒表面作为绝缘层。利用真空离子溅射仪,在绝缘层上均匀地溅射一层100 nm厚度的金属铂层,巧妙地将热电偶结构集中在纳米尺度的针尖上。利用显微镜与显微操作仪,首次实现了钨铂热电偶的单细胞测温功能。Shrestha团队[43]为追求低成本,易开发的热传感器,改造了玻璃微量吸液管,将低熔点的焊料合金 (Sn) 作为芯材置于玻璃管内,并在管外镀镍薄层,最终在玻璃管尖端构建了热电偶结。通过将制备好的热电偶插入到视网膜色素上皮细胞中,测量了瞬态的细胞温度变化。以热电效应为基础的测温工具在温度分辨率和时间分辨率上表现出极大的优势,为细胞测温研究的发展奠定了重要基础。
Gao等[44]在碳纳米管内填充液态镓制备了新型纳米温度计,其工作原理与水银温度计相似,通过观测液态镓的热膨胀来测量温度。Li等[45]直接将细胞培养在只有2 mm大小的铂电阻上,利用铂电阻的温度敏感性将附着在电阻表面的细胞温度检测出来。该测温装置增加了信号收发模块,实现了细胞温度的无线测量。待测细胞连同测温装置一同放进细胞培养箱中,确保待测细胞处于最合适的生存环境。Inomata等[46]开发了一种独特的测温方法,利用微流控技术制备了一个只能容纳单个细胞通过的流道,当细胞流动到特定位置,细胞产生的热量会传递到一个真空室内,室内的硅谐振热传感器会根据温度的变化而改变谐振器的谐振频率。该装置成功应用到单个棕色脂肪细胞的温度检测,整个过程持续了20 min。
活细胞本身能够感知温度变化,并由此来激活某些蛋白。细胞温度的传感是由蛋白质、核酸和mRNAs来完成的,通过修改其构象结构来响应温度变化[47]。Narberhaus等[48]证实RNA温度计是细胞中感知温度的主要方式。RNA温度计位于RNA结构的某些特定区域,在生理温度范围内保护核糖体结合位点的未翻译区域。当细胞温度下降,细胞会激活冷休克蛋白的表达。这些mRNA蛋白经过结构重排,在低温下形成热力学上更稳定、不易降解的构象,有利于细胞的存活。Shah等[49]计算了不同温度下RNA结构的分布,比较近100种随机选择的mRNA并探究了它们的热敏特性,建立了一种研究RNA随温度变化的新方法。
在过去的研究中,用于细胞内温度测量的技术得到了发展。随着人们认知的提高,细胞生物学研究、疾病诊断治疗以及药物研发等领域都对细胞测温提出了更高的要求。基于发光式的温度计中,有机荧光物质对细胞生理环境要求高,容易受到光漂白的限制,导致无法长时间检测温度;量子点由于自身存在不稳定的毒性,不均一的形态影响发光分布;侵入式的热电偶虽然精度高,响应速度快,不易受细胞环境干扰,但是此测量方法往往会损坏细胞的完整性;基于生物结构的温度计,往往选择性高,不能有效地应用到其他细胞中。因此,细胞测温技术仍处于初级阶段,还需要进一步的探索。
3 基于细胞温度检测的药物研发前景
3.1 药物筛选 药物研发是对潜在药物的识别、发现、设计和合成,必须在实验室中进行广泛的表征和生物活性以及安全性的评估测试,然后才能在人体上进行一系列的临床实验,最终将所有的实验信息汇总进行审批。研究表明,药物研发从发现测试到最终的审批过程平均需要10~15年的时间,这是一个漫长且充满风险的过程。药物的发现和开发需要大量的资源和时间,新药开发的成本也在不断增加。药物研发不仅要达到预防和治疗疾病的要求,还要在安全性、可靠性等方面提供保障。药物筛选作为药物研发阶段的关键一步,决定着整个研发过程的进展。细胞测温技术不仅可以快速获取准确的细胞信息,而且能够从细胞甚至亚细胞层面提高药物筛选效率,加快研发进展。
随着技术的发展和各学科领域之间的相互配合,有效药物的发现过程变得更加顺利。细胞内温度的变化可以反映细胞在受到内外界刺激下的许多信息。这种新维度的评估方式对于目前的药物筛选有着重要启发。事实上细胞之间是存在差异性的,细胞结构、蛋白质合成以及基因的表达均有不同。过去,由于技术水平的限制,样品分析往往针对细胞群体,导致细胞特异信号的平均化。随着细胞测温技术的引入,在单细胞水平上进行信号检测、药物筛选成为可能。例如Wang等[23]通过微纳热电偶测量了单个人脑胶质瘤细胞 (U251) 在加入不同抗肿瘤药物后的温度变化,其中只有在加入喜树碱 (CPT) 后,细胞温度升高了0.5 ℃左右 (见图4)。相同的结果由Gota团队[24]在COS7细胞中发现,喜树碱是DNA拓扑异构酶Ⅰ的抑制剂,在细胞进行DNA复制过程中造成细胞损伤,最终导致细胞死亡。作为细胞周期特异性药物,喜树碱对S期阶段的细胞具有更明显的影响,这一特性在温度检测中被证实。Zohar团队[50]利用热成像技术发现,乙酰胆碱刺激后的细胞可以产生一种被阿托品阻断的双相热波,而阿托品本身可以在细胞中产生单相热波,表明它与受体的相互作用同时激活了细胞的一些代谢途径。温度的变化与药物的作用机制相对应,因此可以通过对细胞温度进行监测实现药物的筛选。
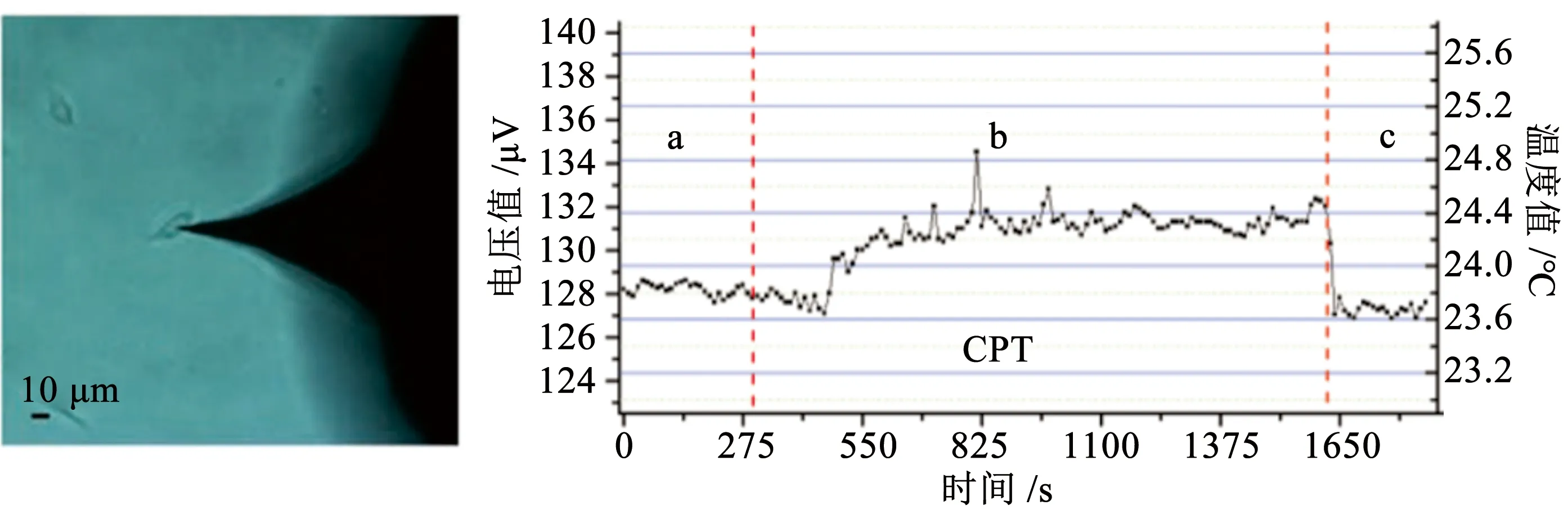
图4 喜树碱(CPT)刺激后细胞温度变化[23]
3.2 药物分析 在药物研发过程中,对于药物的药代动力学和治疗效果的分析评估也至关重要。在药物研发的初期,通过体外模拟药物在体内的作用过程,不仅节约了成本而且简单高效。在药物分析过程中,为了检测药物作用效果以及安全性,需要定量分析药物在细胞内的吸收、分布以及代谢的规律。然而细胞的生长和分化过程复杂多变,传统的技术手段不能实时有效地反映药物作用过程。细胞测温技术通过监测热量的方式获取空间和时间分辨率的信息,实时追踪特定细胞的信号更新。随着测量分辨率的进一步提高,药物在细胞水平上的定位成为可能,这也是目前药物研究中一个重要的信息缺口,多样的测温技术在精准定量分析和追踪药物功效方面将会展现出巨大的潜力。随着技术的革新,细胞测温技术的分析已经达到亚细胞的水平,可以实现从细胞膜、细胞质、线粒体、内质网以及细胞核等全方位的温度监控,从而精确监测药物作用细胞后的动态变化。例如前文介绍的Uchiyama小组[31]通过荧光寿命绘制了单个细胞的温度分布,可以清晰地观测到各个细胞器的温度,证实处于不同活跃状态的细胞器之间的温度是不同的,频繁进行生化反应的场所 (细胞核、线粒体等) 反映出更高的热量变化。Takei团队[51]通过特制的比色纳米温度计成功地追踪到由离子霉素引起的单个细胞的温度变化。离子霉素是对钙离子有亲和力的离子载体,在细胞中会引起钙离子浓度改变从而导致细胞温度变化,不同部位温度的升高表明细胞内产生了不同程度的热量 (见图5),从温度视角分析药代动力学,有助于评估药物作用的详细靶点。Inomata团队[46]探究了去甲肾上腺素对棕色脂肪细胞的影响,刺激后的细胞持续释放热量,可用于统计药物作用的反应时间。Gota团队[24]和Suzuki团队[25]等分别尝试了通过调控细胞代谢产物浓度来改变细胞温度,相似的药物作用机理也可以通过细胞温度改变来逆向推导,有利于药物功效的准确分析。
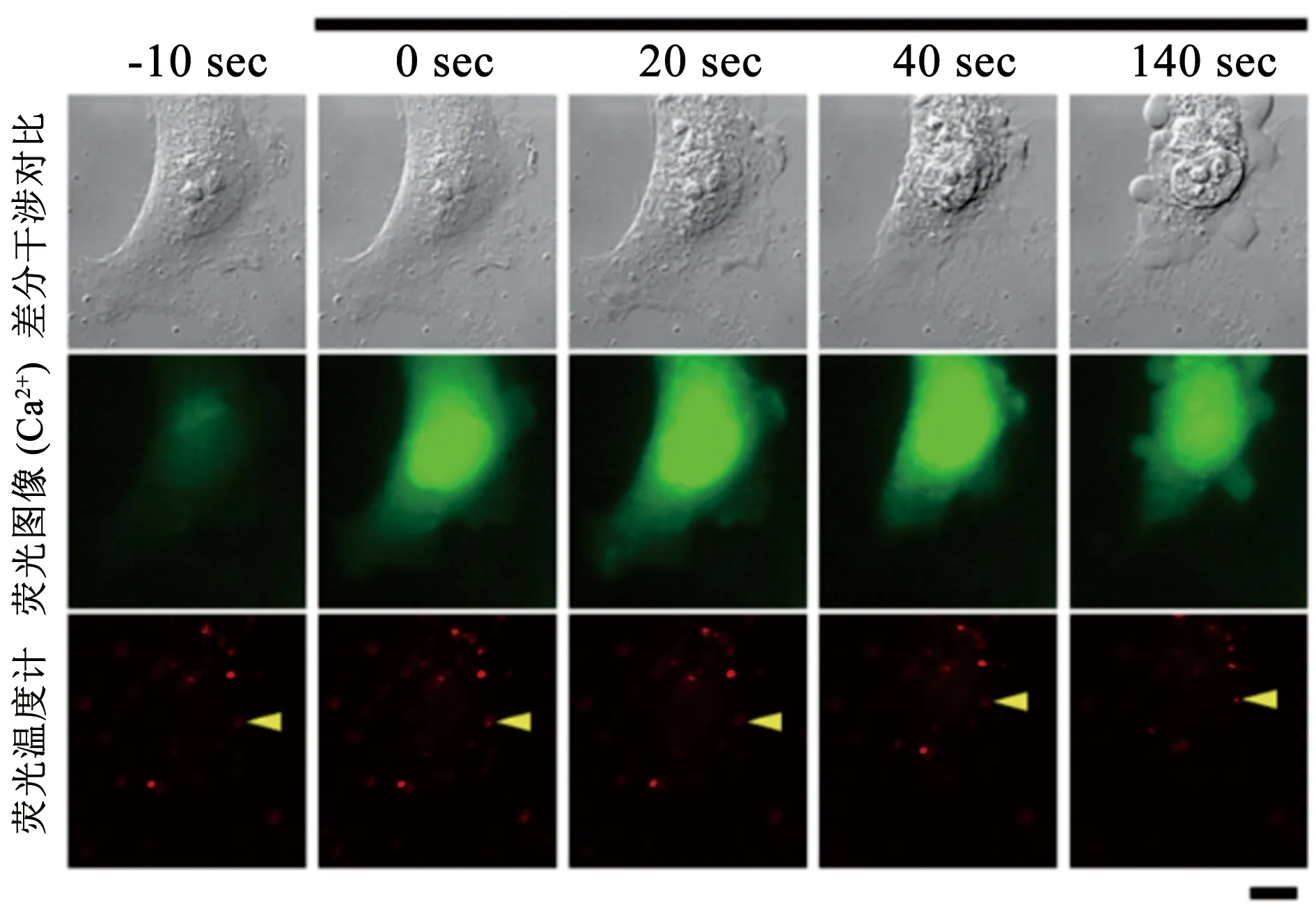
图5 离子霉素诱导下细胞温度非均匀变化
3.3 治疗方案设计 临床上治疗方案的设计直接影响药物发挥的效果。对于用药时间、最佳剂量以及给药间隔的把控在药物研发中需要得到足够的重视。通过体外细胞模拟测试,可以方便的探究最佳的用药条件。为了更加有效地治疗,相比于大规模的临床实验,治疗应针对于个别病例,甚至精准到个别病变组织。针对性的细胞温度-给药模型能够提供相关疾病的详细热力学信息,从而改进个性化医疗,促进精准治疗的发展。细胞热量的变化程度与药物作用效果联系起来,是一种新的定量分析手段。为探究炎症发生机制以及炎症治疗的最佳给药浓度,Li等[52]在体外培养了人微血管内皮细胞 (HMEC-1),利用内毒素 (LPS) 刺激人微血管内皮细胞 (HMEC-1) 来触发炎症反应,证实当LPS浓度为0.1 mg·L-1时,炎症效果最明显,此时内皮细胞所表达的温度变化也最强烈。接着,他们以同样的方式检测发现去甲肾上腺素在1 μmg·L-1浓度下炎症修复效果最好,证实了药物在发挥最佳功效时存在合理的浓度范围 (见图6)。细胞的产热过程与细胞活动有着密切联系,细胞温度变化程度可以作为评估标准,用于分析各种细胞生理活动。通过细胞温度-给药模型的建立,将有助于制定合理有效的临床治疗方案。
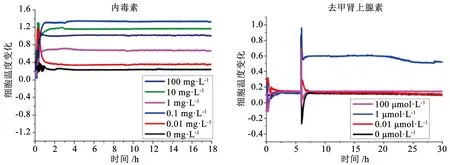
图6 不同浓度药物对细胞温度影响[52]
此外,通过检测癌细胞对温度刺激的反馈信息也是改进治疗方案的有效手段。Yang等[21]利用量子点监控了细胞受到冷刺激下的温度变化,证实活细胞对冷刺激有一定的应激抵御能力。Bendix等[53]直接测量了细胞磷脂双分子层的温度,实现了对温度升高过程的精确控制。在癌症热疗技术中,当肿瘤细胞被加热超过40 ℃时即可被杀死,但正常细胞与肿瘤细胞交替混合,需要实现精确的局部靶向加热。Kucsko团队[54]将局部光致热源纳米金颗粒与敏感的纳米尺度温度计金刚石纳米晶体 (Nanodiamonds) 结合在一起,实现了对肿瘤细胞的精准定位以及对局部细胞温度的实时监控,测量并调控了亚细胞结构的产热梯度,实现了在不损伤周围细胞的同时识别并杀死肿瘤细胞。因此,灵活多样的细胞测温技术为临床疾病的治疗提供了更多的解决方案。
4 结语
本文总结了一些具有代表性的测温技术及其在细胞生物领域的相关应用,可以预见细胞测温技术在药物研发领域有着广阔的前景,通过结合生物手段,细胞测温技术将能够应用到药物靶向、药物缓释、新药开发等领域。目前,细胞测温技术正处在一个发展的阶段,随着微纳加工技术的不断进步,细胞测温领域未来的趋势必将是多学科的结合应用,例如材料设计、热力学、纳米技术、微电子学以及生物医学等。在后续的研究中,我们需要持续关注细胞测温的技术革新,提高测温装置的性能,追求多种测温手段的相互结合。在生物应用中,我们要深入发掘细胞温度所蕴含的生物信息,推动药物筛选、药物分析以及治疗方案设计等多个方面的发展,从而加快新药研发的进程。在多学科领域的配合下,细胞测温技术必将成为细胞生物学或生命科学发展的有力工具。

