云南主栽核桃品种对Alternaria alternata叶枯病的抗病性评价
贺占雪 马建鹏 杨斌 赵宁


摘要 为了解云南地区不同核桃品种对叶枯病的抗性,从而为核桃抗病品种选育和叶枯病的防治提供依据,试验采用田间调查和离体叶片接种法获得病斑面积和病情指数,采用聚类分析的方法对田间调查和离体接种的病斑面积进行聚类分析,并结合病害分级标准,综合评价云南主栽37个核桃品种对Alternaria alternata的抗病性。结果表明:‘大泡核桃1叶片上未出现病斑,‘小圆果病斑面积最小, 为5.05 mm2,而‘圆菠萝2病斑面积最大,达到887.68 mm2;采用Ward最小偏差平方和法和欧式距离进行聚类分析,其聚类效果与接种结果和田间调查结果的吻合度最好。通过田间调查和离体接种综合评价,将37个核桃品种分为13个抗病品种、15个中抗品种、7个中感品种和2个感病品种。
关键词 核桃; 叶枯病; Alternaria alternata; 抗性评价
中图分类号: S 436.6
文献标识码: A
DOI: 10.16688/j.zwbh.2018345
云南核桃栽培范围广、面积大、产量产值高,是云南林业产业的重要组成部分。云南全省核桃种植面积达288万hm2,其中约有67万hm2挂果,年核桃干果产量达100多万t,产值超过380亿元,是云南省林业产业中产值最高、效益最好、农民得益最多的产业[12]。随着人工栽培面积的扩大,加之高效管理技术不到位,病虫害发生也逐渐增加。据云南省林业有害生物防治检疫局统计,截至2013年底,全省核桃病虫害发生面积1.3万hm2,其中虫害发生面积0.7万hm2、病害发生面积0.6万hm2;2016年全国森林有害生物普查,发现云南核桃病虫害发生面积已经超过7万hm2,其中病害发生4.7万hm2,这显示核桃病虫害发展速度十分迅猛。核桃叶枯病是由Alternaria alternata引起的核桃叶部常见病害,是核桃产业发展中面临的一个重要病害。该病害会降低核桃的结实量和果实饱满度,给当地核桃生产和农民的经济收入带来损失,严重制约核桃产业的发展。
链格孢属真菌是引起植物叶枯病的主要病原菌[35],1999年Belisario等首次报道了由Alternaria alternata引起的核桃叶斑病[6],2004年Belisario等再次报道了引起榛子和核桃叶枯病的病原是A. alternata[7],2006年Hong等报道了A. alternata是引起欧榛和核桃叶枯病的病原[8],2010年徐阳等报道了新疆南疆和田墨玉县托乎拉乡的核桃叶枯病是由A. alternata引起[9],2012年曲文文等明确危害核桃的链格孢菌是A. alternata[10],2015年韩敏从新疆喀什地区分离到核桃叶枯病病原A. alternata[11]。项目组前期对云南省核桃病害研究时发现A. alternata同样是引起核桃叶枯病的主要病原。
应用抗病品种是防治植物病害最经济安全的方法,而抗病性鉴定和抗病种质资源的筛选是品种合理利用和抗病育种工作的基础[12]。余仲东等[13]采用针刺接种法对核桃枝条进行接种试验评价了12个核桃品种对Botryosphaeria引起的溃疡病的抗性;牛亚胜等[14]采用标准差法研究了20个核桃品种对黑腐病的抗病性,石进昌等[15]采用田间试验法对核桃细菌性黑斑病进行了抗性调查,筛选出抗性较高的品种。笔者对云南主栽的37个核桃品种对叶枯病病原Alternaria alternata抗性进行了初步测定和评估,以期对核桃品种的引种栽培提供理论依据。
1 材料和方法
1.1 材料
供试菌株:供试链格孢Alternaria alternata由西南林业大学云南省森林灾害预警与控制重点实验室分离并保存。
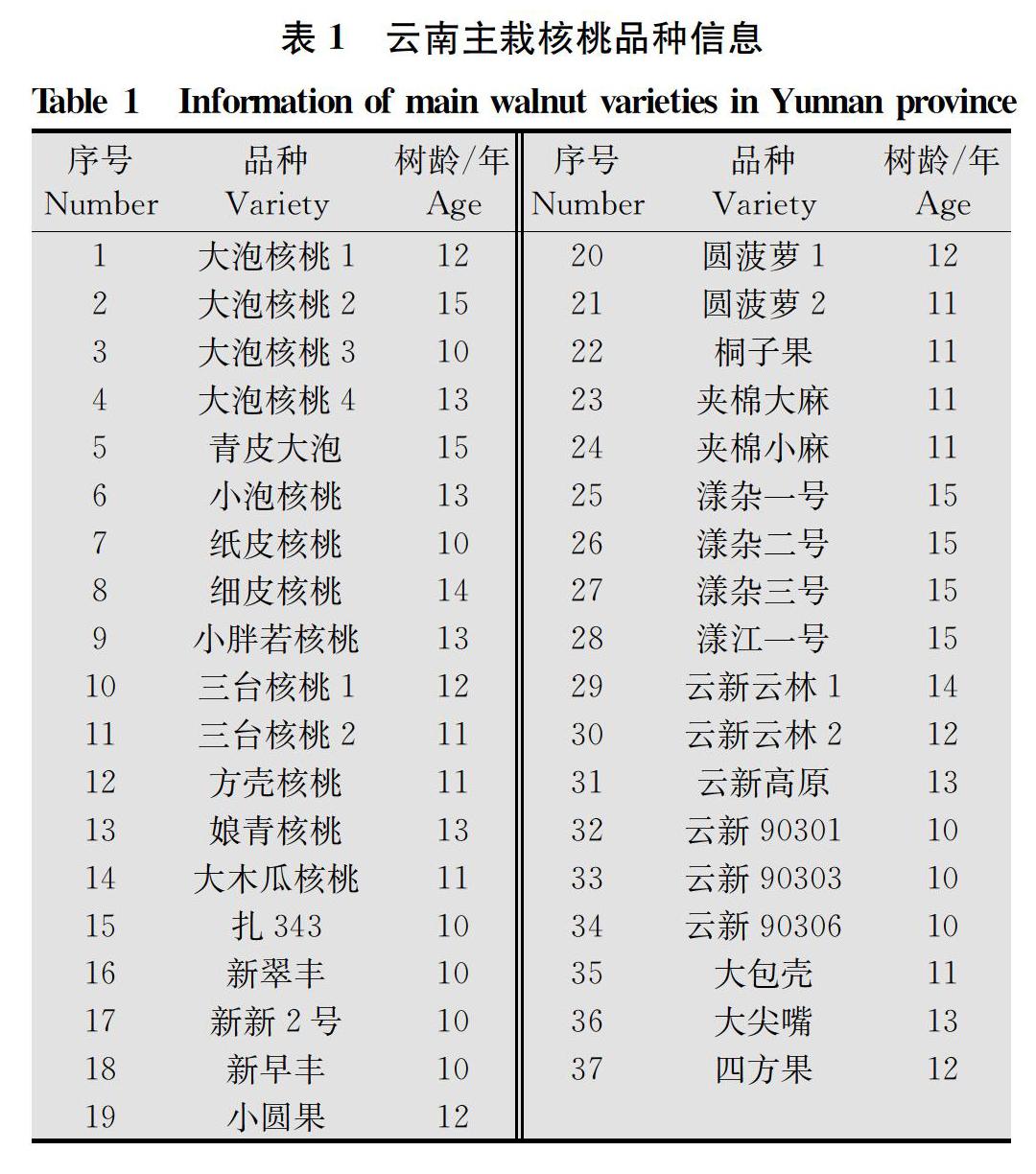
接种材料:接种用核桃树叶片采自大理白族自治州林业科学研究所核桃种质资源圃不同品种的嫩叶。每一供试品种选取生长良好、树势相对一致的核桃树,采集树冠外围中部健壮的发育枝中部复叶,采摘第3~4片小叶,叶宽4~5 cm,长10~12 cm。种质资源圃于2010年建成,所采集的37个核桃的品种信息如表1。
1.2 方法
1.2.1 田间调查
2017年、2018年于核桃叶部病害发病初期、盛发期和盛发后期,在云南大理、楚雄、昌宁、临沧等地的核桃种植基地进行核桃叶枯病田间自然发病调查。每个品种选取具有代表性的10株,每株分别从东西南北4个方向各选择10片叶,调查叶枯病病叶的生长状况、病斑面积、病斑形状、大小、颜色、数量等,采用十字交叉法测量病斑直径,统计相关数据,计算相应的病斑面积均值和病情指数。
病情指数=∑(病级×该级叶片数)总叶片数×最高病级×100。
病害分级标准参照苜蓿匍柄霉叶斑病的分级标准,稍有改进[16]。
以病情指数为基础,采用相对抗病性评价不同品种的抗性程度,根据病情指数并参照王瑜等[17]抗性分级研究中划分标准进行抗性划分。抗病:病情指数<5;中抗:5≤病情指数≤15;中感:15<病情指数≤25;感病:病情指数>25。
1.2.2 离体接种
1.2.2.1 菌株培育及接种材料处理
链格孢在PDA培养基上于25℃培养5 d后,采用3 mm打孔器在菌落边缘打取菌饼,备用。
供试核桃嫩叶用75%乙醇表面消毒后用无菌水冲洗3次,吸干表面水分,用石英砂在叶片正面固定部位摩擦,造成轻微伤口,备用。
1.2.2.2 接种
试验采集的37个核桃品种的叶片大小相近。在培养皿底层放入滤纸并加入无菌水使其润湿,将经过处理的叶片放入培养皿内,叶柄基部用浸湿的脱脂棉裹住以保持水分;然后将制好的菌饼反扣在叶片摩擦部位,以接种无菌PDA为对照,各处理重复10次。每天观察记录接种后叶片的发病情况。3 d后开始按十字交叉法測量病斑直径,直至第7天,采用第5天的数据计算病斑面积。
病害分级标准参照黄德芬[18]的分级标准,在此基础上进行改进。将接种后叶片出现的病斑面积分为以下几级(表3)。
1.2.3 数据处理与分析
所收集的试验数据进行病情指数计算,再用SPSS 22.0软件进行聚类分析。根据所测量的直径计算出病斑面积,然后去掉病斑面积数据的最大值和最小值,依次进行以下6种处理:不转换、对数转换、平方根转换、中心化转换、规格化转换以及标准化转换;聚类方法采用组间连接法、组内连接法、最近距离法、最远距离法、重心法、中位数法、Ward最小偏差平方和法等7种方法;聚类距离采用欧氏距离。将数据处理方法、聚类方法和聚类距离分别组合进行数据分析,依据接种后的平均病斑面积和聚类分析结果,筛选出最适合的聚类分析方法。
1.3 抗性评价
根据田间调查和离体接种的结果进行系统聚类分析,结合病情指数分级,对37个核桃品种对Alternaria alternata的抗性进行划分。
2 结果与分析
2.1 田間调查抗性评价
由表4可以看出,37个核桃品种的病情指数在2.5~32.6范围内。病情指数是反映不同核桃品种抗病性的一项重要指标,根据病情指数划分37个核桃品种的抗病性:抗病品种13个,占35.13%;中抗品种16个,占43.24%;中感品种6个,占16.22%;感病品种2个,占5.40%。
按病斑面积均值,对37个品种进行系统聚类分析,结果显示,将各重复病斑平均面积原始数值不作转换、聚类方法采用Ward最小偏差平方和法、聚类距离采用欧式距离,所得聚类结果与田间调查病情指数划分结果吻合度最好,符合田间调查病斑大小的分布规律。据此,以欧式距离5作为聚类分割点,将37个核桃品种分为4类,第1类13个抗病品种;第2类16个中抗品种;第3类6个中感品种;第4类2个感病品种(图1)。
2.2 离体鉴定抗性评价
将链格孢接种在37个核桃品种叶片上,测量病斑直径,计算5 d后病斑面积,按照病害分级标准,将37个核桃品种分为4类抗性等级:第1类有16个抗病品种,病斑面积在0~40.14 mm2范围内;第2类有12个中抗品种,病斑面积在52.48~124.96 mm2范围内;第3类有7个中感品种,病斑面积在174.76~327.44 mm2范围内;第4类有2个感病品种,病斑面积大于840 mm2(表5)。
用离体接种叶片的病斑面积进行聚类分析,将37个核桃品种分为4类,第1类16个抗病品种占43.24%;第2类12个中抗品种占32.43%;第3类7个中感品种占18.91%;第4类2个感病品种占540%(图2)。
2.3 田间调查与离体接种抗病性综合评价
表6结果显示,两种方法的抗病性评价结果吻合度较高,有33个品种对Alternaria alternata的抗性结果一致,占测试品种的89.2%。综合评价后,将测试的37个品种对Alternaria alternata抗性分为4类。第1类13个抗病品种(R):‘大泡核桃1、‘小圆果、‘三台核桃1、‘夹棉小麻、‘纸皮核桃、‘圆菠萝1、‘大泡核桃4、‘新新2号、‘漾杂一号、‘大泡核桃3、‘夹棉大麻、‘桐子果、‘小胖若核桃;第2类15个中抗品种(MR):‘新翠丰、‘云新云林1、‘小泡核桃、‘方壳核桃、‘云新云林2、‘大泡核桃2、‘漾杂三号、‘青皮大泡、‘云新90303、‘四方果、‘大木瓜核桃、‘三台核桃2、‘大包壳、‘漾杂二号、‘娘青核桃;第3类7个中感品种(MS):‘云新高原、‘云新90306、‘漾江一号、‘细皮核桃、‘大尖嘴、‘新早丰、‘扎343;第4类2个感病品种(S):‘云新90301、‘圆菠萝2。
3 结论与讨论
抗病性评价是植物病害防治的重要途径,是作物抗病育种的重要基础,从抗原筛选、后代选择、直到品种推广的全过程都离不开抗病性评价。抗性是寄主、病原物和环境三者之间相互作用的综合表现,抗病或感病是相对于特定的菌株和特定环境条件下品种的表现型[1922]。而聚类分析法是多种植物抗性评价方法之一,作为数据分析工具,聚类的结果满足相同组中数据对象的差距尽可能的小,不同组中的数据差距尽可能大的鉴定方法,在各个领域都得到广泛的应用[2325]。在本次试验研究中使用聚类分析法,可以将试验样品在抗病性方面的数量性状按其性质的亲疏度进行分类,从而得出不同品种的抗性分级。试验过程中采用SPSS 23.0软件对室内离体接种后的叶片病斑面积进行聚类分析,将37个核桃品种分为抗病、中抗、中感、感病4类,并且试验结果与田间调查的抗病性评价结果高度吻合。陈永芳等应用关联分析法,对橘类18个品种和其果实品质进行了综合评价,明确了最优品种,试验结果证实了聚类分析可以作为选择优良品种的评价方法[26]。
核桃叶枯病是一种较大程度影响核桃产业可持续发展的植物病害,目前主要采用化学防治,不仅污染环境,还容易产生抗药性,选育和栽培抗病品种成为生产中防治该病安全而长效的方法。本研究采用田间调查和离体接种方法评价了云南主栽的37个核桃品种对A.alternata引起的叶枯病的抗性,离体接种的结果与田间调查的结果吻合度较高,经过综合评价将37个核桃品种对叶枯病的抗性反应划分为抗病、中抗、中感、感病4个类别,其中13个品种抗病,15个品种中抗,7个品种中度感病,2个品种感病。这种方法适合于人工接种条件下核桃品种对叶枯病的抗病反应分类。本研究结果显示,同一核桃品种不同树龄表现出了对叶枯病的不同抗性,在相同的环境因子下,随着树势增强,抗性也相应增强。本研究为今后核桃种植过程中筛选抗病基因,选育新的抗病种质资源,进一步优化抗病育种和叶枯病的防治等方面提供了基础数据,并为今后核桃新品种培育和核桃产业的健康发展提供了科学依据。
参考文献
[1] 柏斌. 云南核桃已成为云南第一特色经济林果[J]. 中國果业信息, 2015, 32(11): 33.
[2] 马婷. 云南核桃林下经济发展模式参考[J]. 致富天地, 2016(1): 11.
[3] 刘新伟, 陈岩, 宋福, 等. 我国梨和部分国外梨果实上链格孢菌的鉴定研究[J]. 植物检疫, 2009(5): 15.
[4] PEEVER T L, CANIHOS L Y, OLSEN L, et al. Population genetic structure and host specificity of Alternaria spp. causing brown spot of Minneola tangelo and rough lemon in Florida[J]. Phytopathology, 1999, 89(10): 851860.
[5] PEEVER T L, SU G, CARPENTER-BOGGS L, et al. Molecular systematic of citrus-associated Alternaria species [J]. Mycologia, 2004, 96(1): 119134.
[6] BELISARIO A, FORTI E, CORAZZE L, et al. First report Alternaria alternate causing leaf spot on English walnut[J]. Plant Disease, 1999, 83(7): 696.
[7] BELISARIO A, MACCARONI M, CORAMUSI A, et al. First report of Alternaria species groups involved in disease complexes of hazelnut and walnut fruit [J]. Plant Disease, 2004, 88(4): 426.
[8] HONG S G, MACCARONI M, FIGULI P J, et al. Polyphasic classification of Alternaria isolated from hazelnut and walnut fruit in Europe[J]. Mycological Research, 2006, 110(11): 12901300.
[9] 徐阳,刘雪峰,蒋萍,等.和田地区核桃叶枯病病原菌的鉴定[J].西部林业科学,2012,41(3):102105.
[10]曲文文,刘霞,杨克强,等.山东省危害核桃的链格孢属真菌鉴定及其系统发育[J].植物保护学报,2012,39(2):121128.
[11]韩敏,蒋萍.核桃叶斑病病原菌的分子鉴定[J].新疆农业科学,2015,52(1):9196.
[12]陈红梅,李金花,柴兆祥,等.35个马铃薯品种对镰刀菌干腐病优势病原的抗病性评价[J].植物保护学报,2012,39(4):308314.
[13]余仲东,李涛,王兴旺,等.5个核桃主栽品种对Botryosphaeria溃疡病的抗性评估[J].中国南方果树,2016,45(4):123125.
[14]牛亚胜,谢鸣,汪恒兴,等.核桃品种对黑斑病抗性的研究[J].北方果树,2010(4):57.
[15]石进昌,马玉林.不同核桃品种对核桃细菌性黑斑病的抗性调查[J].中国园艺文摘,2017,33(2):66.
[16]张静妮.不同秋眠等级苜蓿匍柄霉叶斑病抗性评价及抗病机理研究[D].北京:北京林业大学,2008.
[17]王瑜,刘怡,周彬彬,等.苜蓿对匍柄霉叶斑病与茎点霉叶斑病的抗性评价研究[J].草业学报,2015,24(7):155162.
[18]黄德芬.甘蓝黑腐病的离体抗性鉴定及相关生理生化指标分析[D].重庆:西南大学,2011.
[19]玄立春,王红霞,孙晓丽,等.核桃青皮单宁测定方法的研究[J].河北果树,2013(4):46.
[20]寿园园,李春敏,赵永波,等.苹果抗褐斑病离体鉴定的方法[J].果树学报,2009,26(6):912914.
[21]高润蕾.哈密瓜细菌性叶斑病病原鉴定及不同品种抗病性测定[D].呼和浩特:内蒙古农业大学,2009.
[22]姜琬.重庆枇杷灰斑病菌鉴定、抗性评价及防控研究[D].重庆:西南大学,2014.
[23]刘天明,李华,张振文.鲜食葡萄品种对霜霉病的抗性及抗病机理研究[J].植物保护学报,2001,28(2):118122.
[24]殷辉,周建波,吕红,等.36个苹果树品种对腐烂病菌的抗病性评价[J].山西农业科学,2017,45(6):9981001.
[25]施丽丽.河北省太行山区核桃主要栽培品种综合性状评价研究[D].保定:河北农业大学,2012.
[26]陈永芳,弓成林,程昌凤.18个桔类品种果实品质的灰色关联分析[J].四川农业大学学报,2000,18(2):157159.
(责任编辑:杨明丽)

