白细胞介素-35对可溶性CD40配体诱导人脐静脉血管内皮细胞活化的作用
血管内皮细胞活化是冠状动脉粥样硬化性心脏病(冠心病)患者早期重要的病理生理改变[1-2],活化的血管内皮细胞释放多种炎性因子、血管活性物质以及大量的氧自由基,促进冠心病的发生发展[3]。CD40/CD40配体(CD40L)分布于内皮细胞和血小板,可通过多种信号通路活化血管内皮细胞,使其过表达黏附分子、炎性因子以及氧自由基等,与冠心病的发生密切相关[4]。白细胞介素(IL)-35是由调节性T细胞(Treg)等分泌的新型抗炎因子,可以抑制脂多糖(LPS)对血管内皮细胞的活化,从而抑制血管内皮细胞炎性因子的表达,减轻炎性反应[5],但尚不明确IL-35是否可抑制sCD40L对血管内皮细胞的活化。本研究检测冠心病患者外周血清中可溶性CD40配体(sCD40L)和IL-35的水平,并分析IL-35对sCD40L活化血管内皮细胞的抑制作用,探讨IL-35在冠心病发病中的作用。
1 对象与方法
1.1 研究对象
选择2018年2月至2018年8月在江苏省滨海县人民医院心内科诊断的冠心病患者43例,其中不稳定型心绞痛患者20例(UA组),急性ST段抬高型心肌梗死患者23例(STEMI组),所有患者行冠状动脉造影检查,诊断和分型均符合《心脏病学》诊断标准[6];同时选取年龄、性别匹配的20例健康体检者作为对照组。排除标准:合并感染性疾病、瓣膜性心脏病、扩张型心肌病、脑卒中、严重肝肾功能不全、恶性肿瘤以及使用类固醇类药物的患者。本研究经医院伦理委员会批准(批准号01/2018),所有参加者签署知情同意书。
1.2 试剂
细胞因子IL-35购自美国Bio-rad公司;sCD40L购自武汉艾美捷科技有限公司;sCD40L、IL-35、E-选择素、可溶性细胞间黏附因子(sICAM-1)酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技有限公司;DMEM培养基、胎牛血清(FBS)、胰蛋白酶购自美国Gibco公司;丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、氧自由基(ROS)检测试剂盒购自上海碧云天生物技术有限公司。
1.3 血液标本采集
AMI患者在入院时采集外周静脉血3 mL,其余患者在入院次日清晨空腹采集静脉血3 mL,置于肝素钠抗凝管,3 000 r/min离心2 min,收集血清,储存于-80 ℃备用。
1.4 人脐静脉血管内皮细胞(HUVEC)的培养
取剖宫产孕妇分娩的健康新生儿脐带20 cm,采用胰酶消化法获得血管内皮细胞,将其接种于含20%FBS的DMEM完全培养基,置于37 ℃、5%CO2培养箱,待细胞长至80%融合状态后,选取第2~5代细胞用于实验。流式细胞仪检测内皮细胞表面标记CD31,纯度达85%以上。实验分为空白组、sCD40L组和IL-35+sCD40L组。sCD40L组加入25 μg/mLs CD40L,IL-35+sCD40L组加入20 ng/mL IL-35和25 μg/mL sCD40L,培养24 h后收集细胞,PBS洗涤2次,上清液储存于-80 ℃备用。
1.5 ELISA法检测外周血清中IL-35、sCD40L水平及细胞培养上清液中E-选择素、sICAM-1水平
使用ELISA试剂盒检测外周血清中IL-35、sCD40L水平及细胞培养上清中E-选择素、sICAM-1的水平,操作严格按照试剂盒说明书进行。
1.6 比色法检测HUVEC中MDA水平及SOD活性
取对数生长期的HUVEC以1×105/mL的细胞密度接种于96孔培养板内,培养方法及分组同1.4,培养后弃上清,按照试剂盒说明书检测HUVEC的MDA水平及SOD活性。
1.7 2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针法检测HUVEC中ROS活性
将血管内皮细胞接种于6孔板,初始密度为4×105/孔,培养方法及分组同1.4,每孔加入2 mL无血清培养液以及20 μmol/L DCFH-DA溶液,混匀,于37 ℃、5%CO2培养箱中避光孵育30 min后用培养液轻轻洗涤细胞2次,荧光显微镜观察拍照(激发波长为488 nm,发射波长为525 nm),ImageJ软件计算平均荧光强度值(IOD)。
1.8 统计学分析
采用SPSS 22.0软件对数据进行统计学分析,计量资料采用均数±标准差表示,两组间比较采用student′st检验,多组间比较采用单因素方差分析;偏态分布采用中位数表示,组间比较采用Mann-WhitneyU检验或Kruskal-Wallis检验;线性相关分析采用Spearman分析。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者外周血清IL-35和sCD40L水平比较
3组患者年龄、性别、高血压史、糖尿病史、吸烟史均无统计学差异,见表1。ELISA试剂盒检测外周血清IL-35及sCD40L的水平。与对照组相比,UA组、AMI组IL-35水平均降低,且STEMI组降低更为显著;而sCD40L水平显著升高,且STEMI组升高更明显,差异均有统计学意义(P均<0.05),结果见表2。

表1 3组患者临床资料比较

表2 3组患者外周血清IL-35和sCD40L水平比较
注:与对照组比较,(1)P<0.05;与UA组比较,(2)P<0.05
2.2 冠心病患者外周血清IL-35与sCD40L的相关性分析
冠心病患者外周血清IL-35水平与sCD40L水平呈负相关(r=-0.443,P<0.01),见图1。
2.3 IL-35对HUVEC分泌E-选择素、sICAM-1的干预作用
ELISA法检测3组HUVEC培养上清中E-选择素、sICAM-1的水平。与空白组相比,sCD40L组E-选择素、sICAM-1水平均显著增加(P均<0.05);与sCD40L组相比,IL-35+sCD40L组E-选择素、sICAM-1水平均显著降低(P均<0.05),见表3。

表3 3组HUVEC培养上清中E-选择素、sICAM-1水平比较
注:与空白组比较,(1)P<0.05;与sCD40L组比较,(2)P<0.05
2.4 IL-35对HUVEC中MDA水平及SOD活性的影响
比色法检测3组HUVEC中MDA水平及SOD活性。与空白组相比,sCD40L组HUVEC中MDA水平显著升高,SOD活性显著下降(P均<0.05);与sCD40L组相比,IL-35+sCD40L组HUVEC中MDA水平显著下降,SOD活性显著升高(P均<0.05),见表4。

表4 3组HUVEC中MDA水平及SOD活性比较
注:与空白组比较,(1)P<0.05;与sCD40L组比较,(2)P<0.05
2.5 IL-35对HUVEC中ROS活性的影响
DCFH-DA荧光探针法检测3组HUVEC中ROS活性。与空白组相比,sCD40L组HUVEC中ROS活性显著升高(13.45±4.12对3.65±2.08,P<0.05);与sCD40L组相比,IL-35+sCD40L组HUVEC中 ROS活性显著降低(7.09±3.06对3.65±2.08,P<0.05),见图2。
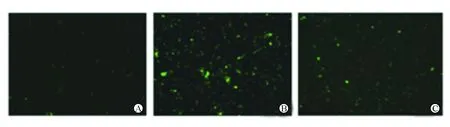
注:A为空白组;B为sCD40L组;C为IL-35+sCD40L组
3 讨论
血管内皮细胞活化在冠心病的发展过程中发挥着重要作用[7],血管内皮细胞具有阻止巨噬细胞浸润和泡沫细胞形成、调节凝血和阻止血栓形成的功能。活化的血管内皮细胞可分泌多种生物活性物质如E-选择素、细胞间黏附分子和ROS等,导致动脉粥样硬化等疾病的发生[3],慢性炎性反应是导致血管内皮细胞活化的主要因素,并贯穿于整个冠心病的发生发展过程。炎性反应的激活以及促炎/抗炎因子的失衡与动脉粥样硬化的发生、斑块的破裂、血栓的形成等密切相关,促进了稳定型心绞痛向UA,加剧了疾病进展[8]。
CD40/CD40L的相互作用可以调节氧化应激,影响免疫系统、心血管系统等信号通路,与冠心病的发生密切相关[9]。CD40L与CD40相互作用促进单核细胞、巨噬细胞等黏附于血管内皮细胞,诱导细胞间黏附分子(ICAM-1)、E-选择素等的表达,增加氧自由基的生成,导致氧化应激[10];同时,CD40通过与CD40L的相互作用调控多种基质金属蛋白酶的表达,促进动脉粥样斑块的破裂[11]。sCD40L是CD40L水解形成的具有生物活性的可溶性片段,与CD40L具有相同的生物学功能[12]。Yuan等[4]研究表明,循环血液中sCD40L能刺激泡沫细胞的形成,促进动脉粥样硬化的发展,增加粥样斑块的不稳定性,加速冠心病的发展。Heeschen等[13]研究表明,sCD40L对冠心病具有一定的预测价值。Fouad等[14]研究发现,UA及急性心肌梗死患者外周血清sCD40L水平显著高于稳定型心绞痛及健康体检者。本研究结果与上述研究一致,显示STEMI患者与UA患者外周血清sCD40L水平显著升高,且STEMI患者升高更显著。
IL-35是IL-12家族的新成员,由两个亚基组成,其主要生物学功能是:(1)抑制血管炎性反应;(2)促进Treg细胞活化,增强其抑制功能;(3)抑制辅助T细胞(Th)1、Th17等细胞的增殖;(4)促进抗炎因子如IL-10的产生,抑制促炎因子如IL-17的产生[15]。本研究表明,冠心病患者外周血IL-35水平显著降低,且STEMI患者降低更为显著,这与Lin等[16]研究结果一致。Mor 等[17]研究表明,冠心病患者外周血Treg比例下降,其抑制功能也明显下调。IL-35可能通过加重炎性反应参与冠心病的发生。
本研究显示IL-35与sCD40L水平呈负相关,IL-35能显著抑制sCD40L诱导的内皮细胞E-选择素、sICAM-1的分泌。E-选择素和ICAM-1是血管内皮细胞活化的标志,血管内皮细胞活化后分泌大量的E-选择素和ICAM-1,两者通过与细胞间受体结合,促进白细胞、单核细胞、T细胞紧密黏附于血管内皮细胞,加重血管内皮细胞的功能障碍,影响动脉粥样斑块的稳定性[18],促进冠心病的发生发展。
MDA和SOD可反映机体脂质过氧化、受自由基攻击的损伤程度和机体清除氧自由基的能力。在生理状态下,氧自由基生成和清除维持平衡状态;在病理状态下,这一平衡被打破,细胞受损或活化,产生过量的氧自由基,使机体处于氧化应激状态。本研究显示,IL-35明显降低血管内皮细胞脂质过氧化物水平,上调内皮细胞清除氧自由基的能力,从而抑制sCD40L对血管内皮细胞的活化。
综上所述,本研究发现,冠心病患者外周血IL-35水平显著降低,而sCD40L水平显著升高,两者呈负相关。IL-35能抑制sCD40L诱导的血管内皮细胞的活化,其机制主要通过降低血管内皮细胞脂质氧化及血管内皮细胞氧自由基的水平,上调血管内皮细胞清除氧自由基的能力。结果表明,IL-35和sCD40L在冠心病的发生发展过程中起着重要的作用,调控IL-35和sCD40L可能是治疗冠心病的新途径。

