2-(2-吡啶基)苯并噻唑的Mn(Ⅱ)、Zn(Ⅱ)、Co(Ⅱ)的金属配合物的合成以及与DNA相互作用的研究
蔡健,贺玉婷,李红霞,岳淑美
(长春师范大学化学学院,吉林长春 130032)
含氮杂环化合物的唑类配合物中研究最多的是三唑[1-2]、咪唑[3]、咔唑[4]以及易合成且活性良好的噁唑[5-6]等,这几种唑类化合物在抗癌、抗肿瘤领域都有着很好的发展潜力。特殊的结构给予了含氮杂环化合物许多独特的功能,吸引了大量的科研专家对其进行性能研究[7]。含有平面芳香环的金属化合物可通过嵌插结合的方式进入DNA的碱基对之间[8],因此这些金属化合物特别容易形成π-π*堆积,且它们可以通过非共价键互相配位的方式结合,如静电作用、疏水作用、范德华力等[9]。含有氮杂环给电子配体的过渡金属配合物因能与DNA配位而可能成为一种以DNA为靶分子的金属抗癌剂。如果可以发现能够定向破坏DNA的配合物,那样将对抗癌药物的开发以及癌症的治疗,提供了更多的方法和手段。开展对本实验研究结果的探讨,有助于人们进一步了解DNA与配位化合物的作用方式,希望可以在药物的药理、开发核酸探针、筛选及设计药物等方面提供一定的理论基础[10]。
本研究主要合成了2-(2-吡啶基)苯并噻唑金属锰、锌、钴的配合物,并利用紫外光谱和荧光光谱对以2-(2-吡啶基)苯并噻唑为配体的配合物与小牛胸腺DNA的作用方式进行了研究。发现金属锰、锌、钴的配合物可以与DNA通过静电或沟壑的方式进行结合,并能有效断裂DNA。本文工作包括如下:(1)以多聚磷酸、2-吡啶甲酸和邻苯硫酚为原料合成配体2-(2-吡啶基)苯并噻唑;(2)合成以Mn(Ⅱ)、Zn(Ⅱ)、Co(Ⅱ)为中心离子,以2-(2-吡啶基)苯并噻唑为配体的配合物;(3)分别用紫外可见光谱和荧光光谱对金属配合物和小牛胸腺DNA的相互作用方式进行研究。
1 实验材料与方法
1.1 主要化学试剂及仪器
主要化学试剂见表1。
仪器:TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司)、RF-5301PC型荧光分光光度计(日本岛津)。

表1 主要化学试剂
1.2 2-(2-吡啶基)苯并噻唑的合成方法
将20 mL多聚磷酸加入到250 mL的圆底烧瓶中,待温度升至110 ℃后,分别加入2-吡啶甲酸25mmol(3.1 g)和邻苯硫酚 25mmol(2.5 mL),然后升温到180℃反应3h,趁热倒入300 mL的冰水混合物中,不断搅拌,用NaOH溶液调至pH为6~7。然后过滤、洗涤、干燥,用甲醇溶液重结晶,可得到绿色的粉末。
1.3 配合物2-(2-吡啶基)苯并噻唑锰(1)的合成
取1mmol的氯化锰和1mmol的配体2-(2-吡啶基)苯并噻唑溶于10mL的甲醇中,再加入少量的硫氰化钾放入锥形瓶中,将其置于磁力加热搅拌器上加热回流搅拌4h,浓缩至5mL。将其充分反应过后的液体倒入洗净烘干的小瓶中,将小瓶放入一个装有1/3乙醚的大瓶中,用乙醚蒸汽扩散的方法得到金属锰配合物的粉末。
1.4 配合物2-(2-吡啶基)苯并噻唑锌(2)的合成
将0.216g配体溶解到15.20mL甲醇中,用电子天平称量0.1725g的氯化锌溶于另外的5mL甲醇中,然后将两种溶液均匀混合,装进反应釜中,放进烘箱约5天后,关闭烘箱,再冷却2天,根据其在乙醚中溶解度小的原理利用乙醚蒸汽培养数日后得到无色粉末。
1.5 配合物2-(2-吡啶基)苯并噻唑钴(3)的合成
将 0.0318 g的 CoCl2·6H2O(0.1 mmol)和 0.0212g的配体(0.1 mmol)溶于15mL无水甲醇中,用磁力搅拌器加热至配体溶解,反应一段时间后,将溶液放进反应釜中,温度设置120℃,用烘箱烘5天,结束后关闭烘箱,留反应釜在烘箱内冷却2天,再用乙醚蒸汽扩散培养单晶,5天后得到淡黄色的粉末。
1.6 溶液的配制
Tris-HCl/NaCl缓冲溶液的配制:先量取4.2mL浓盐酸溶于500mL蒸馏水,备用。再称取6.057g三羟甲基氨基甲烷溶于500mL蒸馏水,用稀释后的浓盐酸溶液调节三羟甲基氨基甲烷溶液的pH等于7.00。最后称取5.844g氯化钠,加入到以上两种溶液的混合溶液中,来平衡该溶液的离子强度,并定容至1000mL。
小牛胸腺DNA(CT-DNA)的配制与浓度测定:称取0.014g小牛胸腺DNA用Tris缓冲溶液进行溶解,定容至100mL,之后放入冰箱在2~8℃的温度中放置2~3天。取800ΜlDNA溶液和3200μLTris缓冲溶液混合均匀。进行紫外光谱的测定时,现将混合溶液放入石英池中测定A260和A280,并计算两者的比值得A260/A280=1.832,其值在1.8~2.0,在实验纯度要求的范围。
配合物缓冲溶液的配制:2-(2-吡啶基)苯并噻唑金属锰配合物分散到10mL二甲基亚砜试剂中,然后用配制好的Tris缓冲溶液定溶至50mL,使配合物缓冲溶液的起始浓度为2×10-3mol/L。
1.7 紫外可见光谱法
按文献[3]的方法,配制DNA缓冲溶液与不同浓度的金属配合物的溶液,样品浓度配比见表1。充分混合后,得到配合物与DNA作用后的吸收光谱,观察其变化。

表2 样品浓度配比
2 结果与讨论
2.1 配合物(1)~(3)与DNA作用的紫外吸收光谱
目前,紫外可见光谱法是研究配合物与DNA作用的最常用和最有效的方法之一。一般情况下,DNA加入到金属配合物溶液后,若配合物的吸收峰强度降低、吸收的波长红移,可以判定是配合物插入DNA的证据之一。因为配合物中的配体具有较大的刚性平面结构,可插入到DNA的碱基对间发生π电子堆积,进而二者间发生偶合作用。偶合是由于作用配体π*电子与碱基的π电子重叠发生的。偶合后能级下降并禁阻了π→π*跃迁的能力,进而出现了减色效应[11]。若紫外可见吸收光谱谱峰产生小幅度的红移,则可能是配体与DNA发生了静电引力和沟壑作用,且出现不明显的减色效应[12-14]。配合物与DNA作用后,其吸收光谱产生增色效应,且增色程度随着DNA浓度的增加而增大,出现这种现象可能是由于配合物与DNA结合,导致DNA螺旋结构的破坏。结果如图1~3(图中的1-6分别为表2中的样品浓度配比)。
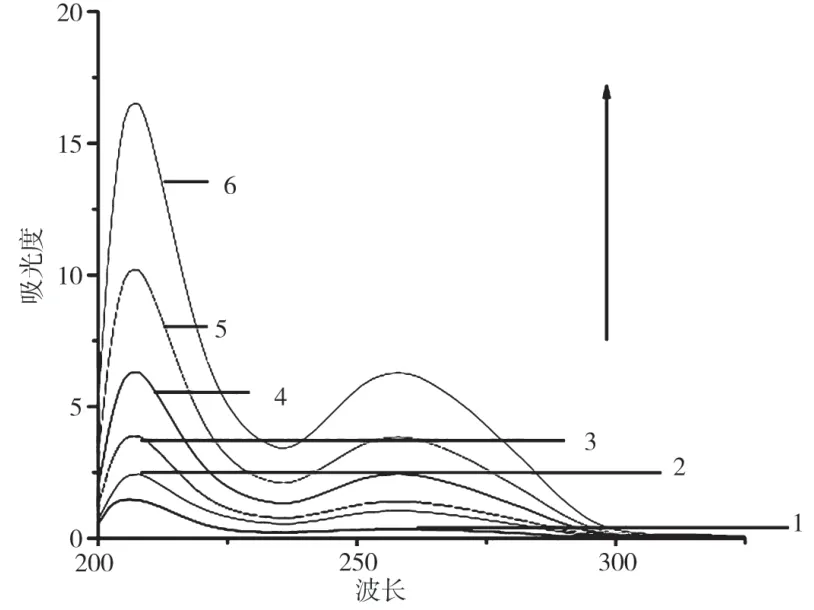
图1 2-(2-吡啶基)苯并噻唑Mn与DNA作用的紫外光谱

图2 2-(2-吡啶基)苯并噻唑Zn与DNA作用的紫外光谱

图3 2-(2-吡啶基)苯并噻唑Co与DNA作用的紫外光谱
本文的紫外吸收光谱得出的结果是:随着DNA浓度的增加,配合物与DNA作用产生了增色效应,表明2-(2-吡啶基)苯并噻唑Mn、Zn和Co配合物是通过静电或沟壑的方式与DNA相互作用的。
2.2 荧光光谱研究
荧光光谱是非常灵敏且有效的检测手段,对所研究的噻唑类金属配合物与DNA作用的检测和表征具有无法取代的价值[15-16]。荧光光谱法特别是针对含有荧光特性的化合物最为有效,判断配合物与DNA作用的模式是依据两者前后所测的荧光强度的不同来判定[17-20]。荧光光谱法还可以研究具有荧光靶向特点的物质,可以根据所测得的荧光具体情况分析判断它们的作用方式。
如图4~6所示是金属锰、锌、钴配合物的荧光光谱,图中由下至上光谱图分别加入配合物的量为0μL、0.5μL、1μL、1.5μL、2μL。

图4 2-(2-吡啶基)苯并噻唑Mn与DNA作用的荧光光谱

图5 2-(2-吡啶基)苯并噻唑Zn与DNA作用的荧光光谱

图6 2-(2-吡啶基)苯并噻唑Co与DNA作用的荧光光谱
由此可见,随着遗传物质DNA浓度呈梯度逐渐上升,噻唑类金属锰、锌、钴配合物的荧光强度逐渐增强,说明配合物与DNA发生了强烈的相互作用。这种增强也许和配合物进入DNA内的疏水环境的程度从而改变了配合物的络合环境有关。它避免的溶剂水分子的猝灭效果,制约着配合物结合位点的流动性,从而减少了它们震动模式,增强了它们的发光强度。
3 结论
本文合成并培养出三个噻唑类配合物,即Mn(Ⅱ)、Zn(Ⅱ)、Co(Ⅱ)的金属配合物,并通过紫外光谱和荧光光谱对其做了一些性质研究:通过紫外光谱和荧光光谱对配合物与DNA的实验,得出了初步的结论,金属配合物与DNA以非插入的作用方式破坏了DNA的双螺旋结构。因此推测,这三种配合物可以以此结合模式与癌细胞DNA发生作用,使癌细胞DNA损伤。可以沿着这个方向,继续研究能否通过该作用方式定向破坏癌症细胞,为研究治愈癌症药物的研究提供更多的选择。

