黑豆纳豆激酶冻干保护剂的选择
韩翠萍 刘庆冠 刘 畅 张 涵 江连洲 程建军
(东北农业大学食品学院 哈尔滨150030)
纳豆起源于日本,是深受日本人民喜爱的传统发酵食品,迄今已有2000 多年的历史[1],与中国的豆豉有很深的历史渊源[2]。纳豆激酶是纳豆在发酵过程中由纳豆枯草杆菌(纳豆菌)产生的一种碱性丝氨酸蛋白酶[3],具有溶解血栓,促进血液循环以及预防心血管疾病等医疗保健功能[4]。目前国内外对纳豆激酶的研究主要集中在其药理作用和分离纯化上,而对其冻干保护剂的研究鲜有报道。Cai Yongjun 等[5]研究表明,可用DNA 家族改组技术提高纳豆激酶的纤溶活性,为纳豆激酶在溶栓治疗中的应用提供有益的参考。Fujita M 等[6]和Sumi H[7]发现纳豆激酶具有将pro -UK(尿激酶原)激活成尿激酶的活性。Lampe 等[8]研究表明,纳豆激酶拥有比传统的溶栓剂更为卓越的优点,如无抗原性,半衰期较长,不易引起出血等。张新[9]和阎家麒等[10]成功将发酵液先用硫酸铵盐析沉淀,再经超滤除去金属离子,然后分别使用Sephadex G-100 层析柱和Sephacry1 S-200 层析柱纯化。此分离纯化方法将几种提酶法融合在一起,取长补短,得到的酶活性也较高。韩润林等[11]采用发酵与泡载分离耦合方法研究纳豆激酶的分离纯化,结果表明,该法使生产周期大幅度的缩短,更重要的是提高了酶的活性。YANG 等[12]研究采用超顺磁性聚甲基丙烯酸甲酯(PMMA)微球从发酵液中直接分离纯化纳豆激酶,试验结果较为理想,酶活回收率85%,纯化因子8.7%。
细胞和组织在冻干过程中会受到不同程度的损伤,包括机械损伤、细胞膜损伤以及细胞代谢调节功能的损伤,更严重的会导致细胞或组织死亡[13]。众多研究发现,加入冻干保护剂可以降低冻干过程对细胞组织的损伤程度,尽可能保持其原有的组织结构和生物活性[14]。冻干保护剂能将细胞和菌体最大面积地包裹在其中,减少细胞组织和菌体与氧气间接或直接接触,为细胞提供一个良好的休眠环境,因此能够达到延长物料的储存期,使物料在一定时间内保持较高活性的效果[15]。
在添加壳聚糖的条件下,本文首先考察8 种冻干保护剂对纳豆激酶在冻干过程中的保护效果,然后做正交试验,以纳豆激酶酶活和纳豆菌存活率为指标,最终确定最佳的复合冻干保护剂组合,以期为纳豆激酶冻干保护剂的进一步开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
纳豆激酶,东北农学大学实验室自提;尿激酶,中国药物生物制品检定所;纳豆芽孢杆菌,上海惠世生化试剂有限公司;牛血纤维蛋白原,上海源叶生物科技有限公司;琼脂糖(生化试剂),上海万疆生物技术有限公司;其它药品和试剂均为分析纯级。
1.2 仪器与设备
NH-4 型数显恒温磁力搅拌水浴锅,常州赛普实验仪器厂;ARRW60 型电子精密天平(精密度为0.01g),奥豪斯(上海)公司;可调移液器,大龙兴创实验仪器(北京)有限公司;数字酸度计,上海大普仪器有限公司;DHP-9012 型电热恒温培养箱,上海一恒科技有限公司;电子数显卡尺,无锡凯保鼎工具有限公司;LGJ-1 冷冻干燥机,上海医用离心机厂;SHA-13 恒温振荡器,常州国华电器有限公司;XH-C 旋涡混合器,常州恩培仪器制造有限公司。
1.3 方法
1.3.1 纳豆激酶酶活保持率的测定 采用琼脂糖-纤维蛋白平板法来测定纳豆激酶的活性。
1) 尿激酶标准曲线的绘制 通过绘制尿激酶标准曲线,建立纤维蛋白平板的溶解圈面积与尿激酶活力单位的相关性。用磷酸盐缓冲液将尿激酶标准品稀释至250,500,1 000,1 500,2 000 IU/mL,用移液枪分别取10 μL 溶液点样于纤维蛋白平板上,测定溶解圈两个相互垂直的直径,相乘作为溶解圈面积,测定3 次。将3 组数值取平均值,以尿激酶酶活为纵坐标,溶解圈面积为横坐标,绘制酶活标准曲线。
2) 纤维蛋白平板制作 参照Astrup[16]报道的方法,略加调整,制作纤维蛋白平板。
纳豆激酶酶活保持率计算公式:

1.3.2 纳豆菌存活率的测定 纳豆菌是日本传统发酵食品——纳豆的生产菌,该菌可以产生一系列抗菌肽类物质(通常有surfactin、iturin、fengycin等)[17],能够有效抑制食品腐败[18]。对纳豆菌存活率的测定方法采用稀释平板计数法,每组3 次试验,结果取平均值,方法详见参考文献[19]。纳豆菌存活率计算公式:

式中,B——冻干后的总菌群;A——冻干前的总菌群。
1.3.3 冷冻干燥保护剂的选择和优化 将脱脂乳粉、蔗糖、麦芽糊精、麦芽糖、乳糖、海藻糖、山梨醇等保护剂添加到 (添加量为4%,8%,12%,16%,20%)纳豆激酶原液中,抗坏血酸(添加量为0.4%,0.8%,1.2%,1.6%,2%)添加到纳豆激酶原液中,用无菌玻璃棒轻轻搅拌均匀后调节pH7.0~7.2,分装于培养皿中,厚度约10 mm,先于冰箱中预冷冻10 h,而后冷冻干燥处理。干燥后,于4 ℃冰箱保存备用。分别测定纳豆激酶酶活保持率和纳豆菌存活率。通过此方法先筛选出对纳豆激酶和纳豆菌保护效果较好的单一保护剂。在单因素试验基础上,对筛选出的保护剂复配处理后做正交试验,对保护剂的组合进行优化。
1.4 数据分析
通过Origin7.5、Design -Expert8.0 和SPSS Statistics20.0 分析所得数据。
2 结果与分析
2.1 脱脂乳粉对纳豆激酶酶活保持率和纳豆菌存活率的影响
以不同浓度的脱脂乳粉作为冻干保护剂,冻干后测定纳豆激酶酶活保持率和纳豆菌的存活率,结果见图1。
由图1可知,脱脂乳粉在冷冻干燥过程中对纳豆菌和纳豆激酶的保护作用比较显著。当脱脂乳粉的添加量为4%~8%时,纳豆激酶的酶活保持率和纳豆菌的存活率急剧增大,然后随着添加量的增加缓慢增大,最后趋于稳定。在脱脂乳粉的添加量16%时,两者均达到最大值。
脱脂乳粉对纳豆菌和纳豆激酶的保护作用较明显,是由于添加了脱脂乳粉后,使其大范围的覆盖在酶和菌体的表面,形成一层天然保护膜,较大程度地减少了纳豆菌和纳豆激酶暴露在空气中的面积,进而降低它们与氧气发生反应及蛋白质变性的几率。另外,脱脂乳粉还有防止细胞壁结构在冻干过程中遭到破坏而导致活性物质流失的作用,提升了纳豆菌的存活率。
经综合考虑,选取8%,12%,16% 3 个水平做下一阶段的正交试验。
2.2 蔗糖对纳豆激酶的酶活保持率和纳豆菌的存活率的影响
以不同浓度的蔗糖作为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌的存活率,结果如图2所示。纳豆菌和纳豆激酶在蔗糖的存在下,得到较好的保护。在蔗糖添加量4%~12%时,纳豆激酶酶活保持率显著提高。从统计数据看,当蔗糖添加量为12%时,纳豆激酶的酶活保持率达到38.4%,随着蔗糖添加量的增加,酶活保持率开始下降。对于纳豆菌,在蔗糖添加量为8%时,纳豆菌存活率便达到最大值44.6%,之后缓慢降低。
蔗糖是由一分子葡萄糖和一分子果糖脱水缩合而成的二糖,是一类低分子的糖类。在脱水缩合过程中醛基和酮基均遭到破坏,只剩分子内的羟基与纳豆菌和纳豆激酶表面存在的自由基发生反应,进行交联作用,生成更稳定的结构,降低纳豆激酶和纳豆菌暴露在空气中发生氧化反应的程度,蔗糖的保护作用不如脱脂乳粉显著。此外,蔗糖持水性较好,在溶液中可与水分子发生自由结合,减少了冻干过程中因水分的挥发而对纳豆激酶和纳豆菌有影响。
经综合考虑,选取8%,12%,16% 3 个水平进行下一阶段的正交试验。

图1 不同浓度的脱脂乳粉对纳豆激酶和纳豆菌的影响Fig.1 Effect of different concentrations of defatted milk powder on NK and bacillus natto

图2 不同浓度的蔗糖对纳豆激酶和纳豆菌的影响Fig.2 Effect of different concentrations of sucrose on NK and bacillus natto
2.3 麦芽糊精对纳豆激酶酶活保持率和纳豆菌存活率的影响
以不同浓度的麦芽糊精作为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌的存活率,结果见图3所示。麦芽糊精对纳豆菌和纳豆激酶也有一定的保护作用。随着麦芽糊精添加量的增加,纳豆菌存活率和酶活保持率在一定范围内均呈现较大幅度的提升,在麦芽糊精添加量分别为8%和12%时,纳豆激酶酶活保持率和纳豆菌存活率出现最大值,分别为21.9%和22.5%。继续增加浓度,反而使酶活保持率和纳豆菌存活率下降。
麦芽糊精是广泛应用于各领域中的一类冻干保护剂。当它溶于溶剂后,会吸收溶剂中大量的热量,使溶剂温度骤然降低,防止蛋白质被酶解、氧化;同时,它可降低溶液的冰点,抑制水结晶,较好地保护酶和菌体。
经综合考虑,选取4%,8%,12% 3 个水平进行下一阶段的正交试验。
2.4 麦芽糖对纳豆激酶的酶活保持率和纳豆菌的存活率的影响
以不同浓度的麦芽糖为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌的存活率,结果见图4。酶活保持率随着麦芽糖添加量的增加先急剧增加再急剧下降,然后趋于稳定,在添加量为8%时达到最大值14.9%;纳豆菌存活率随添加量的增加先显著升高后缓慢降低,在添加量为12%时达到最大值17.2%。虽然在一定范围内,随着麦芽糖添加量的增加,酶活保持率和纳豆菌存活率均出现较大幅度的提升,但其最大值都不理想(<20%),这主要是因为麦芽糖是一种还原糖,它的醛基在一定条件下与蛋白质的氨基发生美拉德反应,导致酶和菌体受损,从而影响酶活和菌体存活率。本试验不考虑将麦芽糖作为冻干保护剂。

图3 不同浓度的麦芽糊精对纳豆激酶和纳豆菌的影响Fig.3 Effect of different concentrations of maltodextrin on NK and bacillus natto
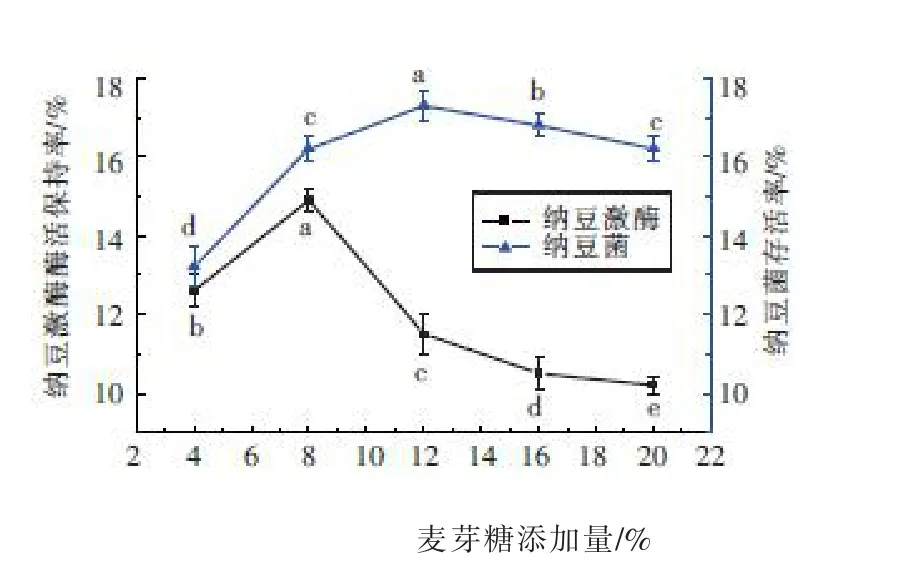
图4 不同浓度的麦芽糖对纳豆激酶和纳豆菌的影响Fig.4 Effect of different concentrations of maltose on NK and bacillus natto
2.5 抗坏血酸对纳豆激酶的酶活保持率和纳豆菌的存活率的影响
以不同浓度添加量的抗坏血酸作为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌的存活率,结果见图5所示。抗坏血酸对纳豆激酶和纳豆菌的保护作用极其显著。在添加量为0.4%时,酶活保持率和纳豆菌存活率分别达到40.2%和51.2%。随着抗坏血酸添加量的增加,酶活保持率和存活率急速增加,当添加量1.2%时,酶活保持率和纳豆菌存活率均达到最大值,分别为50.2%和62.1%。继续增加抗坏血酸的浓度,酶活保持率和菌存活率趋于稳定,最终选取0.4%,0.8%,1.2% 3 个水平进行下一阶段的正交试验。抗坏血酸是一类较常见的抗氧化剂,在纳豆激酶的冷冻干燥过程中,它可清除酶和菌体内的自由基,进而抑制蛋白质氧化,提高菌体细胞的活性。
2.6 乳糖对纳豆激酶的酶活保持率和纳豆菌存活率的影响
以不同浓度的乳糖为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌的存活率,结果见图6。乳糖对纳豆菌和纳豆激酶的保护作用并不理想,添加量4%~12%之间酶活保持率和存活率有明显的提升,然而其最优值很低,分别为14.6%和16.7%。其原因可能与麦芽糖相似,它的醛基与蛋白质的氨基发生非酶褐变反应,导致酶和菌体变性,影响蛋白质的生理活性和功能特性,从而影响酶活和菌体存活率。从保护效果角度考虑,不选择乳糖作为纳豆激酶的冻干保护剂。

图5 不同浓度的抗坏血酸对纳豆激酶和纳豆菌的影响Fig 5 Effect of different concentrations of ascorbic acid on NK and bacillus natto

图6 不同浓度的乳糖对纳豆激酶和纳豆菌的影响Fig.6 Effect of different concentrations of lactose on NK and bacillus natto
2.7 海藻糖对纳豆激酶的酶活保持率和纳豆菌的存活率的影响
以不同浓度的海藻糖为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌存活率,结果见图7。海藻糖对纳豆激酶酶活保持率影响较大,当添加量为8%时,可使酶活保持率达42.2%。随着添加量的增加,酶活保持率缓慢增加,添加量为16%和20%时,数值基本处于平稳状态。海藻糖是一类非还原性双糖,它使酶蛋白分子的失水部位通过氢键与外部游离的水分子相连接,增加了酶蛋白的稳定性,降低了蛋白分子因构象改变而变性的几率。
然而,海藻糖对纳豆菌的保护作用却不理想,最优值仅为29.1%,价格较其它冻干保护剂高,故不选择海藻糖作为纳豆激酶的冻干保护剂。
2.8 山梨醇对纳豆激酶的酶活保持率和纳豆菌存活率的影响
以不同浓度的山梨醇作为冻干保护剂,冻干后测定纳豆激酶的酶活保持率和纳豆菌存活率,结果见图8。山梨醇对纳豆菌和纳豆激酶的保护作用相差甚远,添加量4%~12%之间,纳豆菌存活率显著增加,而酶活保持率基本不变;在添加量8%时达到最大值12.5%。山梨醇可以利用自身的结构与纳豆菌菌体表面的细胞膜相互结合,起到保护菌体细胞膜的作用,使其结构更加稳定。此外,山梨醇暴露在空气中极易吸水,在一定程度上影响了冻干粉的储存稳定性,因此,不选择山梨醇作为纳豆激酶的冻干保护剂。

图7 不同浓度的海藻糖对纳豆激酶和纳豆菌的影响Fig.7 Effect of different concentrations of trehalose on NK and bacillus natto

图8 不同浓度的山梨醇对纳豆激酶和纳豆菌的影响Fig.8 Effect of different concentrations of sorbitol on NK and bacillus natto
2.9 正交试验优化纳豆激酶冻干保护剂
选取脱脂乳粉、蔗糖、麦芽糊精和抗坏血酸4种冻干保护剂进行4 因素3 水平的正交试验,共9 组试验,每组做3 次平行试验,进一步优化其冻干参数。试验设计及结果见表1。
对于纳豆激酶的酶活保持率,各因素对试验的影响显著性顺序为A(脱脂乳粉)>D(抗坏血酸)>C(麦芽糊精)>B(蔗糖),最佳方案为A3B2C2D3;而对于纳豆激酶的纳豆菌存活率,各因素对试验的影响显著性顺序为A(脱脂乳粉)>D(抗坏血酸)>B(蔗糖)>C(麦芽糊精),最佳方案为A3B1C3D3。
这两个最优方案并不完全相同,脱脂乳粉和抗坏血酸的添加量对于酶活保持率和纳豆菌存活率都是最重要的影响因素,两者先后顺序也一致,且均选择第3 水平为试验的最佳水平。蔗糖和麦芽糊精对试验的影响是次要因素。结合实际需求,选取A3B1C2D3作为最佳冻干保护剂组合,即:脱脂乳粉添加量16%,抗坏血酸添加量1.2%,麦芽糊精添加量8%,蔗糖添加量8%。
通过验证,在此条件下冻干的纳豆激酶酶活保持率为79.8%,纳豆菌存活率为83.2%,较单一保护剂有较大提升,这是因为各种保护剂间存在协同作用,使冻干效果显著提高。

表1 正交试验设计及结果Table 1 The design and results of orthogonal experiment
3 结论
从8 种冻干保护剂中选出对纳豆激酶和纳豆菌保护效果较好的,做正交试验。通过极差分析并结合实际,确定最佳的冻干保护剂组合,即:脱脂乳粉添加量16%,抗坏血酸添加量1.2%,麦芽糊精添加量为8%,蔗糖添加量8%。通过验证,在此条件下冻干的纳豆激酶酶活保持率为79.8%,纳豆菌存活率为83.2%,较单一保护剂有较大提升,冻干效果显著提高。

