不同发酵剂对发酵香肠中风味物质释放及有害生物胺控制的影响
王德宝 赵丽华 田建军 赵富元 吕金积 张海荣 靳 烨*
(1 内蒙古农业大学食品科学与工程学院 内蒙古呼和浩特010018 2 内蒙古蒙元宽食品有限公司 内蒙古古巴彦淖尔015000 3 内蒙古晶鑫食品有限公司 内蒙古古巴彦淖尔015000)
发酵香肠在市场上占有份额较少,因其呈现出诱人的玫瑰色、独特的风味而深受消费者的青睐,然而其食品安全问题也备受关注。发酵香肠是指将绞碎的瘦肉与丁状脂肪及辅料混匀后灌入肠衣,经自然或添加外源发酵剂发酵、干燥成熟制成pH 值低于安全酸度5.3 的一类发酵肉制品[1-3]。pH、风味物质等变化离不开糖类、脂肪、蛋白质等物质的分解氧化[4]。封丽[5]、陈肖等[6]研究了腌制剂、脂肪酶中式香肠风味物质产生的贡献作用。Toldra等[7]研究发现干腌火腿中绝大部分挥发性风味物质因脂类而自动氧化形成。蛋白质分解产生游离氨基酸经脱羧、脱氨或羰基等作用,可产生一系列具有良好嗅感的物质[8]。游离氨基酸也是生物胺类物质主要前体,SILLA[9]研究表明少量生物胺对人体具有重要功能和生理调控,若体内积累过量则会导致机体不适,严重会危及生命。Armagan[10]研究发现过量生物胺与肉制品中残留亚硝酸盐易形成具有强致癌作用的亚硝胺物质。良好的风味不仅可赋予香肠良好品质,也可增加消费者购买欲望。同时肉制品食用安全性也引起广泛关注。提高香肠良好风味物质含量及控制香肠有害生物胺含量尤为重要。本试验通过添加植物乳杆菌与肉葡萄球菌发酵剂,探究在发酵香肠加工过程,发酵剂对风味物质释放及有害生物胺控制的影响。
1 材料与方法
1.1 试验材料
原料肉(m原料肉∶m羊肉,肥瘦比为1∶4),源自内蒙古巴彦淖尔乌拉特苏尼特羊后腿及羊尾。肠衣:25~30 mm 羊小肠。
发酵剂:植物乳杆菌(Lactobacillus plantarum)与肉葡萄球菌(Staphylococcus carnosus),由内蒙古农业大学肉品微生物实验室提供。
主要药品:硝酸钠、亚硝酸钠(分析纯),上海国药集团;单磺酰氯、组胺、β-苯乙胺、酪胺、尸胺和1,7-二氨基庚烷(色谱级),美国Sigma-Aldrich公司;甲醇、正己烷及丙酮(色谱级),上海安谱实验科技股份有限公司。
主要仪器与设备:1260 高效液相色谱仪,美国安捷伦公司;HD-3A 型智能水分活度测量仪,深圳市银都科技有限公司;TCP2 全自动测色色差计,北京奥依克光电仪器;Master DHS 动态顶空进样器,美国Thermo 科技有限公司;GC-MS DSQ II 单四极杆气相色谱质谱联用仪,美国Thermo 公司;TG16-WS 台式高速离心机,湖南离心机仪器有限公司;LRH-250-HS 型恒温恒湿培养箱,沈阳亮衡天平仪器有限公司。
1.2 试验方法
1.2.1 发酵香肠工艺配方[3]配方:羊后腿肉80%、羊尾肥膘20%、蔗糖0.5%、食盐2.5%、亚硝酸钠70 mg/kg、葡萄糖0.5%、硝酸钠100 mg/kg、抗坏血酸0.05%、发酵剂107CFU/g。
发酵香肠加工条件见表1。

表1 发酵香肠加工条件Table 1 The processing conditions of fermented sausage
1.2.2 试验设计 通过预试验及单因素模拟试验,获得发酵剂植物乳杆菌与肉葡萄球菌最佳复配比1∶2。试验共分3 组:第1 组为对照组(不加外源发酵剂),第2 组为单一植物乳杆菌,第3 组为植物乳杆菌和肉葡萄球菌复配发酵剂。样品分别于灌肠后(0)、发酵结束(3 d)、干燥中期(6 d)、成熟(9 d)4 个工艺点各随机抽取,并测定其理化品质。
1.2.3 理化指标测定 参照GB/T 9695.5-2008《肉与肉制品pH 测定》、GB 5009.33-2010 《食品中亚硝酸盐与硝酸盐的测定》、GB/T5009.208-2008《食品中生物胺含量测定》测定香肠pH、亚硝酸盐及生物胺含量[11-13];使用HD-3A 型智能水分活度仪测定Aw。
1.2.4 风味测定[14]气相色谱GC 条件:色谱柱为TR-WAX(30 m×0.25 mm×0.25 μm),载气为氦气,流速1.0 mL/min。升温程序:初始温度35 ℃,保持2 min;以4 ℃/min 升至160 ℃,保持2 min;再以10 ℃/min 升至240 ℃,保持10 min。质谱条件:接口温度250 ℃,离子源温度250 ℃,电子方式为EI,溶剂延长时间3 min,离子扫描范围50~300 amu。DHS:保温3 min,炉温75 ℃,剥离时间8 min,流速40 mL/min;干燥时间1 min,流速30 mL/min;注射时间3 min,接口处温度250 ℃,焙烤时间20 min,流速80 mL/min,传送带温度200 ℃,转化阀200 ℃。
1.3 数据处理
采用Excel 和SPSS19.0 对数据进行统计处理和显著性分析,P<0.05 表示差异显著,同组不同制作时间差异性用大写字母表示,同一时间不同组间差异用小写字母表示,相同字母表示不显著。
2 结果与分析
2.1 不同发酵剂对发酵香肠品质影响
2.1.1 发酵剂对发酵香肠pH 的影响 由图1可知,灌肠后0 d,3 组发酵香肠pH 值均为5.8,与新鲜原料肉酸度值相差甚微,说明在腌制过程中菌株生长活性微小,几乎无酸产生。发酵过程,发酵剂通过糖酵解将碳水化合物快速分解为乳酸等小分子有机酸[15],促使香肠pH 急剧下降;3 d 发酵结束,复配组pH(5.07)<单一组pH(5.13)<对照组pH(5.22)(P<0.05)。3~6 d 干燥过程,香肠所处环境温度、RH 急剧降为15 ℃、80%~85%,发酵剂代谢活性及产酸能力可能受到抑制,使pH 下降速率减缓,干燥结束复配组pH(4.74)降到组中最低,说明添加复配发酵剂可加快香肠产酸速率。6~9 d,随着产酸速率下降及香肠中水分和酸性物不断挥发,蛋白可能被分解产生碱性物质,含量增加[16-17],使香肠pH 在成熟过程中呈上升趋势。发酵结束,复配组香肠pH(4.94)显著低于发酵香肠安全酸度(5.3)(P<0.05)[18]。
2.1.2 发酵剂对发酵香肠水分活度(Aw)的影响 水分活度(Aw)已成为衡量食品保藏期长短的一个重要指标,可以说Aw 是控制食品腐败的重要因素。Aw<0.9 时,大部分细菌生长受到抑制;Aw<0.6 时,霉菌及耐盐细菌代谢活性几乎为零。从酶与Aw 关系来看,Aw 高、低影响酶促反应底物浓度及酶构象,Aw<0.85 时,酶活性大幅下降[19-20]。
由图2可知,0 d,3 组发酵香肠Aw 值均为0.97。0~3 d 发酵过程,高湿条件(RH:90%~95%)几乎抑制香肠中水分向外扩散的可能性,发酵结束时发酵香肠Aw 仍为0.97。3~6 d 干燥期,因香肠内外环境温度和RH 差,促使水分逐渐向外部环境扩散,结束时3 组Aw 分别降为0.86,0.85,0.83,且复配组Aw 值<单一组<对照组,表明发酵剂有助于香肠Aw 的降低。6~9 d 成熟过程,3 组香肠Aw 值持续下降,相比干燥过程,下降幅度较小,可能是由于香肠肉馅外层水分扩散速率快于内层,导致外层较为干燥,阻碍了肉馅中心水分的散发;香肠发酵结束,3 组Aw 值分别降为0.80,0.79 及0.76。

图1 发酵羊肉香肠pH 变化Fig.1 pH changes of the fermented mutton sausages

图2 发酵羊肉香肠Aw 变化Fig.2 Changes of Aw value of the fermented mutton sausages
2.1.3 发酵剂对发酵香肠中亚硝酸盐的影响 亚硝酸盐具有发色、抗氧化及防腐作用,可消除原料肉不适风味,提高产品质量[21]。然而其残留过量会与香肠中生物胺生成具有强致癌作用的亚硝胺,是目前食品界备受关注的食品安全问题[22]。
由图3可知,0 d 时3 组亚硝酸盐含量均为70 mg/kg。0~3 d 发酵过程,低pH 值使部分亚硝酸盐转化为亚硝酸,与肌红蛋白结合生成亚硝基肌红蛋白[23-24],香肠中亚硝酸盐残留量呈下降趋势,3d 末复配组亚硝酸盐含量(66 mg/kg)<单一组(68 mg/kg)<对照组(69 mg/kg)(P<0.05)。干燥过程环境温度及RH 急剧降低,使硝酸还原酶活性被抑制,3 组发酵香肠亚硝酸盐含量急剧下降,对照组、单一组及复配组3 组含量分别为16.8,15.2,13.5 mg/kg,且3 组间差异显著(P<0.05)。成熟结束即为成品,复配组亚硝酸盐残留量(12.6 mg/kg)显著低于其它两组,更低于国家食品安全规定最高允许残留量30 mg/kg[25]。
2.2 发酵香肠中生物胺
2.2.1 发酵剂对发酵香肠中β-苯乙胺含量的影响 苯乙胺是一种芳香胺,可被单胺酶氧化分解,可有效防止其在脑部集中。Bover-cid[26]研究发现,精胺与亚精胺是香肠原料肉中最主要的生物胺。朱志远等[27]试验表明,发酵剂和成熟时间对精胺和亚精胺含量基本没有影响。本试验主要探究不同发酵剂对发酵香肠制作过程(发酵、干燥及成熟过程)有害生物胺的抑制作用。
由图4可知,发酵结束时复配组β-苯乙胺含量(2.81 mg/kg)<单一组(3.83 mg/kg)<对照组(6.89 mg/kg),且组间含量差异显著(P<0.05)。3~6 d 干燥过程,各组β-苯乙胺含量呈下降趋势,对照组下降幅度最大,此时内源酶对苯乙胺分解作用大于外源酶。6~9 d 成熟过程,较低温度及湿度对香肠中微生物及酶代谢活性均产生较强抑制作用,β-苯乙胺呈上升趋势,其中添加发酵剂两组苯乙胺含量增加幅度高于对照组。

图3 发酵羊肉香肠中亚硝酸盐含量变化Fig.3 Changes of the nitrite content of the fermented mutton sausages
2.2.2 发酵剂对发酵香肠中尸胺含量的影响尸胺虽对人体无害,但可通过抑制双胺氧化酶、羟甲基转化酶及脱毒酶的活性而潜在增加组胺含量及毒性[28]。
由图5可知,3 d 发酵结束时3 组尸胺的含量较高,且对照组(9.85 mg/kg)显著高于复配组(8.53 mg/kg)与单一组(8.40 mg/kg)(P<0.05),单一组与复配组间尸胺含量差异不明显(P>0.05)。干燥过程中,各组尸胺含量呈下降趋势,干燥结束时结果与发酵结束差异显著(P<0.05)。6~9 d,3组尸胺含量大幅下降,复配组含量(4.02 mg/kg)<单一组(4.10 mg/kg)<对照组(4.65 mg/kg),说明通过发酵、成熟及添加植物乳杆菌与肉葡萄球菌复配发酵剂能有效较低香肠中尸胺含量。
2.2.3 发酵剂对发酵香肠中组胺含量的影响组胺是组氨酸经脱羧酶脱羧后形成,是食品中毒性最强的胺。其毒性效果取决于组胺的吸收浓度以及其它胺的存在情况,甚至还包括胺氧化酶的活性以及个人肠内的生理状况。美国食品药品管理局 (FDA) 规定食品中组胺含量<50 mg/kg,酪胺<100 mg/kg。欧洲在鱼产品中规定组胺最高限量为100 mg/kg[30]。由表2可知,香肠加工前期3组香肠均未检出组胺。成熟末期,对照组组胺含量为3.036 mg/kg,单一组为2.92 mg/kg,复配组为2.89 mg/kg,复配组<单一组<对照组。综上表明,添加复合发酵剂有助于降低香肠中有害生物胺残留。

图4 发酵羊肉香肠中β-苯乙胺含量变化Fig.4 The content changes of β-phenylethylamine in fermented mutton sausages

图5 发酵羊肉香肠中尸胺含量变化Fig.5 The content change of cadaverine in fermented mutton sausages

表2 发酵羊肉香肠中组胺含量变化Table 2 The content changes of histamine in fermented mutton sausages
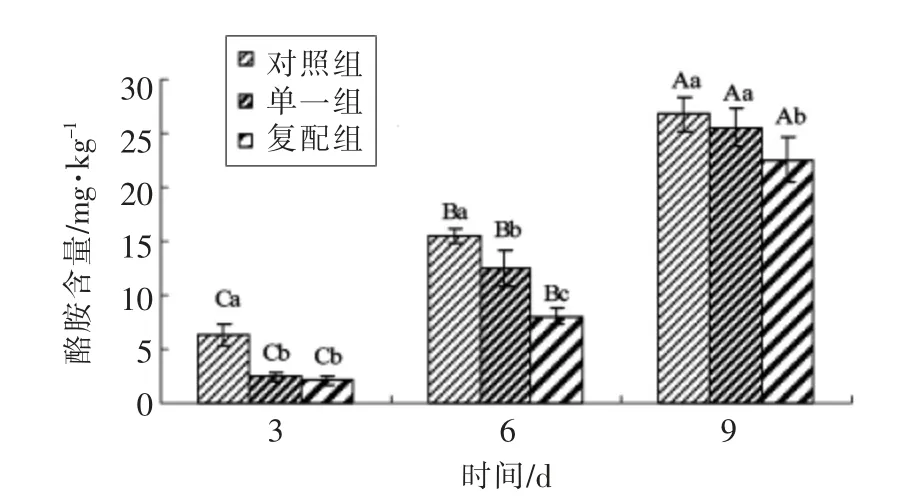
图6 发酵羊肉香肠中酪胺含量变化Fig.6 The content changes of tyramine in fermented mutton sausages
2.2.4 发酵剂对发酵香肠中酪胺含量的影响由图6可知,发酵结束时3 组香肠酪胺含量较低,结果为对照组(6.32 mg/kg)>单一组(2.42 mg/kg)>复配组(2.11 mg/kg)。3~6 d 干燥过程,酪胺含量呈快速上升趋势,干燥结束时酪胺含量显著高于发酵结束时(P<0.05),组间仍是对照组(15.48 mg/kg)>单一组 (12.54 mg/kg)>复配组 (8.07 mg/kg)。在6~9 d 成熟过程,各组酪胺含量是干燥结束时的2~3 倍,而复配组含量(22.54 mg/kg)显著低于其它两组。综上表明,苯乙胺与酪胺同时产生,且酪胺在香肠中呈现逐渐增加趋势,而成熟结束各组含量均低于100 mg/kg;相比对照和单一组,复合发酵剂对酪胺含量变化有一定的抑制作用。综观整体,在香肠制作各阶段点,成品时酪胺含量最高,与张慧超等[29]研究结果一致。
2.3 香肠中风味物质
香肠中风味物质主要源于三大营养物质分解及生化反应。碳水化合物在发酵剂作用下被分解产生乳酸、乙酸、琥珀酸等,可赋予香肠特殊风味物质;糖与蛋白质经过美拉德反应产生呋喃、吡啶、吡嗪、噻吩、噻唑、吡咯、咪唑以及环烯硫化物,是香肠产生肉香味主要途径[31]。此外,肉中丰富的不饱和脂肪酸易被氧化分解产生酮、醛及内酯等对香肠香味具有重要贡献的风味物质[8]。风味是评价肉制品品质特征的重要因素,良好的风味不仅可赋予香肠良好品质,也可增加消费者购买欲望。

表3 发酵羊肉香肠中风味物质相对含量Table 3 Relative contents of volatile flavor compounds in fermented mutton sausages
由表3可知,通过添加植物乳杆菌与肉葡萄球菌制作发酵香肠,在香肠成熟结束即为成品时共鉴定出26 种挥发性风味物质,主要包括醇类5种,醛类4 种,酯8 种,酸类3 种,烃类5 种及醚类1 种。从对照组共检出15 种挥发性物质,其中醇类1 种,醛类2 种,酯6 种,酸类1 种,烃类4 种及醚类1,而单一组与复配组均检出26 中风味物质。比较3 组6 类风味物质相对含量,可知含量最为丰富是醇类,醛类次之,其次是酯类、烃类,而醚类含量最低。结果表明:复配组醇类风味物质含量8.90 mg/kg,单一组为8.66 mg/kg,显著高于对照组1.27 mg/kg;复配组与单一组醛类物质含量分别为8.04,6.24 mg/kg,远高于对照组0.40 mg/kg。对于酯类、烃类、酸类等风味物质,两发酵剂组仍高于对照组。这一结果可能与接种发酵剂有关,产生机理有待进一步研究。综上可知,醇类、醛类是香肠中主要风味贡献物质。
3 讨论与结论
通过添加植物乳杆菌与肉葡萄球菌发酵剂将试验分为3 组,探究不同发酵剂对发酵香肠加工过程品质变化、风味物质释放及有害生物胺控制的影响。发酵过程复配组产酸速率>单一组>对照组,且在干燥结束时降到组中最低4.74,低于发酵香肠安全酸度5.3(P<0.05);随着pH 降低,使蛋白质对水分束缚能力下降,促使复配组Aw 下降速率快于其它两组;低pH 可使亚硝酸盐与肌红蛋白间接结合,生成促进香肠显色的亚硝基肌红蛋白,并抑制硝酸盐还原酶活性,成品时复配组亚硝酸盐12.6 mg/kg,低于单一和对照两组,更低于国家安全规定30 mg/kg[25]。
精胺和亚精胺在香肠制作过程含量变化微小,且为肉中所固有胺类物质,未对其加以分析[27]。成品时对照组β-苯乙胺含量<复配组<单一组,复配组尸胺含量 (4.02 mg/kg)<单一组(4.10 mg/kg)<对照组(4.65 mg/kg),组胺仅在9 d 成品时检出,且复配组(2.89 mg/kg)<单一组(2.92 mg/kg)<对照组(3.036 mg/kg),相比4 种生物胺,酪胺含量最高,整个过程酪胺含量呈上升趋势,始终为复配组含量<单一组<对照组,其存在有助于增强组胺毒性[31],说明添加复配发酵剂有利于抑制毒性最强组胺和酪胺的释放,提高香肠安全性。成品时测的发酵组风味物质26 种,对照组仅检出15 种,且发酵组风味物质含量显著高于对照组(P<0.01),说明添加发酵剂有助于香肠中风味物质释放。
综上可知,添加复配发酵剂不仅有利于缩短香肠发酵周期,快速降低水分含量,还有助于抑制和降低香肠中亚硝酸盐及有害生物胺含量,提高香肠安全性和延长货架期,增加香肠中风味物质种类及含量。

