基于DPO引物检测猪流行性腹泻病毒荧光定量RT-PCR方法的建立及初步应用
王以欣,王紫薇,汉武娇,王 丽,姜艳平,崔 文,周 晗,乔薪瑗,唐丽杰,2,李一经,2,徐义刚,2*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.农业部动物疫病病原生物学重点实验室/东北科学观测实验站,黑龙江哈尔滨150030)
由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的猪流行性腹泻病(PED)是以腹泻、脱水和呕吐为特征的一种急性、传播迅速的病毒性传染病,不同年龄的猪均易感,特别是对新生仔猪的危害较为严重,感染仔猪的发病率和死亡率较高[1-3]。该病在1971年首次报道于英国[4],我国于1973年首次在上海发现该病。近年来,PED的发生在我国呈不断上升趋势,给养猪业造成了重大的经济损失。
在临床上,常见PDEV与猪传染性胃肠炎病毒、猪轮状病毒混合感染,难以区分和鉴别[5]。因此,建立快速而准确的检测方法对PED的临床诊断以及流行病学调查具有重要的意义。荧光定量PCR方法灵敏度高,可以实时监测反应进程,是目前疾病诊断中最为常用的检测方法,被广泛应用于各类病原检测。引物设计是决定PCR特异性的主要因素之一。双启动寡核苷酸引物(DPO)具有极高的扩增特异性,其5'或3'端如果有3个以上的碱基与模板发生错配,反应扩增效率就会极大地降低甚至终止扩增反应,同时DPO引物的有效退火温度范围较宽,实验过程中不需要对PCR反应的退火温度进行优化[6-9]。本研究以PEDV的N基因为靶基因,设计了PEDV的DPO引物,经过条件优化,建立了基于DPO引物检测PEDV的荧光定量RT-PCR方法,为PEDV的准确检测和流行病学调查提供技术支持。
1 材料与方法
1.1 主要实验材料 PEDV LJB-03株、猪轮状病毒(PRoV)、传染性胃肠炎病毒(TGEV)、牛轮状病毒(BRV)、牛病毒性腹泻病毒(BVDV)、传染性造血器官坏死病毒(IHNV)、传染性法氏囊病毒(IBDV)、猫传染性腹膜炎病毒(FIPV)、牛呼吸道合胞体病毒(BRSV)、牛细小病毒(BPV)由本实验室分离保存;dNTP Mix、ExTaqDNA聚合酶、pMD19-T simple载体、SYBR Green I染料、大肠杆菌TG1感受态细胞、Superscript Reverse Transcriptase Reagent Kit购自TaKaRa公司;DNA胶回收试剂盒、质粒提取试剂盒、TRIzol试剂购自Invitrogen公司。272份腹泻仔猪临床样品(粪便和小肠组织)由本实验室采集自哈尔滨周边规模化猪场。
1.2 引物设计 根据GenBank中登录的PEDV LJB-03(DQ072726)的N基因序列,利用Oligo 6.0软件设计引物PEDV-N-F/PEDV-N-R,用于扩增全长N基因序列,以构建质粒标准品。DPO引物的设计方法如下:根据目的基因先确定DPO引物的短3'-端,长度为6 bp~15 bp,同时满足其GC含量在40%~80%范围内,然后反向延伸18 bp~25 bp,使其Tm值大于65℃,形成DPO引物的长5'-端,中间用多聚次黄嘌呤肌苷(poly I)连接。同时,以设计DPO引物的相同基因序列设计常规引物PEDV-C-F/PEDV-C-R。引物序列见表1,引物由上海生工生物工程技术服务有限公司合成。
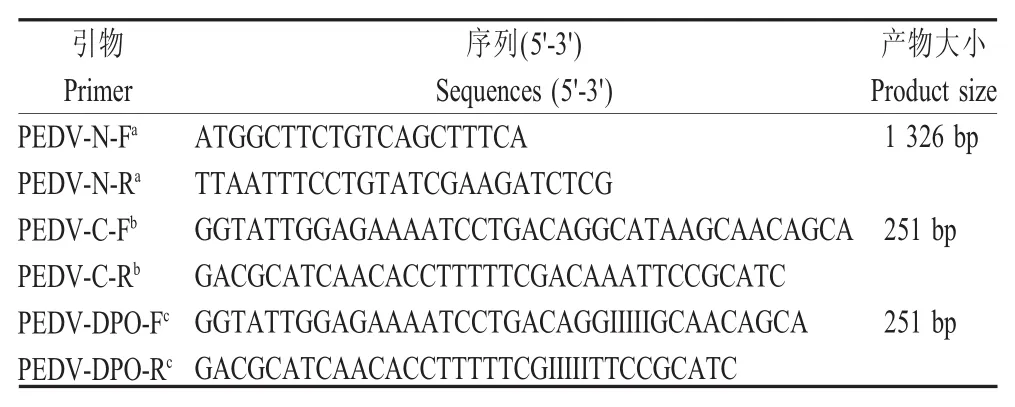
表1 引物序列Table 1 Primers used in this study
1.3 DPO引物与常规引物的退火温度的优化 取Vero细胞增殖的PEDV LJB-03株病毒液,经TRIzol法提取总RNA,反转录为cDNA,以其为模板,分别利用DPO引物PEDV-DPO-F/PEDV-DPO-R和常规引物PEDV-C-F/PEDV-C-R在退火温度为45℃~65℃条件下PCR扩增目的基因片段,经0.8%琼脂糖凝胶电泳检测,分析退火温度对DPO引物和常规引物扩增效果的影响。
1.4 质粒标准品与标准曲线的建立 利用引物PEDV-N-F/PEDV-N-R,以1.3中获得的cDNA为模板,经PCR扩增PEDV N基因,并与pMD19-T simple载体连接,构建重组质粒pMD-N,经转化大肠杆菌TG1感受态细胞提取质粒,经PCR鉴定为阳性的质粒测定浓度,计算其拷贝数后作为质粒标准品备用。将质粒标准品pMD-N 10倍倍比稀释(1.64×108拷贝 /μL~1.64×104拷贝 /μL),以每个稀释度的质粒标准品为模板进行荧光定量PCR反应(每个浓度梯度3次平行重复试验)。反应体系(20 μL)为:SYBR Green I Universal Master Mix 10 μL、DPO引 物 PEDV-DPO-F/PEDV-DPO-R 各 0.2 μL、DEPC水 8.6 μL、模板 1 μL。反应条件为:95℃ 10 min;95℃15 s,60℃1 min,40个循环。以质粒标准品拷贝数的对数作为X轴,Ct值(循环阈值)作为Y轴,建立质粒拷贝数与循环阈值对应的标准曲线。
1.5 特异性试验 分别提取PEDV、PRoV、TGEV、BRV、BVDV、IHNV、IBDV、FIPV、BRSV的基因组RNA,反转录为cDNA,以该cDNA及提取的BPV基因组DNA为模板,利用本研究建立荧光定量PCR方法进行扩增,以评估该方法的特异性。
1.6 敏感性试验 将浓度为1.64×108拷贝/μL的质粒标准品 pMD-N 10倍倍比稀释(1.64×107拷贝/μL~1.64×101拷贝 /μL),以每个稀释度的质粒标准品为模板,分别进行荧光定量PCR扩增和常规RT-PCR扩增,以确定该方法的最低检测限,并比较两种方法的敏感性。
1.7 重复性试验 以3个不同浓度的质粒标准品pMD-N为模板,利用本研究建立的荧光定量PCR方法在同一时间进行该方法的批内重复性试验;以上述质粒标准品为模板,在不同时间分别利用该荧光定量PCR方法扩增,以进行该方法的批间重复性试验,每个检测重复5次,经统计分析,以确定本方法的检测重复性和稳定性。
1.8 临床样品的检测 将采集的临床腹泻仔猪的粪便样品直接采用TRIzol法提取总RNA,采集的小肠组织样品从液氮取出直接研磨后采用TRIzol法提取总RNA,然后将提取的RNA反转录为cDNA作为模板,利用建立的荧光定量PCR方法扩增,并与常规RT-PCR方法(所用引物为PEDV-C-F/PEDV-C-R)的检测结果进行比较,同时对本实验建立方法检测结果为PEDV阳性的样品进行靶基因测序分析,以验证该方法检测结果的准确性。
2 结果
2.1 DPO引物与常规引物退火温度优化结果 利用DPO引物进行靶基因的PCR扩增,在45℃~65℃退火温度范围内均能够高效地扩增出靶基因片段,而常规引物则存在最适退火温度,其最佳退火温度为54℃(图1),表明DPO引物具有较宽的有效退火温度范围。
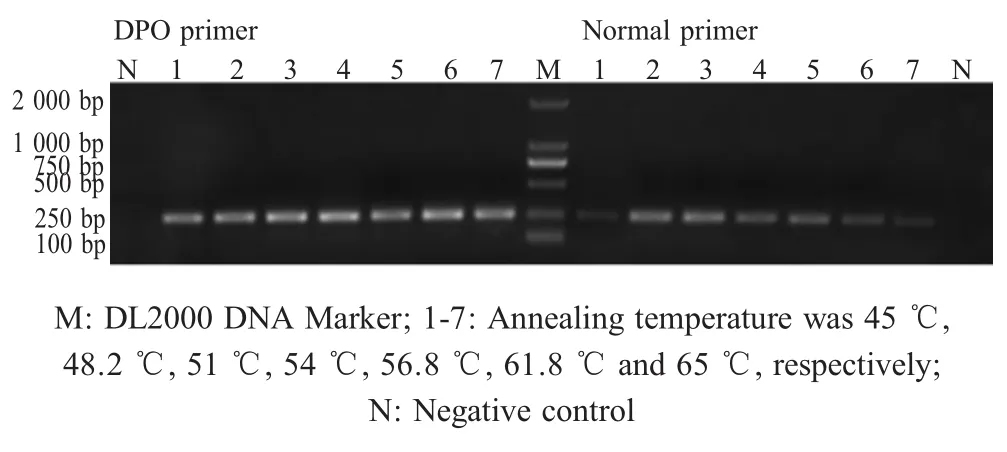
图1 DPO引物与常规引物不同退火温度扩增靶基因的优化结果Fig.1 Optimization results of amplification of target gene by DPO primer and conventional primer at different annealing temperature
2.2 质粒标准品的鉴定及标准曲线的建立 以获得的cDNA为模板,利用引物PEDV-N-F/PEDV-N-R经PCR扩增PEDV N基因,连入pMD19-T simple载体,并转化大肠杆菌TG1,提取质粒并经PCR鉴定(图2),测定阳性重组质粒pMD-N浓度,经计算其浓度为1.64×108拷贝/μL。将质粒标准品10倍倍比稀释后按照本研究建立的方法扩增,以建立该方法的标准曲线。结果显示,扩增方程为:y=-3.593x+45.034,相关系数为0.999,线性关系良好,扩增效率为92.43%,依据该方程可以对样品中的病毒核酸进行定量(图3)。
2.3 特异性试验结果 利用本研究建立的方法检测PEDV、PRoV、TGEV、BVDV、BRV、IBDV、IHNV、BPV、FIPV及BRSV的核酸,结果显示,仅PEDV为阳性扩增结果,其它病毒均为阴性结果(图4),表明所建立的方法具有较强的特异性。
2.4 敏感性试验结果 将浓度为1.64×108拷贝/μL的质粒标准品10倍倍比稀释后分别作为模板,利用本研究建立的方法进行扩增,结果显示,该方法对质粒标准品的检测限为1.64×101拷贝/μL(图5A),而常规RT-PCR方法对相应质粒标准品的检测限约1.64×102-3拷贝/μL(图5B),表明本研究建立的方法敏感性较高。
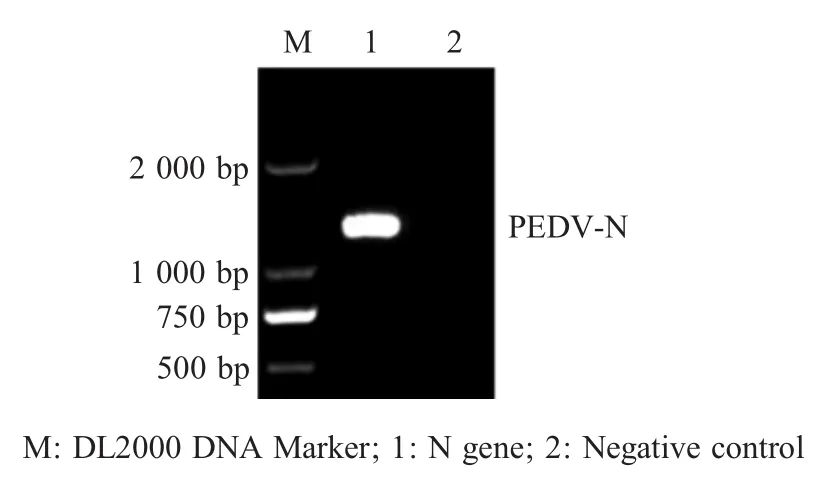
图2 重组质粒标准品pMD-N的PCR鉴定结果Fig.2 Identification result of plasmid standard pMD-N by PCR
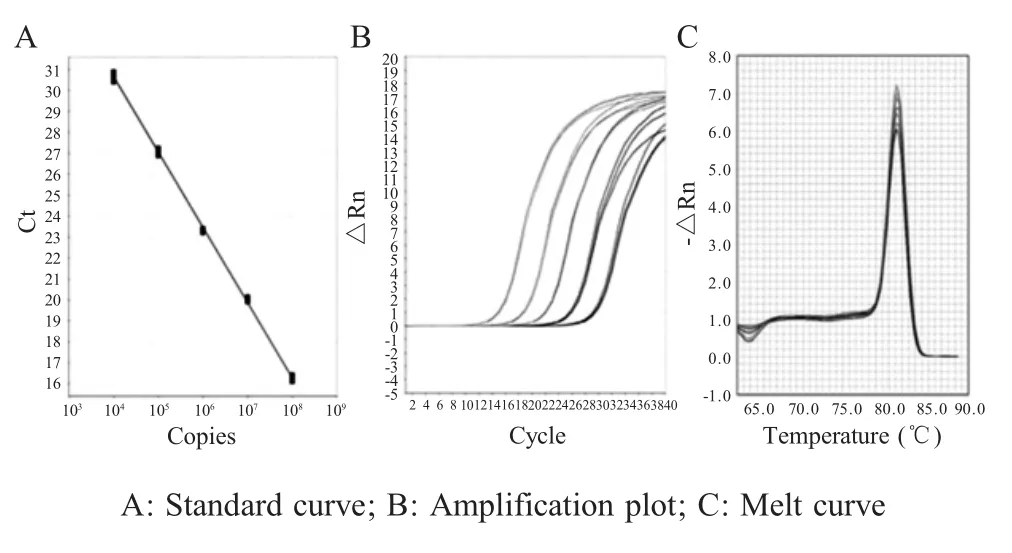
图3 荧光定量RT-PCR方法标准曲线的建立Fig.3 Standard curve of DPO-based fluorescent quantitation RT-PCR method

图4 特异性试验结果Fig.4 Specificity test of the DPO-based fluorescent quantitation RT-PCR method
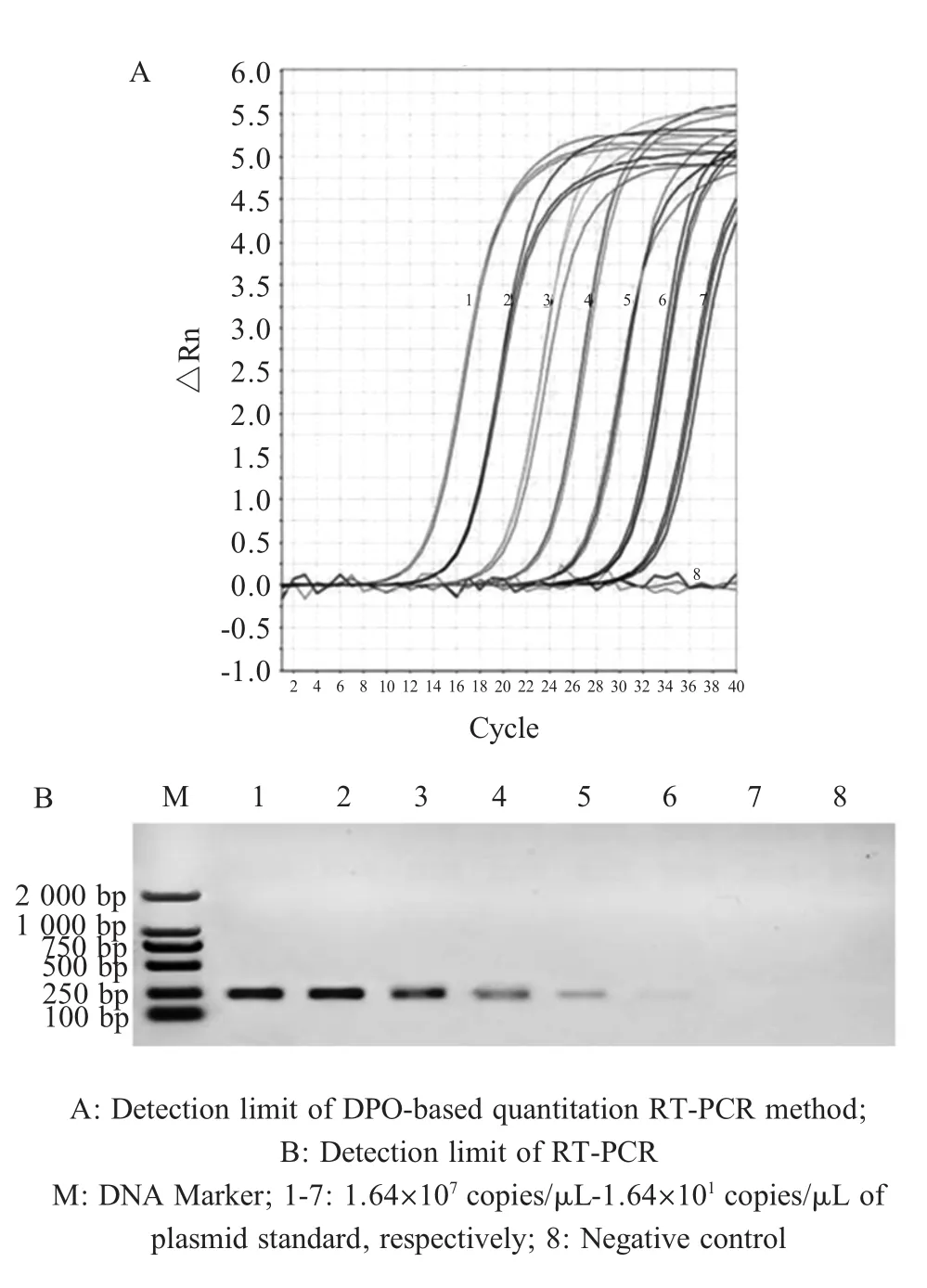
图5 敏感性试验结果Fig.5 Sensitivity of DPO-based fluorescent quantitation RT-PCR method
2.5 重复性试验结果 利用本研究建立的方法对不同浓度的质粒标准品进行组内、组间重复性试验,结果显示,组内和组间变异系数均小于1.0%(表2),表明本研究建立的方法具有较好的重复性。
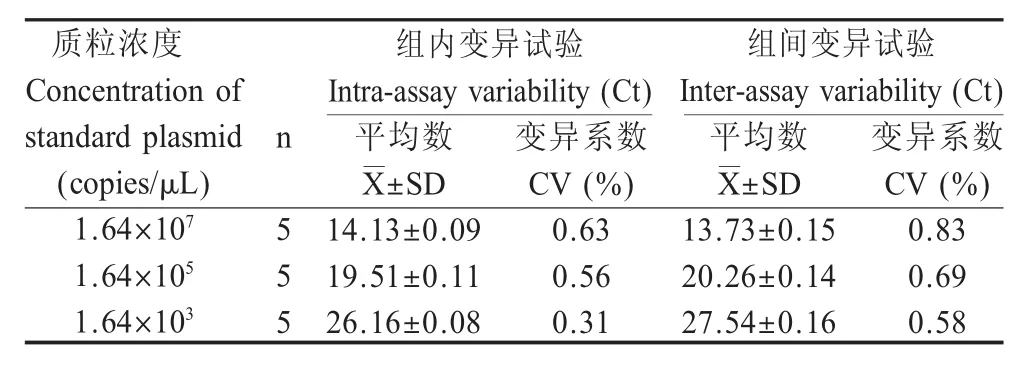
表2 重复性试验结果Table 2 Intra-assay and inter-assay reproducibility test of the DPO-based fluorescent quantitation RT-PCR method
2.6 临床样品检测 利用本研究建立的方法对采集的272份仔猪临床腹泻样品进行检测,结果共检出39份PEDV阳性样品,阳性率为14.34%,与常规RT-PCR方法检测结果(36份PEDV阳性样品)的符合率为92.31%(表3);对本研究建立方法检测出的PEDV阳性样品经PEDV N基因测序验证结果显示,本研究建立的方法检测结果的准确率为100%,表明该方法具有较好的检测准确性。
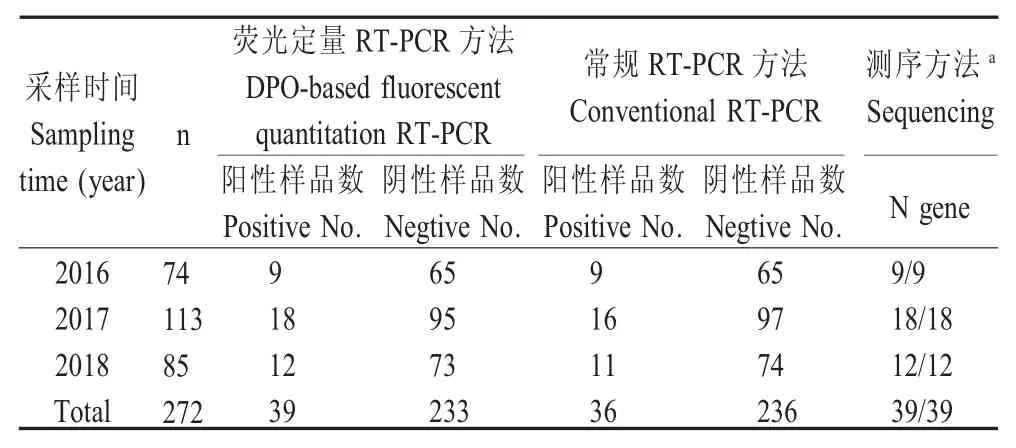
表3 临床样品的检测结果Table 3 Detection results of samples by DPO-based fluorescent quantitation RT-PCR assay
3 讨论
PEDV是危害我国养猪业的主要病毒性病原之一,在临床上常与TGEV、PRoV呈现混合感染[10-11],建立快速、准确的检测方法对PEDV的鉴别检测和流行病学调查具有重要意义。基于SYBR Green染料的荧光定量PCR方法是目前被广泛采用的快速检测方法之一,由于SYBR Green荧光染料的特异性较差,因此这类检测方法对引物的设计要求极为严格,引物内不能出现发夹结构、反向重复序列,引物间也不能出现引物二聚体,更不能与模板发生错配扩增等。同时,在引物的特异性筛选中,既要保证引物的特异性,又要保证引物的各项参数(如错配率即特异性、二聚体、发卡结构、Tm值等)符合荧光定量PCR反应的要求。因此,利用常规引物建立基于SYBR Green染料的荧光定量PCR方法的过程较为繁琐且存在一定的难度。
本研究为避免由于常规引物特异性差等不足而造成检测假阳性的不利因素,引入了具有强特异性的DPO引物以建立检测PEDV的荧光定量RT-PCR方法。设计常规引物时,通常需要反复优化引物的特异性,避免引物二聚体和发卡结构,并保证上下游引物Tm值尽可能接近,与设计常规引物相比,DPO引物设计过程简单,不需要反复优化引物参数。不需要考虑特异性,DPO引物自身结构特点已经满足反应特异性要求,同时也不用考虑二聚体和发卡结构,所以,与设计常规引物相比,其设计过程显著简化。其5'-端和3'-端是两个独立的特异性区域,其5'-端与模板可以稳定结合,其3'-端负责靶基因的特异性延伸,两者间用poly I连接后,形成一个空泡结构,本身并不影响扩增反应,却显著增强了引物的特异性[12-16]。本研究根据DPO引物的设计原则,以PEDV的N基因为靶基因设计了检测PEDV的DPO引物对。由于DPO引物的特殊结构,与常规引物相比,DPO引物对退火温度不敏感,有效退火温度范围较宽,同时保持了对靶基因N基因高效一致的扩增效率,因而在建立方法时不需要对PCR退火温度进行优化,简化了操作。实践应用证明,本研究基于DPO引物和SYBR Green染料建立的检测PEDV的荧光定量RT-PCR方法,极大地提高检测准确性和灵敏性,显示了其较好的实用性。此外,从仔猪临床腹泻样品的检测情况来看,PEDV阳性检出率为14.34%,低于目前PEDV的流行水平,分析其原因虽然在引起仔猪病毒性腹泻的病例中,PEDV是主要致病因,而能够引起仔猪腹泻的致病因素还包括致腹泻性大肠杆菌、环境应激等。总之,本研究建立的方法具有特异性强、灵敏度高的优点,为PEDV的检测和流行病学调查提供了检测手段。
——一道江苏高考题的奥秘解读和拓展

