星点设计-效应面法优化叶黄素脂质体的处方及制备工艺
李传灵,石晓晴,黄月英,卞 俊*
(1.海军军医大学长海医院虹口分院药学科,上海 200434;2.江西中医药大学药学院药剂学教研室,南昌 330004)
1 仪器和试药
1.1 仪器 高效液相色谱仪(美国Waters公司);Nano-Zs90 粒径分析仪(英国马尔文仪器有限公司);80-1离心机(上海手术机械厂);R系列旋转蒸发仪(上海申生科技有限公司);JY92-2D细胞超声破碎机(宁波新芝生物科技股份有限公司);SK3300H超声波清洗机(上海科导超声仪器有限公司)。
1.2 试剂和药品 卵磷脂[磷脂酰胆碱(PC)≥98%,批号201608011]、胆固醇(批号D1605010,阿拉丁试剂有限公司);注射用大豆磷脂、口服大豆磷脂(PC≥85%,上海太伟药业有限公司);叶黄素(批号20170331,浙江海宁凤鸣叶绿素有限公司);吐温-80(批号101720160801,湖南尔康制药股份有限公司);乙腈(色谱纯,批号R141464,迪马科技有限公司);氯仿(分析纯,批号20170626,常熟市杨园化工有限公司);Sephadex G-50(批号170313,上海金穗生物科技有限公司);磷酸盐缓冲液、注射用水(海军军医大学长海医院虹口院区药学科自制)。
2 方法和结果
2.1 叶黄素脂质体的制备 通过预实验确定叶黄素脂质体的制备工艺为:精密称取处方量磷脂、胆固醇、叶黄素和少量的吐温-80,置于250 ml圆底烧瓶中,加入氯仿,于水浴中超声加速溶解。将圆底烧瓶置旋转蒸发仪中,抽真空,旋蒸除去氯仿,在圆底烧瓶上形成均匀薄膜,用磷酸盐缓冲液水化,将类脂膜洗脱并水合成脂质体初悬液,置于超声波细胞粉碎机中超声,再经过0.45、0.22 μm微孔滤膜各过滤3次,得到脂质体悬浮液,于4 ℃下保存。
2.2 脂质体中叶黄素分析方法的建立
2.2.1 色谱条件 DiamonsilC18色谱柱(250 mm×4.6 mm,5 μm);流动相:100%乙腈;检测波长:443 nm;流速:0.6 ml/min;柱温:25 ℃;进样量:20 μl。在该色谱条件下,叶黄素峰的理论塔板数≥10 000,分离度>1.5。
2.2.2 包封率的测定[9]包封率(EE)是指包封在脂质体内的药物量占投入总药量的百分比,是脂质体制剂处方筛选和建立质量标准的重要指标。用公式表示:EE(%)=wdrug/wtot×100%,其中wdrug表示包封在脂质体中的药物量,wtot表示脂质体混悬液中的药物总量。
2.2.3 凝胶微柱的制备 称取 Sephadex G-50约5 g,加入蒸馏水100 ml,于80 ℃溶胀3 h,室温过夜使完全溶胀。装填于5 ml注射器中待水自然流下,用pH为7.0的磷酸盐缓冲液洗脱2~3个柱床体积,饱和后的凝胶微柱约5 cm,将装好的微柱置于离心机,2×103×g离心3 min,使凝胶柱失水皱缩,备用。
在影片中,还有一场戏,是黄觉和汤唯饰演的男女主人公要逃亡,两人身处险境,像到了末日的感觉。剧组开着车,出去找这场戏的景。他们到了一个地方,看到一条铁路,沿着铁路往前走,在铁路旁边发现了一栋房子,觉得它就是合适的拍摄场地。火车经过时,这栋房子里面会很吵。毕赣最初的设想是,火车经过,屋子里的灯和其他很多道具会晃动起来,制造一种末日的感觉。但到了拍摄时,他跟主创交流后发现,之前设想的那些意象很难实现,也并没有他想象中的那样文学化。于是最后选择了一个道具,就是在桌上晃动的一个杯子,来表现那种末日感。
2.2.4 游离药物的分离 精密量取2.1项下的脂质体悬浮液 0.2 ml,上样于自制的凝胶微柱的顶端,平行操作3份,1.5×103×g离心1 min,收集离心液。加入pH值为7.0的磷酸盐缓冲液0.4 ml于凝胶微柱的顶端,1.5×103×g离心2 min,分别连续操作2次,合并3次收集的离心液,置于2 ml量瓶中,用甲醇破乳并定容,计算包封率。
2.2.5 粒径的测定 取经过凝胶微柱分离的叶黄素脂质体1 ml,置于纳米粒径分析仪中,测定叶黄素脂质体的粒径分布。
2.2.6 渗漏率的测定 将不同制备条件得到的叶黄素脂质体于4 ℃下储藏15 d,每隔一段时间取样,测定叶黄素脂质体的包封率,并计算渗漏率。脂质体渗漏率的计算公式为:渗漏率=(EE储存过程中/EE开始时)×100%。
2.3 处方和工艺筛选及星点设计-效应面法优化处方和工艺 采用单因素试验,固定其他的量不变,改变其中一种试验因素,按照2.1项下方法制备叶黄素脂质体,以叶黄素包封率(EE)和粒径(l)为指标,分别考察磷脂种类、磷脂与胆固醇质量比(膜材比)、吐温用量、叶黄素用量(载药量)、缓冲液pH、吐温-80加入顺序、旋蒸温度、超声功率对指标的影响,根据试验结果筛选对指标影响较大的因素,采用星点设计-效应面法优化处方和工艺。
2.3.1 单因素试验
2.3.1.1 磷脂种类 固定其他因素不变,只改变磷脂的种类,分别用卵磷脂、口服大豆磷脂和注射用大豆磷脂,按照2.1项下方法制备脂质体,考察其对包封率和粒径的影响。结果显示,包封率注射用大豆磷脂>卵磷脂>口服大豆磷脂,而粒径注射用大豆磷脂<口服大豆磷脂<卵磷脂,并且3种磷脂制备的脂质体在保存10 d后,卵磷脂脂质体产生了明显絮凝沉淀。注射用大豆磷脂制备的脂质体包封率和粒径优于口服大豆磷脂,因此选择注射用大豆磷脂制备脂质体。
2.3.1.2 膜材比 固定其他因素不变,只改变膜材比,设定磷脂与胆固醇质量比为5∶1、10∶1、15∶1、20∶1和25∶1,按照2.1项下方法制备脂质体,考察其对包封率和粒径的影响,结果见图1A。脂质体混悬液中总投药量不变,随着胆固醇含量的减少,脂质体包封率先增大后降低, 当磷脂与胆固醇的比例为 5∶1 时,圆底烧瓶上有部分叶黄素脂质体没有水化,此时包封率最低,为 16.87%,原因可能是因为胆固醇的浓度较高时,脂质体刚性太大,超出了膜负荷,所形成的磷脂双分子层不稳定,造成部分脂质体破裂。当磷脂浓度过高时,磷脂与药物易形成单独的磷脂复合物,从而使脂质体的包封率降低。由图1A可知,胆固醇和磷脂质量比在10∶1~20∶1范围内,脂质体的包封率较高,而且粒径较小,因此选择10∶1~20∶1范围继续考察。
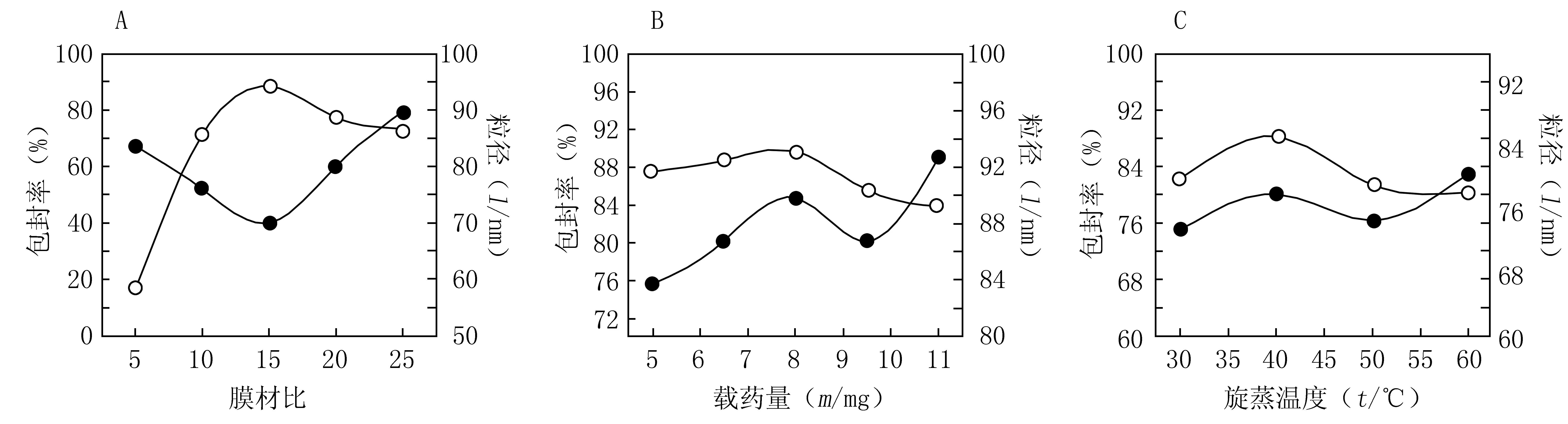
图1 粒径和包封率的单因素试验结果Figure 1 Results of single factor test on particle size and entrapment efficiencyA:膜材比考察结果;B:叶黄素用量考察结果;C:旋蒸温度考察结果;○:包封率;●:粒径
2.3.1.3 吐温-80用量 固定其他因素不变,只改变吐温-80的用量,分别用0.25%、0.5%、0.75%和1% 4种浓度的吐温-80,按照2.1项下方法制备脂质体,考察其对包封率和粒径的影响。结果表明,吐温-80在一定程度上可以提高叶黄素脂质体的包封率并减小粒径,吐温-80用量为0.75%时制备的脂质体粒径最小,包封率达到要求。过多的吐温-80会加速脂质体的聚集,从而降低其包封率并使粒径增大,因此吐温-80用量最佳为0.75%。
2.3.1.4 叶黄素用量 固定其他因素不变,只改变叶黄素用量(载药量),分别添加叶黄素原料药5、6.5、8、9.5、11 mg,按照2.1项下方法制备脂质体,考察其对包封率和粒径的影响,结果见图1B。在叶黄素加入量<8 mg时,其包封率和粒径都随载药量增加而增大,当其加入量>8 mg时,包封率随之降低,而粒径则先减小后增大,为保证增加包封率的同时减小粒径,选择叶黄素用量5~8 mg范围继续考察。
2.3.1.5 缓冲液pH值 固定其他因素不变,只改变缓冲液pH值,分别使用pH值为6.5、6.8、7.0、7.2和7.4的5种缓冲液,按照2.1项下方法制备脂质体,考察其对包封率和粒径的影响。结果表明,在缓冲液pH值为6.5~7.0时,包封率和粒径不存在最优值;pH值在7.0~7.4时,pH值主要影响脂质体的包封率,对粒径影响较小;当pH值为7.0时,其包封率最佳,并且粒径最小,因此选择缓冲液pH值为7.0。
2.3.1.6 旋蒸温度 固定其他因素不变,只改变旋蒸温度,按照2.1项下方法制备脂质体,分别考察30、40、50和60 ℃对包封率和粒径的影响,结果见图1C。在30~40 ℃,叶黄素脂质体的包封率和粒径随温度升高而增加;40~50 ℃时包封率和粒径随温度升高而减小,但包封率均在80%以上,粒径均<80 nm。50~60 ℃时包封率<80%,粒径>80 nm。在30~50 ℃旋蒸温度范围内包封率和粒径最佳,因此选择旋蒸温度为30~50 ℃继续考察。
2.3.2 星点设计-效应面法优化处方
2.3.2.1 实验设计 在单因素试验的基础上,选取叶黄素用量(X1)、膜材比(X2)和旋蒸温度(X3)3个对指标影响较大的因素,通过实验进一步优化。叶黄素用量(X1)取值范围为5~8 mg,膜材比(X2)取值范围为10∶1~20∶1,旋蒸温度取值范围(X3)为30~50 ℃。以包封率(Y1)、粒径(Y2)和渗漏率(Y3)为指标,采用星点设计-效应面法优化叶黄素脂质体制备工艺参数。采用 Design-Expert 8.0 软件进行 3 因素 3 水平的响应面分析实验,实验因素水平见表1,结果见表2。
2.3.2.2 模型拟合和效应面优化 采用 Design-Expert 8.0软件进行多元回归拟合分析,得到自变量对响应值影响的回归方程、三维效应面图和二维等高线图,见图2。

表1 星点设计-效应面法的因素水平表Table 1 The factors and levels of central composite design-response surface method
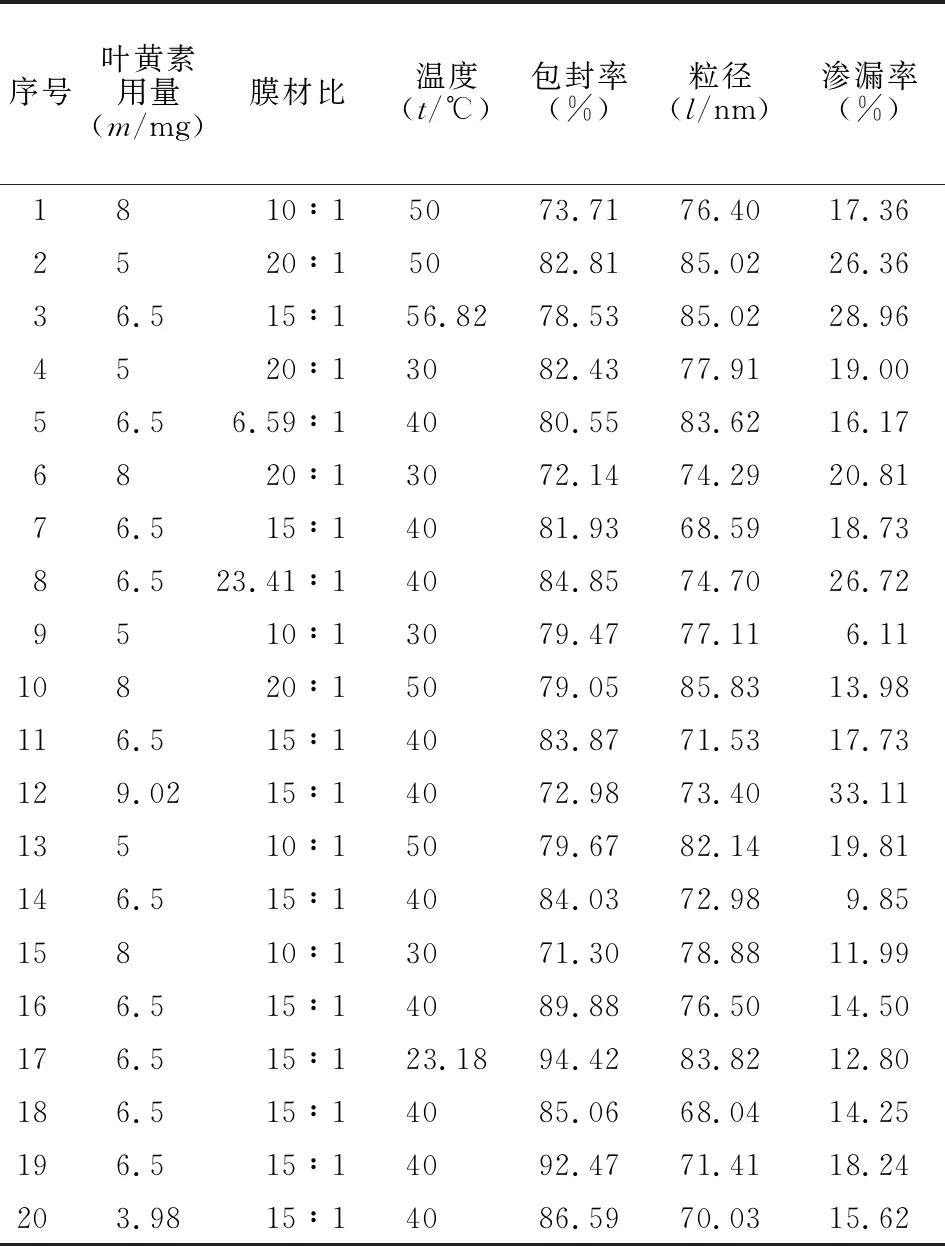
表2 星点设计-效应面法的结果Table 2 Results of central composite design-response surface method (n=3)
回归方程:Y1=86.38-3.74X1+1.43X2-1.23X3+0.01X1X2+1.09X1X3+0.59X2X3-3.37X12-2.34X22-1.01X32;Y2=71.48-0.081X1-0.47X2+1.70X3+0.15X1X2-0.38X1X3+2.01X2X3+0.25X12+2.88X22+4.74X32;Y3=-18.11+1.63X1+3.12X2+3.43X3。
结果表明,Y1、Y2的二项式拟合效果好,而Y3的线性拟合效果较好。从图2可见,膜材比、旋蒸温度和叶黄素用量对药物的包封率有显著影响,旋蒸温度和膜材比对粒径的影响较大,叶黄素用量对粒径影响不显著。
2.3.2.3 叶黄素脂质体最优处方及其制备工艺的确立 根据实验优化结果,筛选确定制备脂质体的最优处方:叶黄素用量为5.34 mg,膜材比为14.35∶1,旋蒸温度为32.9 ℃。最终优化制备工艺:先称取处方量的注射用大豆磷脂及胆固醇置于250 ml圆底烧瓶,再加入15 ml氯仿及少量吐温-80,超声溶解后,置于32.9 ℃恒温水浴旋转蒸发仪中除去有机溶剂,得到在瓶壁形成的均匀磷脂膜;放冷至室温后,加入20 ml 磷酸盐缓冲液,置40 ℃恒温水浴旋转蒸发仪中水化1 h,得到叶黄素脂质体初混悬液,将初混悬液置于超声破碎机中超声(功率400 W),再经过0.45、0.22 μm微孔滤膜各过滤3次,得到脂质体混悬液,于4 ℃下保存。
2.3.2.4 最优处方和验证 根据筛选出的最优化条件制备脂质体,重复3次,测定脂质体包封率、粒径和渗漏率,根据测量结果,验证最优处方和工艺,结果见表3。
由表3可见,包封率、粒径和渗漏率与星点设计-效应面法实验结果相近,3个指标的偏差均<10%,表明该方案重复性好,星点设计-响应面法筛选出的结果为最优方案。
表3 优选工艺验证结果
Table 3 Verification results of the optimal technology
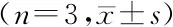

包封率(EE/%)粒径(l/nm)渗漏率(%)预测值88.51±0.3072.94±0.1016.07±0.20实际值87.49±0.3368.52±0.2114.54±0.50偏差(%)1.156.069.52
3 讨 论
3.1 分离方法 本研究中叶黄素为脂溶性药物,不溶于水,遇光热易分解。为了减小误差,应选择可以快速分离被包药物与游离药物的方法。因此,本研究共考察了有机溶剂萃取法[10]、微型柱离心法和超滤法[11]3种快速分离方法。结果超滤法不适合叶黄素药物的包封率测定,因为叶黄素的脂溶性强,未包封的药物在外水相的溶解度低,会以小晶体的形式存在,同样被超滤膜截流在上层,超滤液中的游离药物很少,造成包封率结果偏高,分离度只有14.81%左右。石油醚萃取法同样不适合叶黄素脂质体的分离,因叶黄素在石油醚中的溶解度很低,分离度只有89.61%左右,且石油醚具有强刺激性,不利于制备成制剂。利用葡聚糖凝胶微型柱测定脂质体包封率,不仅洗脱速度快,而且可以有效分离游离药物,分离度>98%,故本研究采用微型柱离心法。
3.2 制备方法 脂质体的制备方法有多种,其中薄膜分散-超声法所需设备、仪器条件和操作较为简单,且使用的主药和磷脂等辅料较少,费用较低,且叶黄素是脂溶性、弱碱性的结晶药物,因此本研究选择薄膜分散超声法作为制备方法。
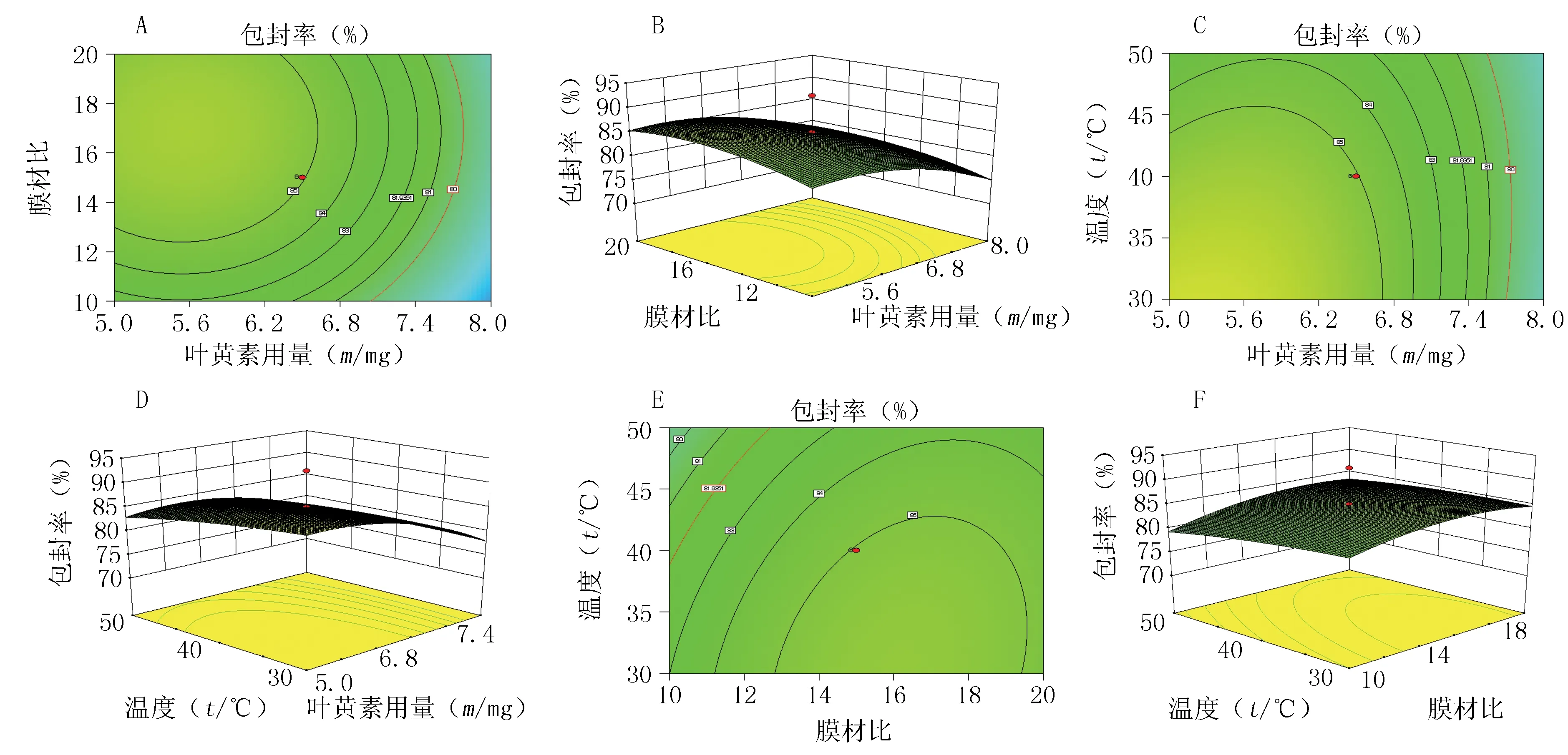
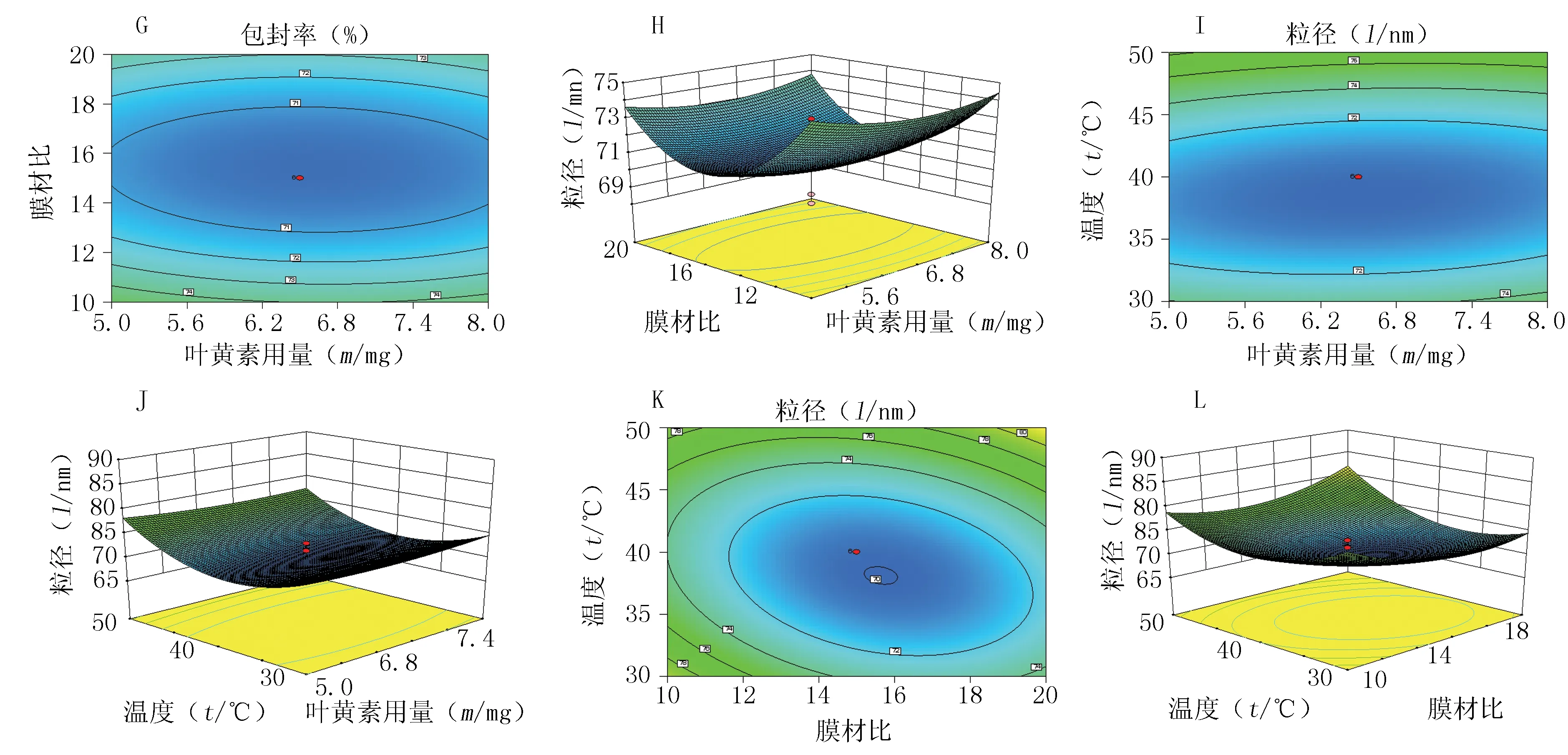

图2 各因素对包封率、粒径和渗漏率影响的等高线图及效应面图Figure 2 Contour lines and response surface graphs of each influential factors on entrapment efficiency,particle size and leakage rateA、B、C、D、E、F:包封率的等高线及响应面图;G、H、I、J、K、L:粒径的等高线及响应面图;M、N:渗漏率的等高线及响应面图
3.3 吐温-80加入顺序及超声功率 单因素试验中,考察了吐温-80加入顺序和超声功率对包封率和粒径的影响。结果表明吐温-80的加入顺序对包封率影响较小,但是水化时加入吐温-80比水化前加入更容易引起叶黄素脂质体聚集,而且叶黄素脂质体的粒径更大,因此选择在水化前加入吐温-80。在超声功率200~800 W范围内,400 W时包封率和粒径为最优值,因此选择超声功率400 W。

