维格列汀对大鼠非酒精性脂肪肝的影响
廖庆辉,郭中秋,赖康保,谭娅琴,陈玉华
(深圳市龙岗区人民医院内分泌代谢科,广东 深圳 518000)
随着生活方式转变,非酒精性脂肪肝(NAFLD)发病率明显升高,导致脂肪性肝炎、肝硬化和肝癌发病率升高,严重影响患者健康,给社会带来沉重负担。核因子κB(NF-κB)是炎症的中心环节,也是癌变过程中的关键调节蛋白。肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)是NF-κB信号通路下游的致炎因子,二者表达增加可促进肝脏炎性损伤,是导致脂肪性肝炎、肝硬化的重要机制之一。解偶联蛋白2(uncoupling protein 2,UCP2)基因是与肥胖相关的易感基因,与胰岛素抵抗、脂代谢紊乱、能量代谢及氧化应激密切相关,而这些因素均不同程度地参与了脂肪肝的形成[1-2]。维格列汀作为新型抗高血糖药物,具有改善肝内脂肪沉积的作用。本研究构建NAFLD模型大鼠,探讨维格列汀对NAFLD大鼠血清炎性因子、肝功能及肝组织UCP2表达的影响,报告如下。
1 材料与方法
1.1 主要实验材料
TRIzol(美国Gibio),反转录试剂盒、实时PCR试剂盒(大连TaKaRa),IL-6、TNF-α酶联免疫吸附测定(ELISA)检测试剂盒(武汉华美),DAB显色试剂盒(福建迈新),UCP2抗体(美国Abcam)。动物IVC饲养系统(苏杭仪器),病理切片机(德国Leica),酶标仪(瑞士Tecan),微量核酸仪(北京奥凯),7500型实时PCR仪(美国ABI)。SD大鼠24只,体质量(158.3±9.3)g,购自南方医科大学,实验动物许可证号:SCXK(粤)2016-0041。
1.2 实验分组及处理
SD大鼠24只,按随机数字表分成正常组、模型组和干预组,每组8只。模型组大鼠正常饮食,使用5% CCl4花生油溶液(0.3 mL/10 g)多点皮下注射,1次/5天,建立NAFLD大鼠模型。正常组大鼠正常饮食,皮下注射等量生理盐水,1次/5天。干预组大鼠正常饮食,在造模处理的同时,给予维格列汀50 mg(kg·d)灌胃。第8周断头处死各组大鼠,进行各项指标检测。
1.3 观察指标
1.3.1炎性因子检测 各组大鼠第8周断头取血分离血清,采用ELISA法检测血清IL-6、TNF-α水平。
1.3.2肝功能检测 断头取血分离血清,采用全自动生化分析仪检测血清丙氨酸转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)水平。
1.3.3病理学检查 第8周断头处死各组大鼠,逐层剪开大鼠腹腔皮肤黏膜,打开腹腔后迅速摘除肝左叶,4%甲醛固定、脱水、透明、浸蜡、包埋,4μm厚度连续切片,HE染色,光镜下观察大鼠肝组织病理变化。1.3.4UCP2 mRNA表达检测采用实时PCR检测各组大鼠肝组织UCP2 mRNA的表达。用TRIzol法常规提取肝组织总RNA,逆转录生成cDNA,荧光定量实时PCR检测UCP2 mRNA表达。引物序列:UCP2上游引物5′-CTCCCAATGTTGCCCGAAAT-3′,下游引物5′-GAGGTCGTCTGTCATGAGGT-3′;内参GAPDH上游引物5′-GATGCTGGTGCTGAGTATG CCG-3′,下游引物5′-GTGGTGCAGGATGCATTG CTCTGA-3′。PCR反应体系:SYBR Premix Ex Taq II(2×)10 μL,10 mol/L上下游引物各0.4μL,ROX Reference Dye II(50×)0.4 μL,DNA模板2 μL,加灭菌蒸馏水至总体积20 μL。将PCR管置于PCR仪中进行反应,反应步骤:95 ℃预变性30 s;然后95 ℃ 3 s、60 ℃ 30 s、72 ℃ 45 s,40个循环。由熔解曲线来判断引物特异性,若同一对引物的所有样品的熔解曲线均是单一峰且峰值一致则表示该引物特异性良好。绘制熔解曲线和扩增曲线,用2-ΔΔCt法计算目的基因的相对表达量。
1.3.5UCP2蛋白表达检测 采用免疫组化试剂盒检测各组大鼠肝组织UCP2蛋白表达,按试剂盒说明书进行操作。
1.4 统计学方法
2 结 果
2.1 炎性因子及肝功能检测
干预组大鼠血清IL-6、TNF-α水平较模型组均显著下降,差异有统计学意义(均P<0.05)。肝功能指标检测显示,干预组大鼠血清ALT、AST较模型组均显著下降,差异有统计学意义(均P<0.05)。见表1。
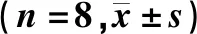
表1 3组大鼠血清炎性因子、肝功能指标检测
注:与模型组比较,*P<0.05
2.2 肝组织病理改变
HE染色观察各组大鼠肝组织病理改变,正常组肝小叶结构清晰完整,肝细胞未见明显脂肪变性,细胞核清晰可见;模型组肝细胞肿胀,胞质疏散,含脂肪粒,肝细胞核固缩;干预组肝细胞趋于正常,脂肪粒变小。见图1。
注:A:正常组;B:模型组;C:干预组
图1 第8周3组大鼠肝组织病理改变(HE染色 ×400)
2.3 UCP2 mRNA表达检测
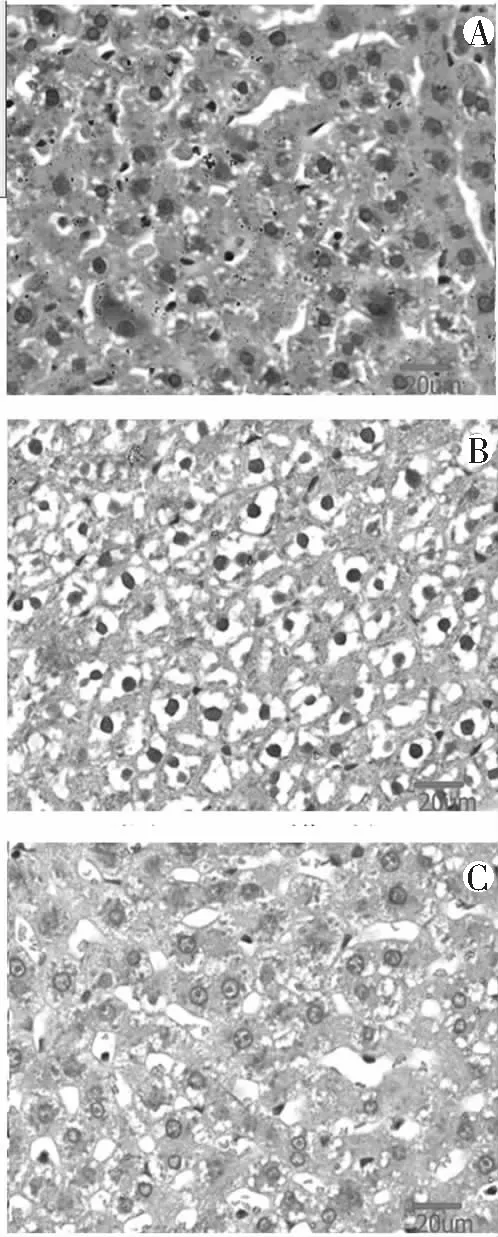
实时PCR检测大鼠肝组织UCP2 mRNA表达显示,模型组UCP2 mRNA表达明显高于正常组和干预组,差异均有统计学意义(均P<0.05)。见图2。
2.4 UCP2蛋白表达检测
免疫组化显示,模型组肝组织UCP2蛋白表达明显高于正常组和干预组。见图3。
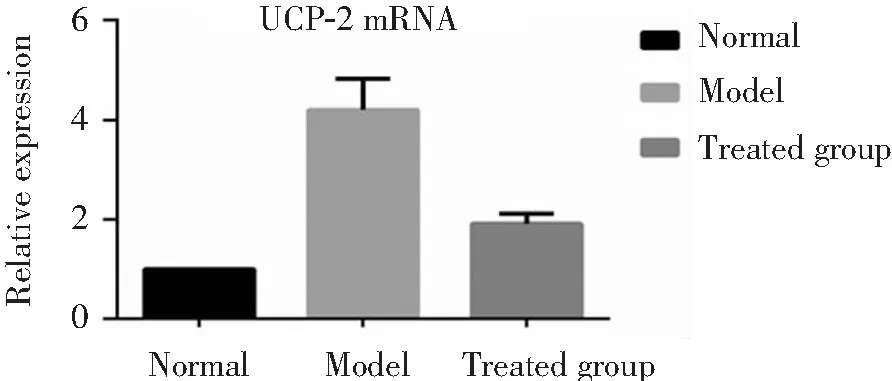
图2 3组大鼠肝组织UCP2 mRNA表达检测(荧光定量PCR)
注:A:正常组;B:模型组;C:干预组
图3 3组大鼠肝组织UCP2蛋白表达(免疫组化×400)
3 讨 论
UCP2是位于线粒体内膜上的一类载体蛋白,对机体能量平衡涉及的体质量、肥胖等具有明显影响,在调节能量代谢和线粒体功能方面发挥重要的作用[3-4]。Beck等[5]研究发现脂肪变的肝脏中UCP2表达量增加。肝内UCP2对肝脏的能量代谢极为重要,NAFLD肝脏组织UCP2表达增加,通过其质子漏作用,一方面减少ATP合成,增加肝细胞对损伤因子的灵敏度,使肝细胞更容易受到打击;另一方面可减少活性氧的生成,对肝脏起保护作用。
维格列汀是一种具有选择性、竞争性的可逆二肽基肽酶4(DPP-4)抑制剂。葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样多肽1(GLP-1)是维持体内葡萄糖浓度的重要激素,都具有肠促胰岛素作用。2型糖尿病患者GIP的促胰岛素分泌作用受损,仅有GLP-1能发挥促胰岛激素分泌作用,它通过作用于胰岛β细胞膜上的受体,促进胰岛素分泌;GLP-1还可抑制胰高血糖素的分泌以及抑制胃排空从而增加饱足感,抑制食欲。通过与DPP-4结合形成DPP-4复合物可抑制该酶的活性,在提高
GLP-1浓度、促使胰岛β细胞产生胰岛素的同时,降低胰高血糖素浓度,从而降低血糖。维格列汀除了有降糖作用外,还能够降低NAFLD肝细胞UCP2的表达,降低血清IL-6、TNF-α等炎性因子水平,改善肝功能[6]。本研究发现模型组大鼠肝组织UCP2表达较干预组明显升高,与上述研究结果一致,也证实了UCP2在肝脏能量代谢中起重要作用。
综上述,维格列汀可抑制NAFLD大鼠肝组织UCP2的表达,降低血清IL-6、TNF-α炎性因子水平,促进肝功能恢复,为NAFLD的防治提供了新的依据。

