超声裂解法在诊断假体周围感染的应用
李程,Nora Renz,Andrej Trampuz
(Charité-Universitätsmedizin Berlin,Center for Musculoskeletal Surgery,Berlin,Germany 14059)
人工关节置换术是一种有效、常用的骨科手术技术,能够改善关节功能,提高患者的生活质量。假体周围感染是人工关节置换术后最严重的并发症。虽然发生率很低,在膝、肩关节置换术后的发生率<1%,髋关节置换术后发生率<2%[1],但是一旦发生感染给患者带来巨大的痛苦和经济负担。一份来自发展中国家的报告显示[2],假体周围感染患者的治疗费用可以比普通住院患者费用高24倍。早期明确诊断感染,对后续的手术治疗起着关键的作用[1]。超声裂解作为一种术中诊断假体周围感染的方法有着较高的准确性。尤其是对于样本采集前接受抗生素治疗的患者。1998年,Tunney等[3]首次报道了超声裂解在髋关节假体周围感染诊断中的应用,但由于受到操作方法等影响,并没有体现出这种培养方法的价值。2007年,Trampuz等[4]对此方法进行改进,结果显示无论患者是否术前接受抗生素治疗,超声裂解液的敏感度均优于术中假体周围组织培养获得的结果。由于超声裂解法操作简单,而且有着较好的敏感度,这种方法逐渐应用于假体周围感染的诊断。近年来,除了传统的培养基培养之外,还出现了一些能提高诊断准确性的新方法,如血培养瓶培养、分子生物学技术、微量热法等[5-8]。我们对超声裂解法的操作步骤以及一些新的培养方法进行分析,为临床应用提供有价值的参考。
1 假体周围感染的诊断方法
目前,有关假体周围感染的诊断标准还缺乏共识。肌肉骨骼感染协会(musculoskeletal infection society,MSIS)、美国感染协会(infectious diseases society of America,IDSA)、欧洲骨与关节感染协会(European bone and joint infection society,EBJIS)相继提出了一些协助诊断假体周围感染的指南[9-11]。在欧洲,常用的诊断假体周围感染的指南为EBJIS提出的方法。根据EBJIS的诊断方法,如果满足以下≥1项标准时,可诊断为假体周围感染:a)临床表现:窦道或瘘管形成,假体周围可见脓液(注:关节假体金属对金属界面可出现类似脓液的表现,但是白细胞计数正常,所见到的为金属碎屑)。b)组织学:每10个高倍视野下,发现≥23个粒细胞,Krenn和Morawietz分型之后的2或3型,相当于假体周围感染。c)关节腔穿刺细胞计数:白细胞>2 000/μL或中性粒细胞>70%。(在术后6周内、类风湿性关节病、假体周围骨折或脱位的患者可出现白细胞升高而非感染。所获得的穿刺液标本需要在24 h内通过显微镜或细胞计数器,检测出白细胞数目)。d)微生物学:关节腔穿刺液培养阳性,或至少有2份组织样本培养出同一种细菌(对于金黄色葡萄球菌、链球菌、大肠杆菌等具有高度传染性的微生物,或患者正在接受抗生素治疗,只要一个组织样本被检测出阳性,即可诊断为假体周围感染),或超声裂解液≥ 50 CFU/mL(当细菌为金黄色葡萄球菌或者厌氧菌,并且正在使用抗生素时,即使<50 CFU/mL也可认为是阳性结果)。有研究发现[12],使用EBJIS指南诊断假体周围感染时,能够比MSIS、IDSA指南发现更多假体周围感染的病例。
2 假体超声裂解
目前,超声裂解法的操作方法还没有统一的标准,多数研究把Trampuz[4]使用的方法作为标准。首先,在手术中取出怀疑感染的假体关节,将假体关节放入合适的容器内。然后加入超声裂解处理液进行漩涡振荡30 s,振荡后放入超声清洗器中清洗5 min。清洗后再次漩涡振荡30 s,最后将获取的超声裂解液移入培养基中进行细菌培养(见图1)。
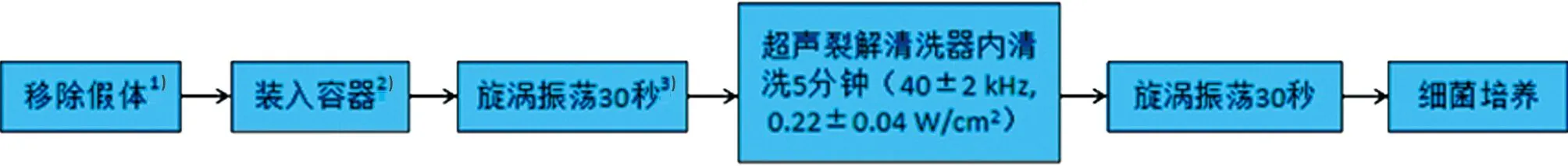
注: 1-避免污染,最好使用合适的无菌手术器械把假体装入容器;2-必须选用无菌、结实、密封性好、大小合适的容器;3-振荡可选用手动或置于漩涡振荡器上
通过阅读文献,我们发现部分超声裂解法的操作步骤为超声裂解后离心[13]或超声裂解结合漩涡振荡[14-16]。然而,加入漩涡振荡或者离心是否对培养结果造成影响。Zitron等[17]对35例骨科翻修手术中移除的假体采用两组培养方法进行对比研究。一组为振荡、超声裂解加离心,另一组为振荡、超声裂解加膜滤法。结果显示离心组的敏感度明显高于膜滤组(78.8% vs 30.3%;P<0.001)。离心法可能会提高培养结果的敏感度。
Portillo等[18]为了发现振荡在诊断假体周围感染时是否有效,对135例关节翻修手术中移除的假体分为振荡结合超声裂解、振荡法两组进行对比研究。结果显示有35例患者被诊断为假体周围感染(急性14例,慢性21例)。当cutoff≥1 CFU/mL时,振荡结合超声裂解的敏感度为71%[95% CI(54%~85%)]、特异度为93%[95% CI(86%~97%)]。振荡法的敏感度为69%[95% CI(51%~83%)]、特异度为92%[95% CI(85%~96%)]。当cutoff≥50 CFU/mL时,振荡结合超声裂解的敏感度为60%[95% CI(42%~76%)]、特异度为99%[95% CI(95%~100%)]。振荡法的敏感度为40%[95% CI(24%~58%)]、特异度为99%[95% CI(95%~100%)]。在接受抗生素治疗与没有接受抗生素治疗的分组中,不同cutoff以及急、慢性感染显示出不同的结果(见图2)。当cutoff≥1 CFU/mL(没有接受抗生素治疗的病例)或cutoff≥50 CFU/mL(接受抗生素的急性感染病例)时,振荡结合超声裂解与单纯振荡有相同的敏感度。除此之外,振荡结合超声裂解的敏感度均优于振荡法。虽然振荡结合超声裂解的方法优于单纯振荡,但是以≥1 CFU/mL为标准,对于没有接受抗生素治疗的患者,也许是一种可行的培养方法。特别是对于一些没有超声清洗器的医院,把移除的假体放入无菌、密封的塑料容器内,加入超声裂解处理液。然后可进行手动振荡或置于漩涡振荡器上。最后,对获取的液体进行培养基培养。
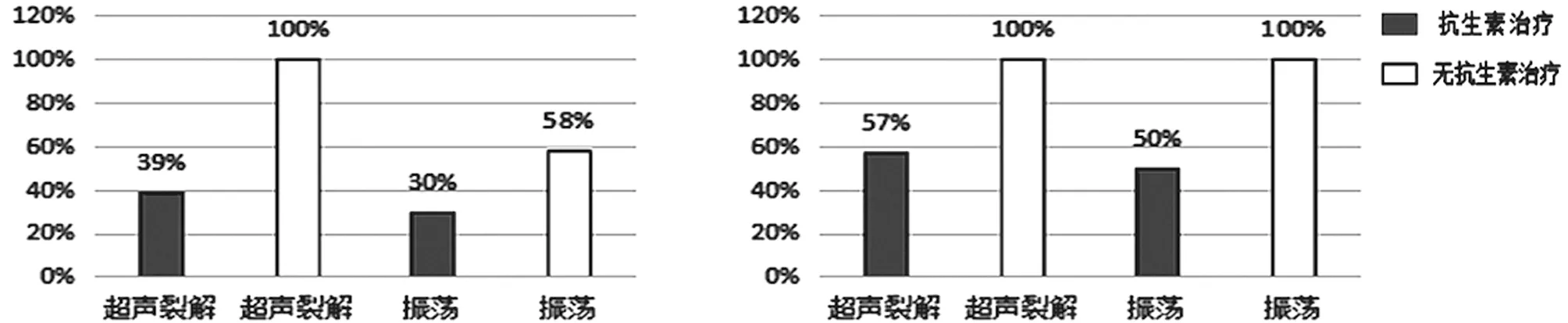
a cutoff≥ 50 CFU/mL时的敏感度 b cutoff≥1 CFU/mL时的敏感度
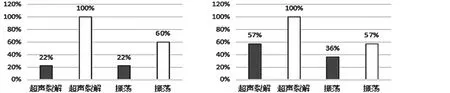
c cutoff≥50 CFU/mL时急性感染的敏感度 d cutoff≥50 CFU/mL时慢性感染的敏感度
图2 接受抗生素治疗对振荡加超声裂解、振荡法的敏感度的影响
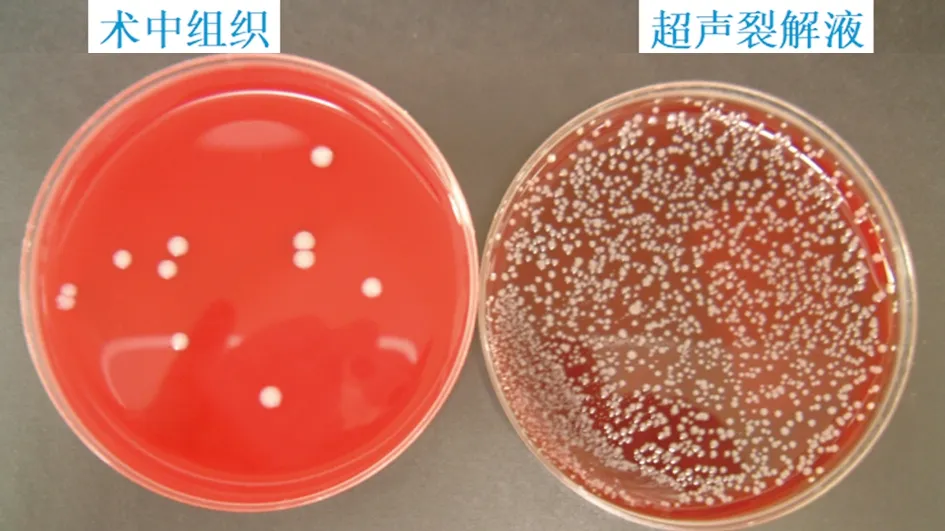
图3 术中组织、超声裂解液培养出的表皮葡萄球菌,超声裂解液检测到比假体周围组织多10 000倍的微生物
3 超声裂解液的培养方法
组织培养和超声裂解法是术中诊断假体周围感染常用的两种方法,在诊断体周围感染时,超声裂解通常比组织培养法检测出更多的微生物[19](见图3)。
有研究发现,超声裂解法的敏感度优于术中组织培养。超声裂解法与术中组织培养在髋、膝关节感染的敏感度分别为92.6%、66.7%;肩关节感染的敏感度分别为66.7%、54.5%;肘关节感染的敏感度分别为89%、55%[20-22]。Prieto-Borja等[23]发现虽然超声裂解液的总体敏感度和特异度优于组织培养、关节腔穿刺液培养。但是对于早期感染(术后3个月内),超声裂解法较传统培养方法,并没有表现出明显优势。在延迟感染(术后3~24个月)的病例中,术中组织与关节腔穿刺液培养的基础上结合超声裂解培养,诊断的敏感度提升了26.6%。由于传统的培养方法有一定的局限性,检测病原菌的敏感度并不高,大约39%~70%之间[24]。虽然超声裂解液在普通培养基培养时有较好的敏感度和特异度(见表2)。但为了进一步提高诊断准确性,近年一些与超声裂解液相组合的方法,开始逐渐用于临床诊断假体周围感染。
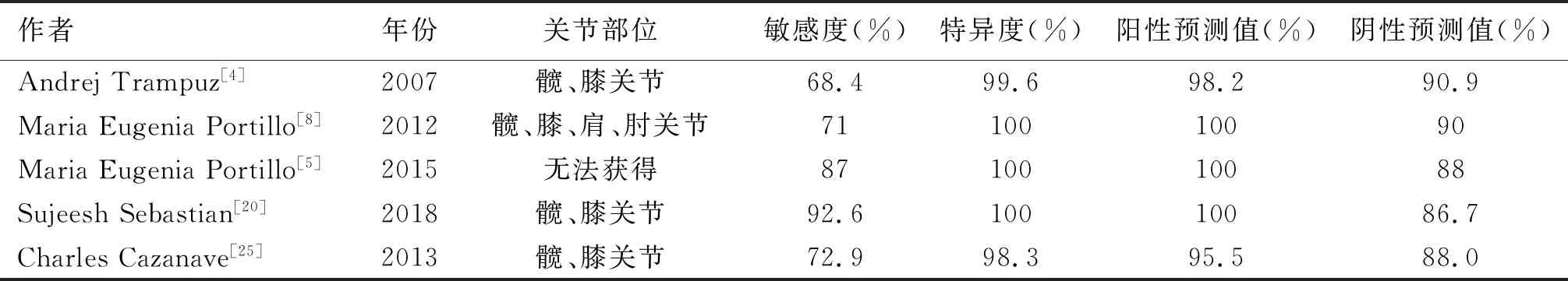
表2 超声裂解液在普通培养基中的敏感度和特异度比较
3.1 血培养瓶法 把样本接种在血培养瓶中进行培养的方法,早期应用于关节腔穿刺液培养[26]。然而目前有关超声裂解液接种到血培养瓶的研究较少。Shen等[27]对110例怀疑感染的病例的超声裂解液、关节腔穿刺液分别接种到血培养瓶中进行对比,超声裂解液诊断假体周围感染的敏感度为88%[95% CI(76%~95%)]、特异度为87%[95% CI(75%~94%)]。关节腔穿刺液的敏感度为64%[95% CI(49%~77%)]、特异度为98%[95% CI(91%~100%)]。超声裂解液的敏感度比关节腔穿刺液高,但是特异度低于关节腔穿刺液。在接受抗生素治疗的病例中,超声裂解液培养结果优于关节腔穿刺液(17例对比11例)。Portillo等[5]对75例怀疑感染的骨科内植物分别进行超声裂解液培养基培养与血培养瓶培养。在39例感染中,多数患者在标本采集前14d内接受了抗生素治疗,然而结果显示血培养瓶培养比传统的培养基培养表现出更高的敏感度(100%对比87%)。Janz等人[28]发现超声裂解液血培养瓶培养不仅能够比传统培养方式检测出更多阳性的结果(101例对比51例)、培养时间更短(2.9 d对比4.2 d)。而且这种在全自动血培养仪培养的方式,减少实验人员60.1%的平均工作时间[29]。为了提高诊断的准确性,减少假阳性的发生。在超声裂解液接种到血培养瓶的过程中,注意避免污染。
3.2 分子生物学技术 随着分子生物学技术的发展,PCR和多重PCR逐渐被用于假体周围感染的诊断。这种方法的优势在于培养时间短(<5 h)、自动化、不易受抗生素影响、敏感度和特异度较高、易于区分无菌性松动和假体周围感染等[8,30]。与传统超声裂解法相比,超声裂解液PCR的敏感度更高(77.1%对比72.9%)[25]。Liu等[6]对超声裂解液PCR在假体周围感染中的诊断进行meta分析,通过筛选共纳入9篇文献,其敏感度为75%[95% CI(71%~79%)],特异度为96%[95% CI(94%~97%)]。该研究发现新鲜标本的敏感度优于冰冻保存标本(82%对比70%),多重PCR比PCR有更高的特异度(98%对比94%)。这种方法由于花费高,并没有在临床普遍应用。
3.3 微量热法 微量热法是利用微生物生长和代谢时产生的热效应快速检测到细菌,这种方法由于敏感度高、方便准确,常被用于生物工程技术、药理学等方面。在临床上常用于筛查输血袋是否有细菌生长[31]。2013年Borens等[7]首次发表了微热量法诊断骨科内植物感染的临床研究,结果显示超声裂解液微热量法的敏感度为100%、特异度为97%。这种方法能够在24h内完成细菌培养。目前微热量法在假体周围感染的应用较少,还需要更多的临床研究来验证其诊断价值。
4 超声裂解法的机制
在所有人类感染中,有超过65%的感染与生物膜相关。由于骨科内植物假体材料的易感性,所以很容易引起生物膜相关感染。生物膜是复杂的微生物群落以嵌入胞外多糖的形式附着于假体表面。生物膜在假体表面形成可以分为四步:黏附、增殖、生物膜成熟和扩散。其中微生物黏附于假体表面是生物膜形成的第一步,也是最重要的一步[32],微生物可通过三种途径黏附于假体表面后发生感染[33]:a)手术期间通过手术切口传播;b)尿路感染或皮肤感染等通过血源性或淋巴源性传播。只要假体(异物)存在,就可发生于关节置换术后的任何时期;c)通过相邻组织传播(感染的软组织、骨髓炎等)。超声裂解在低频率、低强度的作用下,通过破坏和分离假体表面的生物膜(不影响微生物活性),从而发现更多的微生物[34]。
目前,假体周围感染的诊断仍面临着严峻挑战。虽然超声裂解法表现出较高的敏感度和特异度。但是,即使超声裂解法培养出阳性结果,也要警惕可能是污染造成的假阳性。建议在诊断假体周围感染时,采用多种培养方法相结合进行综合评估。在医院或实验室条件允许的情况下,使用血培养瓶法、分子生物学技术、微热量法等能够提高诊断的准确性。

