弗氏柠檬酸杆菌的筛选、鉴定及对分散蓝2BLN脱色性能
芦银香,范晓丹,胡宗玉,吴 静
(天津城建大学a.环境与市政工程学院;b.天津市水质科学与技术重点实验室,天津300384)
我国是染料生产大国,且居于世界首位[1].据统计合成染料在生产和使用过程中大约有10%~20%染料释放到水中,且每排放1 t 染料废水,就会污染20 t 水体[2].根据染料所含的共轭体系结构可分为偶氮染料、蒽醌染料及三苯甲烷类染料等,其中蒽醌染料是仅次于偶氮染料的第二大类染料[3-4].蒽醌类染料分子结构中含蒽醌基,它具有色泽鲜艳、耐光度好及稳定性好等优点[5-6].蒽醌染料因色度大影响日光照射,不利于水生生物和植物的生长[7-8];某些蒽醌染料能够致癌、致畸、致突变[9];因此,有效去除水体中蒽醌类染料是十分有必要的.
目前,国内外针对印染废水的处理方法可以分为物理法、化学法以及生物处理法.但物理、化学法因成本高、操作复杂及易产生二次污染等缺点,很大程度上限制了其发展[10].从污水处理厂的经济效益、生态适应性和广泛的适应性的角度而言,生物处理法具有显著的优势[11].处理染料废水的生物包括细菌、真菌及藻类,细菌的处理效果优于真菌和藻类[12-13],越来越多的细菌被用于处理染料废水[14-17].这些报道主要是关于偶氮染料废水的处理,对于蒽醌染料废水的研究相对少一些[18-20].
本研究从天津市某污水处理厂二沉池污泥中分离筛选出一株对蒽醌分散蓝2BLN 具有较强脱色能力的菌株,经16SrDNA 基因序列分析,鉴定为弗氏柠檬酸杆菌.探讨影响菌种的生理学特征,获得最适生长条件并研究其对蒽醌分散蓝2BLN 的脱色性能.
1 材料与方法
1.1 材料及试剂
污泥取自天津市某污水处理厂二沉池.模拟染料废水的组成(g/L):C6H6O61、(NH4)2S040.1、KH2PO40.03、MgSO40.2、CaCl20.01、FeCl30.01、NaCl 1 及染料(蒽醌分散蓝2BLN).
富集培养基(g/L):蛋白胨10,酵母浸膏5,氯化钠10,pH=7.0~7.2.
LB 固体培养基(g/L):蛋白胨10,酵母浸膏5,氯化钠10,琼脂粉20,pH=7.0~7.2.
分散蓝2BLN、葡萄糖、蛋白胨、酵母浸膏、氯化钠、硫酸铵、磷酸氢二钾、三氯化铁、重铬酸钾,硫酸亚铁铵,上述药品均为分析纯.
1.2 仪器及设备
电子天平(FA2004N 型,上海菁海仪器有限公司);全温振荡培养箱(ZWYR-200D 型,上海智城分析仪器制造有限公司);紫外可见分光光度计(T6 新世纪型,北京普析通用仪器有限公司);微波消解装置(WMX-Ⅲ-B 型,韶关市明天环保仪器有限公司);高压灭菌锅(上海申安医疗器械厂);超净工作台(SWCJ-1F 型,苏州净化设备有限公司).
1.3 菌种的驯化、分离、纯化、筛选
将配制好的废水和污泥放置锥形瓶内,置于温度为30 ℃、转速为150 r·min-1的振荡箱内进行培养.首次加入染料废水浓度为5 mg·L-1,采用梯度驯化,直到各个浓度的色度及COD 去除效果趋于稳定,驯化完成.用梯度稀释、涂布平板的方法对驯化后的活性污泥中菌种反复分离纯化,得到两株细菌,命名为H1 和H2,通过比较它们的脱色率及COD 去除率,筛选出一株优势菌种.
1.4 高效脱色菌种的鉴定
对高效菌种(H2)的16SrDNA 的扩增片段进行测序与分析(委托生工生物工程(上海)股份有限公司进行):使用细菌基因组DNA 小量纯化试剂盒提取基因组DNA.细菌16SrDNA 基因的引物序列为引物27F:5’-AGAGTTTGATCATGGCTCAG-3’;引物1492R:5’-TACGGCTACCTTGTACGACTT-3’.反应体系包括反应缓冲液15 μL,Taq 酶1 μL,DNTP10 μL,模板DNA1 μL,27 引物1 μL,1492R 引物1 μL,最后用去离子水补充至50 μL.PCR 反应条件为96 ℃预变性3 min;96 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共35 个循环;72 ℃最后延伸10 min.PCR 扩增产物用1%琼脂糖凝胶电泳检测.将获得的16SrDNA 序列通过BLAST 程序与GenBank 中核酸数据进行比对分析,选取12 株序列相似性高的标准菌株,用Neighbor Joining(NJ)建树方法构建系统发育树.
1.5 菌种生理学特征
用△OD600表征菌种净生长量.将培养好的种子液按10%(v/v)的接种量接种模拟染料废水中(染料浓度为40 mg·L-1),在摇床转速为150 r·min-1下,研究不同温度(20,25,30,35,40 ℃)对菌种生长的影响;在最适温度下,研究转速(0,50,100,150,200 r·min-1)对菌种生长的影响;在最适温度、转速下,研究接种量(1%,5%,10%,15%,20%)对菌种生长的影响;在最适接种量、温度、转速下,研究不同pH(2,4,6,7,8,10,11)对菌种生长的影响;每隔1.5 h 取样测OD600.
1.6 脱色率和COD 去除率
将处理前后的水样在转速为10 000 rpm/min 下离心10 min,取上清液,在最大波长625 nm 处测出吸光度.根据废水降解前、后吸光度的变化计算出脱色率.脱色率计算公式如下式
式中:A0为进水吸光度值;At为t 时刻出水吸光度值.
采用重铬酸钾法测定COD,COD 去除率计算公式为

式中:COD0为进水COD 值,CODt为t 时刻出水COD 值.
1.7 紫外-可见光谱分析
将处理前后的水样在转速为10 000 rpm/min 下离心10 min,取上清液稀释5 倍于300~700 nm 处进行紫外-可见波谱分析.
2 结果与分析
2.1 高效菌种筛选
菌株H1、H2 对蒽醌分散蓝(40 mg·L-1)随时间变化的脱色率及COD 去除率如图1 所示:8 d 后,H1、H2的脱色率分别为65.4%、79.14%;H1、H2 的COD 去除率分别57.97%、86.08%;H2 的脱色率及COD 去除率均高于H1.因此,本实验选择H2 为目标菌株.

图1 H1 和H2 的脱色率及COD 去除率
2.2 H2 的鉴定
纯化后的H2 菌株在LB 固体培养基上30 ℃培养48 h 后,形成直径为2~4 mm 的单菌落.H2 菌株的菌落(见图2a)特征为圆形、表面有光泽、乳白色、不透明、易挑起,该菌为革兰氏阴性菌,杆状;16SrDNA 序列通过BLAST 程序与GenBank 中核酸数据进行比对分析,选取12 株序列相似性高的标准菌株,用Neighbor Joining(NJ)建树方法构建系统发育树(见图2b);生工生物工程(上海)股份有限公司给出的菌株鉴定结果报告(见图2c);综上所述,H2 鉴定为弗氏柠檬酸杆菌.

图2 菌株鉴定结果
2.3 弗氏柠檬酸杆菌(H2)生理学特征
2.3.1 生长温度范围及最适值
温度对弗氏柠檬酸杆菌影响结果如图3a 所示.由图可知,在20 ℃和25 ℃时,该菌株基本上不能生长,这是因为低温抑制了酶的活性;在30 ℃到40 ℃,菌种均能较好的生长,但△OD600从0.647 4 降至0.432 4,这是因为随着温度的升高,虽然酶促反应加快,但酶活性丧失也加速;温度变化既可以引起菌体细胞壁表面发生物理变化,也可影响分泌酶系的活性和稳定性[21].因此,温度对弗氏柠檬酸杆菌生长影响较大,且最适生长温度为30 ℃.
2.3.2 生长转速范围及最适値
通过改变培养箱的转速来调节锥形瓶内的含氧量.转速对弗氏柠檬酸杆菌影响结果如图3b 所示.由图可知,随着转速(0 r·min-1~200 r·min-1)的增大,该菌株生长趋势呈现先增大后减小的趋势.当转速为0~150 r·min-1时,随着转速的增大,菌体生长的越好,这是因为较高转速可为其提供足够氧气去维持该菌株的新陈代谢,说明该细菌是兼性好氧菌;但转速为200 r·min-1时,该菌体生长趋势反而有所下降,这是因为高转速影响其机械强度,进一步影响了该菌体的生长.因此,弗氏柠檬酸杆菌最适转速为150 r·min-1.
2.3.3 生长接种量范围及最适値
接种量对弗氏柠檬酸杆菌影响结果如图3c 所示:由图可知,当接种量为15%时,该菌株净生长量最大,且9 h 时△OD600 为0.585 8;在前3 h,接种量越大(1%~20%),菌株生长越快,但之后20%生长趋势不如15%.这是因为一开始接种量为20%的反应器内,微生物数量最多,繁殖最快,随着时间越来越长,营养物质不断被消耗,微生物进入了稳定期和衰老期.因此,弗氏柠檬酸杆菌最适接种量为15%.
2.3.4 生长pH 范围及最适値
pH 对弗氏柠檬酸杆菌影响结果如图3d 所示:由图可知,在pH = 2 时,该菌株基本上不能生长,这说明该菌株不能在强酸环境生长;在当pH = 4~7 时,随着pH 增大,该菌株△OD600越大,这说明该菌株能在弱酸环境下生长,且在中性环境下生长的最好;当pH = 8~11 时,△OD600越来越小,这说明该菌株能在弱碱性下生长,但强碱抑制其生长,且pH=11时,基本上不能生长.综上所述,过酸或过碱均会引起微生物细胞表面特性与酶构象的变化,进而影响微生物的生长和代谢[22].因此,弗氏柠檬酸杆菌最适pH=7.
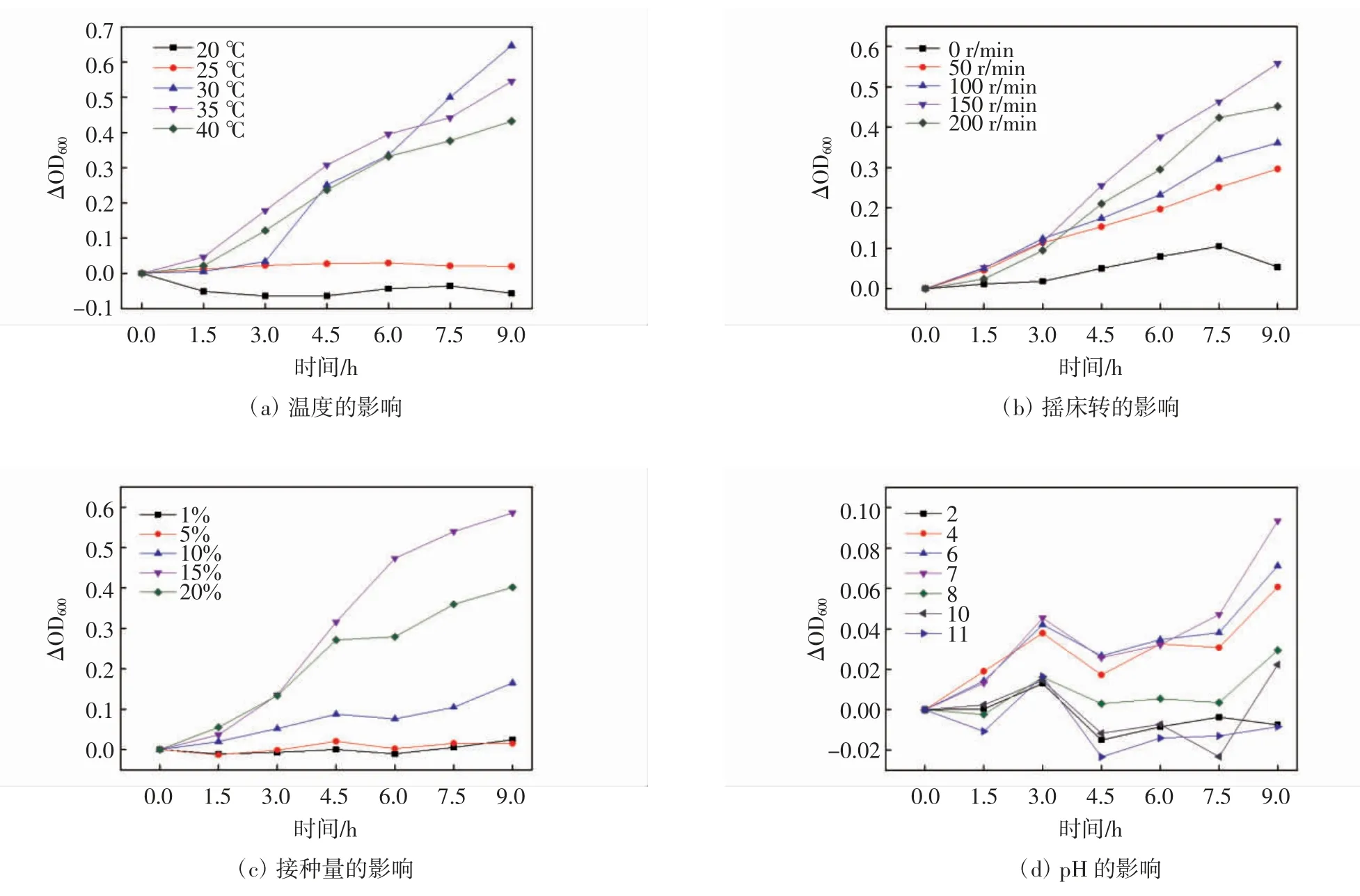
图3 菌株最适生长条件
2.4 紫外-可见波谱分析
反应前后的水样紫外-可见波谱分析结果如图4所示.在最适生长条件下,反应8 d 后分散蓝2BLN 在波长584 nm 和620 nm 处的特征吸收峰逐渐减弱,最终基本消失,这与反应液的颜色由蓝色渐变为无色相一致,且此时脱色率为86.10%.由此推断分散蓝2BLN的蒽醌环结构被破坏,发色基团发生明显变化.当细菌以生物吸附的方式进行脱色时,所有吸收峰的吸光值将出现等比例的下降;当以生物降解的方式进行脱色时,上清液在可见光区的吸收峰将完全消失,或者出现新的吸收峰[23].因此,弗氏柠檬酸杆菌对蒽醌分散蓝2BLN 的脱色是通过生物降解的方式来实现的.
3 结 论

图4 紫外-可见波谱分析
(1)从一般的市政活性污泥中分离到一株具有高效脱色分散蓝2BLN 的菌株.经16SrDNA 鉴定,该菌株为弗氏柠檬酸杆菌,属于枸橼酸杆菌属.
(2)弗氏柠檬酸杆菌最适生条件:温度为30 ℃,培养箱振荡频率为150 r·min-1,pH=7.8 d 后,分散蓝2BLN(40 mg·L-1)脱色率达86.10%.
(3)弗氏柠檬酸杆菌对蒽醌分散蓝2BLN 的脱色是通过生物降解的方式且分散蓝2BLN 的蒽醌环被破坏.
(4)综上所述弗氏柠檬酸杆菌是一株高效蒽醌染脱色菌,具有处理蒽醌染料废水的开发潜能.

