系统性硬化症患者外周血中miR-155的表达与Th17细胞的关系
周 燕 张媛媛
(重庆市第四人民医院检验科,重庆400014)
系统性硬化症(Systemic sclerosis)是一种慢性自身免疫疾病,目前临床主要以控制患者症状、延缓对靶器官的损伤等治疗为主,以往研究主要从遗传与环境因素、免疫学异常、血管病变等方面探索其具体的发病机制[1]。Th17细胞是T效应淋巴细胞亚群的T辅助细胞之一,其分泌的细胞因子可在自身免疫及纤维化疾病中发挥重要作用[2]。miR-155是一种多功能性miRNA,可通过下调靶基因CTLA-4表达进而参与造血、免疫等多种病理生理过程,同时可在多种恶性肿瘤、类风湿等疾病中发挥重要作用[3]。miR-155在系统性硬化症中尚未见研究报道,因此本研究探讨了系统性硬化症患者外周血中miR-155表达及其与Th17细胞的关系,旨在为临床治疗提供一定理论依据。
1 材料与方法
1.1 材料
1.1.1 一般资料 选取2015年6月至2017年3月于我院风湿免疫科住院及门诊治疗的系统性硬化症患者58例为研究组,另选取本院同期健康体检者61例作为对照组。研究组中男10例,女48例,年龄21~60岁,平均(40.35±6.78)岁,病程为2~24月,平均(13.12±10.02)个月。对照组中男11例,女50例,年龄21~61岁,平均(41.28±9.47)岁。两组临床资料比较差异无统计学意义(P>0.05)。纳入标准:①系统性硬化症患者符合相关诊断标准[4];②病程≤2年;③临床资料完整;④未经治疗或治疗后停药3个月以上者;⑤患者知情且签署同意书。排除标准:①皮肤严重萎缩、硬化且处于晚期患者;②合并心、肺、肾等严重疾病;③妊娠或哺乳期患者;④精神病患者;⑤合并有心脑血管、肝肾等原发性疾病;⑥假性硬皮病或外伤引起者。
1.1.2 主要试剂 Trizol试剂盒(北京天根生化科技有限公司),反转录试剂盒(Fermentas公司),qRT-PCR试剂盒(美国Invitmgen公司),ELISA试剂盒(中国深圳晶美生物工程公司)。
1.2 方法
1.2.1 样本采集 两组受试人员于次日清晨抽取空腹静脉血10 ml,肝素钠抗凝,其中一部分分离外周血单核细胞用于检测miR-155表达水平,另一部分用于检测血浆IL-17、IL-21水平、Th17细胞及胞内CTLA-4的表达水平。
1.2.2 qRT-PCR法检测两组外周血单核细胞中miR-155表达水平 在1.5 ml离心管中加入1 ml红细胞裂解液并取抗凝血0.5 ml混匀,置于室温10 min,5 000 r/min离心5 min后收集底部的细胞,并重复一遍,按照Trizol试剂盒操作步骤提取总RNA。采用反转录试剂盒将RNA反转录为cDNA,并进行qRT-PCR反应、检测miR-155的相对表达量,反应体系为20 μl:10 μl 2×SYBR Mix,10×cDNA模板1 μl,上下游引物各1 μl,H2O 8 μl,反应程序设定为95℃ 5 min(预变性),95℃ 30 s(变性)、60℃ 30 s(退火),72℃ 1 min(延伸),共30个循环,72℃ 10 min(终延伸)。每个样本设置3个平行反应复孔。在PCR仪上进行反应,其中引物由生工生物工程(上海)股份有限公司合成(表1)。反应结束后对数据进行分析,miR-155以U6作为内参按照2-ΔΔCt法计算基因相对表达量。
表1 qRT-PCR引物序列
Tab.1 qRT-PCR primer sequences
1.2.3 检测血浆IL-17、IL-21水平 将两组人员静脉血静置并留取血浆0.5 ml,-20℃冰箱保存,严格按照ELISA检测试剂盒说明进行操作,将其置于酶标仪上进行检测并读取A值,运用ELISA软件绘制标准曲线并计算血清IL-17、IL-21的浓度。
1.2.4 流式细胞仪检测外周血Th17细胞及CTLA-4表达比例 收集留存血浆后剩余的血细胞并加入磷酸盐缓冲液(PBS)稀释,分离单个核细胞,浓度调整为1×106细胞/ml,将其滴入24孔细胞培养板内,每孔1.5×106细胞/ml,分别在37℃恒温、5%CO2条件下培养5 h。采用2支试管收集细胞,1 000 r/min离心5 min后弃上清液并加入100 μl PBS重悬细胞,每管分别加入异硫氰酸荧光素(FITC)标记的抗人CD4单抗,室温下孵育30 min。用PBS洗涤细胞,1 000 r/min 离心5 min后弃上清,加入500 μl固定液混合均匀并放置30 min,离心后弃上清并加入500 μl破膜剂混合均匀,重复一次。将别藻蓝蛋白(APC)标记的抗人IL-17单抗2 μl加入其中一支试管,在另一支试管中加入CTLA-4 APC 2 μl,4℃下孵育30 min。孵育后再次清洗并离心10 min,弃上清并加入500 μl PBS重悬,立即上机检测。设标记抗体为同型对照并以CD4+设门,采用美国BD公司FAcsCalibur流式细胞仪检测CD4+、CTLA-4+、IL-17+阳性细胞及其所占比例,其中IL-17+细胞代表Th17细胞。

2 结果
2.1 两组外周血miR-155、IL-17、IL-21水平的比较 研究组患者外周血miR-155、IL-17、IL-21水平均明显高于对照组(P<0.05)。见表2。
2.2 两组外周血Th17/CD4+、CTLA-4/CD4+与Th17细胞的比较 研究组外周血Th17细胞及其占CD4+T细胞比例明显高于对照组,CTLA-4的表达比例明显低于对照组(P<0.05)。见表3。
2.3 检测系统性硬化症患者miR-155、CTLA-4、Th17细胞、IL-17及IL-21相关性 Pearson法显示外周血miR-155表达水平与Th17细胞、IL-17及IL-21呈正相关,CTLA-4表达与Th17细胞、IL-17及IL-21呈负相关,Th17细胞与IL-17、IL-21呈正相关(P<0.05)。见表4。
2.4 ROC分析研究组患者外周血miR-155表达与Th17细胞的诊断价值 ROC分析显示miR-155的敏感度为79.73%,特异度为97.62%,截断值为1.16;Th17细胞的敏感度为72.97%,特异度为92.86%,截断值为1.16%。见表5、图1。
2.5 影响系统性硬化症患者的相关因素分析 将影响系统性硬化症患者相关因素进行Logistic多元回归分析,结果显示患者外周血miR-155表达水平、Th17细胞比例、CTLA-4表达水平、IL-17及IL-21均是影响系统性硬化症患者的危险因素。见表6。



GroupnmiR-155IL-17(pg/ml)IL-21(pg/ml)Control group610.98±0.1217.29±5.1211.26±1.75Research group582.03±0.2156.27±6.2928.78±3.52t33.69637.15834.637P0.0000.0000.000



GroupnTh17/CD4+Th17 cellCTLA-4/CD4+Control group610.23±0.120.52±0.341.44±0.21Research group581.75±0.681)4.87±1.161)0.47±0.071)
Note:1)P<0.05 compared with the control group.
表4 相关性检测结果(r/P)
Tab.4 Correlation test results(r/P)

IndexmiR-155CTLA-4Th17IL-17CTLA-4-0.335/0.01---Th170.450/0.000-0.501/0.000--IL-170.417/0.001-0.458/0.0000.698/0.000-IL-210.328/0.012-0.275/0.0370.444/0.0000.271/0.040
表5 研究组患者miR-155与Th17细胞的ROC分析
Tab.5 ROC analysis of miR-155 and Th17 cells in study group
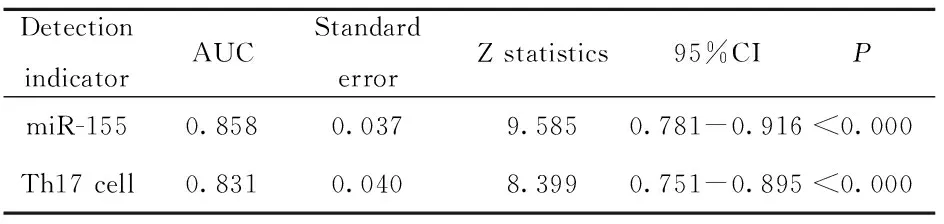
DetectionindicatorAUCStandarderrorZ statistics95%CIPmiR-1550.8580.0379.5850.781-0.916<0.000Th17 cell0.8310.0408.3990.751-0.895<0.000

图1 系统性硬化症患者miR-155与Th17细胞的ROC分析Fig.1 ROC analysis of miR-155 and Th17 cells in patients with systemic sclerosis
表6 影响系统性硬化症患者的相关因素分析
Tab.6 Analysis of related factors affecting patients with systemic sclerosis

Influencing factorβSEWald χ2POR95%CImiR-1550.8160.3744.7600.0122.2611.528-3.347Th171.0680.4276.2510.0032.9082.021-4.185IL-170.5240.3082.8980.0221.6891.305-2.187IL-210.6140.3543.0110.0261.8481.347-2.536CTLA-40.8000.4133.7500.0112.2251.643-3.013
3 讨论
系统性硬化症可影响机体内多个内脏系统的结缔组织发生疾病,严重降低患者生活质量,明确其发病机制并针对性治疗可有效降低患者疾病严重程度[5]。研究表明系统性硬化症的发生常与下游多个免疫细胞的异常相关,IL-6、TNF-α在系统性硬化症的不同阶段时其表达水平存在明显区别并参与疾病发生发展过程[6,7]。miRNAs可在细胞增殖、分化等过程中发挥重要作用,同时可通过调控靶基因表达对机体内调节性T细胞等其他免疫细胞产生重要影响[8]。
miR-155是由BIC(B细胞非编码集合基因簇)基因编码,研究表明miR-155可在银屑病、系统性红斑狼疮等多种免疫相关性疾病中异常表达,可通过调节靶基因CTLA-4的表达参与机体免疫反应过程[9,10]。活化的B细胞、T细胞可促进miR-155表达,CTLA-4是T细胞活化的重要负性调节因子,而miR-155可通过降低靶基因CTLA-4水平进而促使T细胞活化[11]。本研究结果显示研究组患者外周血miR-155、IL-17、IL-21水平均显著高于对照组,说明系统性硬化症患者中miR-155呈高表达。其中IL-17、IL-21可通过增强TNF对成纤维细胞与角质形成细胞的活性进而增加纤维细胞促炎因子数量[12]。推测miR-155表达异常可能促使细胞因子发生紊乱并造成系统性硬化症患者免疫异常。本研究发现外周血中miR-155相对表达量超过1.42时可能已发生系统性硬化症,推测miR-155可作为临床诊断系统性硬化症的分子标志物。
CD4+T细胞可根据细胞的功能分为Th1、Th2、Th17、Treg四个亚群,病理状态下促/抗炎因子分泌异常导致Th1与Th2失衡引起机体免疫功能异常,而Th17细胞可分泌IL-17、IL-21等在人类免疫相关性疾病中发挥重要调节作用[13]。本研究结果显示研究组外周血Th17细胞及其占CD4+T细胞比例显著高于对照组,IL-17、IL-21水平均显著升高,说明系统性硬化症患者体内Th17细胞过度表达并参与疾病的发生过程,且Th17细胞分泌IL-17、IL-21的能力高于正常人,ROC分析结果显示Th17细胞大于3.11%时极可能发生系统性硬化症。本研究结果显示Th17细胞显著高于对照组,而CTLA-4表达比例显著低于对照组,相关性分析显示miR-155表达与Th17细胞呈显著正相关,而CTLA-4与Th17细胞呈显著负相关,说明miR-155在系统性硬化症患者外周血CD4+T细胞中上调表达并可促进CD4+T细胞向Th17型细胞分化。同时Logistic多元回归分析显示患者外周血miR-155表达水平、Th17细胞、CTLA-4表达水平、IL-17及IL-21均是影响系统性硬化症患者的危险因素。
综上所述,系统性硬化症外周血中miR-155表达水平显著升高,Th17细胞比例增加,二者呈显著正相关并参与疾病发生、发展,检测系统性硬化症患者外周血miR-155表达、Th17细胞比例有助于临床诊断,以miR-155为靶点的治疗方案将有助于提高临床疗效。关于miR-155对Th17细胞发挥功能的具体机制有待进一步研究。

