合成环瓜氨酸蛋白短肽诱导猕猴类风湿关节炎模型的研究①
蔡 理 余焙佳 毕亚男 曹艳艳 陈 永 郭小文 肖长虹 陈恩生
(南方医科大学中西医结合医院,广州510315)
类风湿关节炎(Rheumatoid arthritis,RA)是一种以全身多关节对称性肿痛为特点的慢性炎症性自身免疫病,其重要病理特征慢性滑膜炎、滑膜血管翳的形成常引起受累关节出现进行性破坏,导致较高的致残率[1]。近年大量基础与临床研究揭示瓜氨酸化蛋白及抗瓜氨酸化蛋白抗体(Anti-citrullinated protein antibody,ACPAs)在RA免疫炎症反应的启动和维持过程中发挥重要作用,瓜氨酸化蛋白能充当诱导机体特异性免疫应答的始动抗原,产生ACPAs并介导软骨侵蚀及骨质破坏,在RA的诊断及病情预测上均具有重要意义。目前国内外已建立几个以瓜氨酸化蛋白为抗原诱导的关节炎动物模型[2-5],但由于瓜氨酸化蛋白种类、诱导方式、注射剂量及实验动物遗传背景不同,各模型表现出不同的关节炎特点,且与人类RA也存在诸多差异,制约了这些模型的广泛应用。
本课题组前期研究证明,通过偶联血蓝蛋白(Keyhole limpet hemocyanin,KLH)的人工合成的环瓜氨酸化波形蛋白短肽(Cyclic citrullinated vimen-tin,CCit-Vim)具有较强的免疫原性,能够诱导小鼠发生关节炎,并在其血清中能检测到人类RA特异性的ACPAs的存在[6]。但由于RA啮齿类动物模型与人类RA的遗传背景、免疫学、病理学特征上存在较大差异,且关节结构太小,不利于多种影像检查手段的实施,导致该短肽诱导性关节炎小鼠模型目前尚不能作为研究人类RA的成熟实验动物模型。因此,我们拟以偶联血蓝蛋白的环瓜氨酸化波形蛋白短肽(CCit-Vim+KLH)免疫猕猴,进一步来探讨该短肽在灵长类大动物中的免疫原性及诱发关节炎模型的可行性,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 8只成年雄性猕猴,年龄8~12岁,体重6~10 kg,由南方医科大学实验动物中心提供[SCXX(粤)2017-0030]。单笼饲养于东莞南方医科大学明珠实验动物中心大动物实验室,控制实验室条件为:保持实验室12 h光照、12 h黑暗交替循环;室内温度控制在(22±1)℃;相对湿度控制在50%±20%;室内空气不循环,但交换12~15次/h。每日用市售的专用猴饲料喂养猕猴,并补充新鲜水果。在此条件下适应性喂养2周。
1.1.2 主要试剂 Zoletil 50麻醉剂(Virbac,法国),鸡Ⅱ型胶原蛋白(Type Ⅱ Collange,CⅡ,成都瑞芬思生物科技有限公司),完全/不完全弗氏佐剂(Sigma,美国),抗CⅡ抗体、抗CCP(Cyclic citrullina-ted peptide,CCP)抗体、TNF-α、IL-6等ELISA检测试剂盒(上海纪宁生物科技有限公司),HE染液(Panera)。
1.2 方法
1.2.1 环瓜氨酸化蛋白短肽及偶联肽的合成 参考文献[7]研究成果,选定CCit-Vim 26~44位氨基酸序列:SSXSYVTTSTXTYSLGSAL,参考文献的[8]方法,将此短肽中1、14位的2个精氨酸替换为半胱氨酸,形成二硫键,合成环状短肽(CCit-Vim 26~44),再与KLH偶联形成偶联物(CCit-Vim 26~44-KLH),纯度为98%。该部分内容委托武汉ABclonal生物公司人工合成。
1.2.2 模型制作
1.2.2.1 抗原乳化液制备 将10 mg鸡CⅡ,加入0.1 mol/L乙酸溶液1 ml,4℃搅拌过夜,配制成10 mg/ml的CⅡ溶液[9,10];4 mg CCit-Vim+KLH粉末,溶于2 ml 1×PBS中,配成2 mg/ml的CCit-Vim+KLH溶液。在超净台中,使用精密匀浆器分别将10 mg/ml的CⅡ溶液1 ml、2 mg/ml的CCit-Vim+KLH溶液2 ml与等体积的完全弗氏佐剂或不完全弗氏佐剂混匀乳化,终浓度分别为5 mg/ml、1 mg/ml[2]。乳化条件为冰浴上操作,匀浆器25 000 r/min,2 min,暂停2 min,反复4次,至形成油包水白色乳液,滴至水中不扩散为好。
1.2.2.2 猕猴分组 8只猕猴随机分为2组,每组4只,分别为CCit-Vim+KLH组(CCV+K-IA)、CⅡ组(CIA)。各组年龄、体重差异无统计学意义(P>0.05)。
1.2.2.3 造模 CCV+K-IA组注射CCit-Vim+KLH乳化液,首次诱导免疫选择在猕猴背部,分为10个部位皮下注射,总剂量为2 mg(1 mg/ml)。首次免疫后第4周和第8周分别进行强化免疫一次,剂量及注射方式同前;CIA组注射CⅡ乳化液,首次诱导免疫选择在猕猴背部,分为10个部位皮下注射,总剂量为5 mg(5 mg/ml)。首次免疫后4周进行强化免疫一次,剂量及注射方式同前[9,11]。
1.2.3 模型评价
1.2.3.1 猕猴一般状况及关节炎症表现的观察 ①注射前及注射后每周称重记录体重变化及观察有无脱毛等情况。②免疫前后每周采用兽用红外线体表温度计测量食蟹猴关节温度变化。③受累关节活动功能情况:每天观察受累关节的活动情况,注意是否出现关节肿胀、畸形及活动状况。
1.2.3.2 炎症指标及血清学检测 首次免疫后第4、8、12周,猕猴麻醉后采集外周血,全血采用魏氏法检测红细胞沉降率 (Erythrocyte sedimentation rate,ESR);其余外周血3 000 r/min离心10 min后获取血清置于-20℃冰箱保存备用。C反应蛋白(C-reaction protein,CRP)、抗CⅡ抗体、抗CCP抗体、TNF-α、IL-6水平:根据相关抗体的ELISA检测试剂盒说明书进行操作。ELISA法检测CCit-Vim短肽抗体:pH7.4的1×PBS溶解 CCit-Vim短肽(等电点5.51) 至终浓度 20 μg/ml,先用100 μl短肽抗原包被 96孔酶标板,采用HRP标记的羊抗鼠通用型二抗,TMB显色,酶标仪读取450 nm的OD值。
1.2.3.3 影像学检查 免疫后第4周与第8周分别进行四肢关节的影像学检查(双手关节X线、四肢关节超声)。X线双手关节Sharp评分标准[12]:骨侵蚀评分:①关节面骨质疏松、中断,计1分;②关节侵蚀但不超过骨关节面的1/2,计2分;③关节侵蚀约占骨关节面的1/2,计3分;④关节侵蚀超过1/2,但尚有部分正常关节面,计4分;⑤关节面骨质完全破坏,计5分。关节间隙狭窄评分:①局部狭窄或可疑关节间隙狭窄,计1分;②普遍狭窄,但程度不超过正常的1/2,计2分;③狭窄程度等于或超过正常的1/2,计3分;④关节间隙消失、强直,计4分。关节超声标准(EULAR-OMERACT关于RA滑膜炎超声分级的组合评分系统)[13]:0级:正常关节,即灰阶超声未见滑膜增厚(Synovial hypertrophy,SH)(低回声),无论是否存在积液(Effusion)(无回声),滑膜内未见血流信号(Power doppler,PD);1级:轻度滑膜炎,即1级滑膜增厚+≤1级血流信号;2级:中度滑膜炎,即2级滑膜增厚+≤2级血流信号或者1级滑膜增厚+2级血流信号;3级:严重滑膜炎,即3级滑膜增厚+≤3级血流信号或者1级/2级滑膜增厚+3级血流信号。
1.2.3.4 组织病理学检测 首次免疫后12周采用安乐死处死8只猕猴,获取足掌指间关节、腕关节、双膝关节,10%福尔马林溶液浸泡固定后放入10%硝酸脱钙液中脱钙24 h,随后脱水进行石蜡包埋,切成5 μm 切片。HE染色、中性树胶封片,光镜下观察炎症细胞浸润、滑膜厚度、软骨及骨侵蚀情况。半定量评分法评价滑膜增生程度,评分标准如下[14]:滑膜增生程度分为0~4分;0分:无滑膜增生;1分:滑膜增生,滑膜成纤维细胞密度低,未能侵犯到皮下组织;2分:滑膜成纤维细胞密度较高,并侵犯到皮下组织;3分:在2分的基础,滑膜组织内或侵犯区出现纤维化坏死结节;4分:除有3分的表现外,还见到至少一个以上类似生发中心的滑膜细胞簇集区。
2 结果
2.1 两组猕猴的临床表现 如图1所示,两组猕猴中共有7只出现关节症状,其中CCV+K-IA组中发现关节症状的3只猕猴于首次免疫后第4周开始陆续出现双手指间关节僵硬无法屈伸,至第6周部分表现为临床常见的“天鹅颈样”畸形,行为活动受限,并持续至观察期结束;CIA组4只猕猴于第4周出现类似关节炎症状,其关节炎症状表现、发生部位与CCV+K-IA组相似;两组猕猴于首次免疫后均出现不同程度的食量下降,情绪冷漠且行动迟缓,体重由首次免疫后均平缓下降,并在第4周左右进入稳定期,平均体重较注射前减轻5%~10%,并在首次免疫后第2周开始可触及四肢、足掌温度高于躯干,平均增长1.0~1.5℃,并持续至观察期结束。
2.2 炎症指标 两组猕猴不同程度的ESR、CRP升高,提示两组猕猴在首次免疫后均处于炎症活动期。如图2所示,其中两组猕猴的CRP水平在首次免疫后均高于正常水平(CRP>1 mg/L)并持续至观察期结束,而CIA组中发展成急性关节炎症状的1只猕猴,CRP水平在首次免疫后1~2周时处于高峰期(CRP>50 mg/L);在首次免疫后,仅有CIA组中发生急性关节炎症状的1只猕猴出现ESR水平明显升高(ESR>20 mm/h),而在加强免疫后第1周,CCV+K-IA组3只猕猴与CIA组4只猕猴的ESR高于正常水平,并随着时间的延长呈下降趋势,但在第12周观察期结束时所有猕猴的ESR水平均在正常值范围。
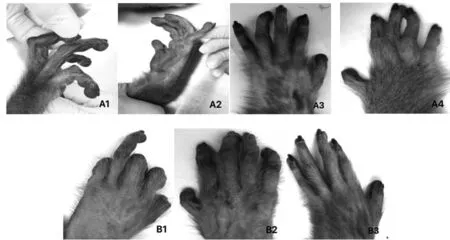
图1 两组猕猴的关节症状表现Fig.1 Joint symptoms of two groups of macaquesNote: A1,A2,A3,A4.CIA;B1,B2,B3.CCV+K-IA.
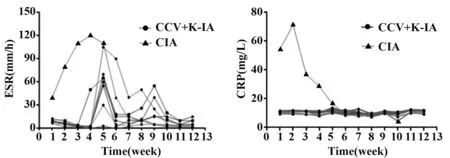
图2 免疫后猕猴的ESR和CRP水平Fig.2 Levels of ESR and CRP in rhesus monkeys afterimmunization
2.3 抗体水平 两组猕猴均产生不同水平的抗CCit-Vim、抗CⅡ抗体、抗CCP抗体,这提示经CCit-Vim+KLH短肽诱导,即使无临床表现的猕猴,也存在对短肽产生的免疫应答反应。我们检测了2种瓜氨酸化表位特异性抗体水平(如图3所示),一是抗CCit-Vim短肽抗体:免疫前CCV+K-IA与CIA组比较,差异无统计学意义(P>0.05),免疫后第12周CCV+K-IA高于CIA组,差异有明显的统计学意义(P<0.05);二是抗CCP抗体:免疫前与免疫后第12周CCV+K-IA与CIA组比较,差异均无统计学意义(P>0.05)。抗CⅡ抗体水平:CCV+K-IA与CIA组每4周表达水平比较,差异无统计学意义(P>0.05)。
2.4 炎症因子 如图4所示,TNF-α:CCV+K-IA与CIA组每4周表达水平比较,差异无统计学意义
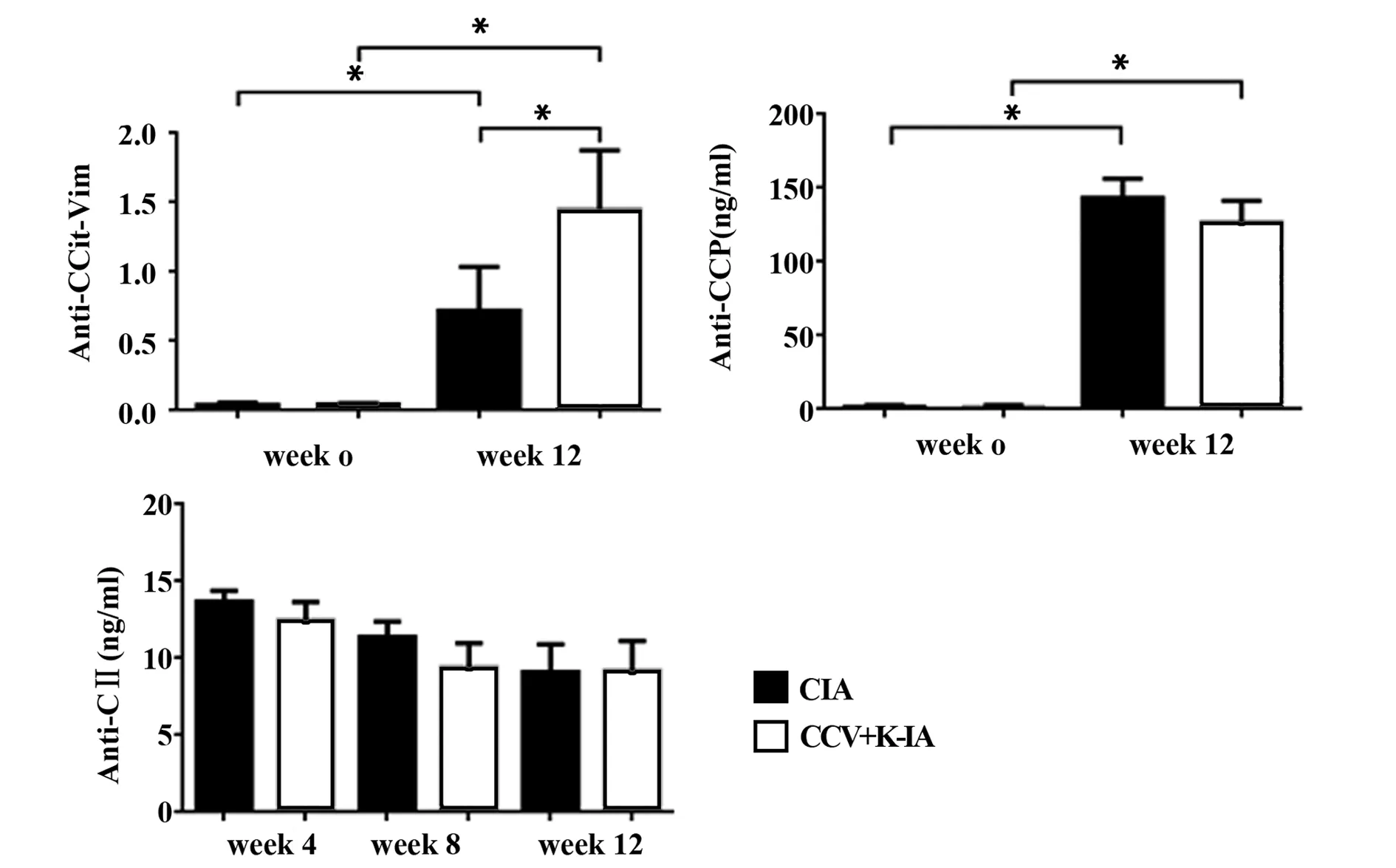
图3 血清抗体水平Fig.3 Levels of serum antibodyNote: *.P<0.05.
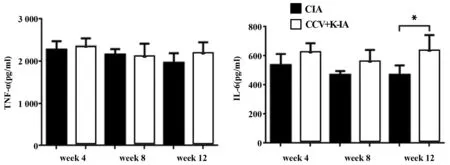
图4 血清炎症因子水平 Fig.4 Inflammatory factorNote: *.P<0.05.
(P>0.05)。IL-6:免疫后第4、8周两组表达水平比较,差异无统计学意义(P>0.05),第12周CCV+K-IA组IL-6表达水平高于CIA组(P<0.05)。
2.5 双手X线 对比免疫后第4周和第8周X光影像检查结果可见,两组猕猴关节病变呈进行性发展,如图5A1、A2显示:两组猕猴的双手指间关节均可观察到不同程度的关节周围软组织肿胀、关节间隙显示模糊、狭窄,部分可见间隙融合;部分猕猴还可观察到近端指间关节端骨质疏松、关节表面骨质破坏,腕关节皮质下小囊状性变及远端指间关节严重畸形等。如图6所示,与免疫后第4周相比,CIA与CCV+K-IA组的X线sharp评分在第8周较第4周均有升高,差异具有统计学意义(P<0.05),而同期评分两组之间比较,差异无统计学意义(P>0.05)。
2.6 关节超声 如图7B1、B2显示:两组猕猴的双手指间关节、双足跖趾关节及腕关节均可见不同程度的滑膜炎以及血流信号,提示炎症反应存在,部分
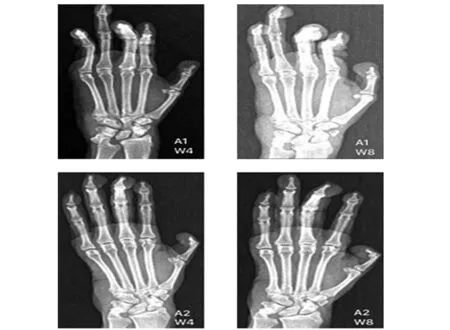
图5 免疫后第4周和第8周X线检查Fig.5 X-ray at 4 and 8 weeks after immunizationNote: A1.CIA;A2.CCV+K-IA.
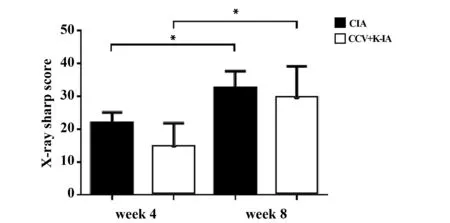
图6 X-ray sharp评分Fig.6 X-ray sharp scoreNote: *.P<0.05.
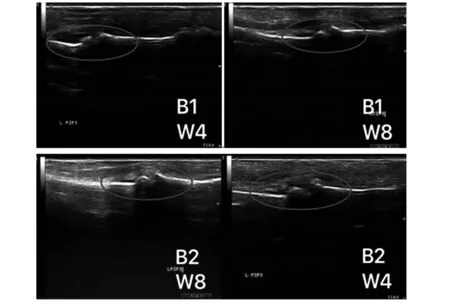
图7 免疫后第4周和第8周关节超声改变Fig.7 Ultrasound classification changes at 4 and 8 weeks after immunizationNote: B1.CIA;B2.CCV+K-IA.
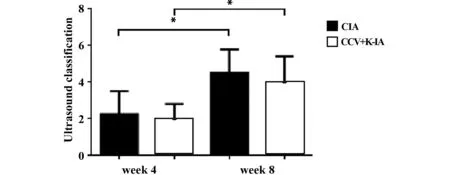
图8 超声滑膜炎评分Fig.8 Ultrasonic synovitis scoreNote: *.P<0.05.
猕猴可探查到指间关节骨质增生,手腕关节滑膜炎、肌腱炎等;如图8所示,与免疫后第4周相比,CIA与CCV+K-IA组的超声滑膜炎分级评分在第8周较第4周均有升高(P<0.05),差异具有统计学意义,而同期评分两组之间比较,差异无统计学意义(P>0.05)。
2.7 关节组织病理学 根据影像学检查结果指示,分别获取两组猕猴的腕、膝关节滑膜组织及近端指间关节组织。其中腕关节滑膜HE染色(图9A1、B1)与膝关节滑膜HE染色(图9A2、B2)显示:两组猕猴腕、膝关节关节腔中取得的滑膜组织中均可见到大量滑膜细胞,并伴炎症细胞浸润、滑膜血管翳形成,且膝关节部位滑膜成纤维细胞密度较症腕关节更高,滑膜细胞在10~12层间;近端指间关节HE染色(图9A3、B3)显示:两组猕猴近端指间关节均可见轻中度的滑膜增生向关节腔内生长,滑膜细胞在3~5层间,部分可见侵犯软骨表面,并伴有炎症细胞浸润。如图10所示,对两组各关节部位滑膜增生程度进行半定量评分,CCV+K-IA与CIA组的指间、腕、膝关节滑膜增生半定量评分相比,差异均无统计学意义(P>0.05)。
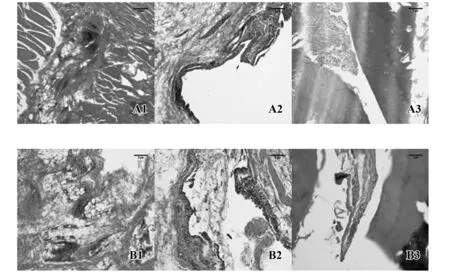
图9 猕猴腕、膝关节滑膜及近端指间关节病理学HE染色(×10)Fig.9 HE staining of wrist,knee and proximal interphal-angeal joints(PIP) synovium in monkeys(×10)Note: A1,A2,A3.CIA;B1,B2,B3.CCV+K-IA.

图10 滑膜增生评分Fig.10 Score of synovial hyperplasia
3 讨论
我们在前期研究中发现,以人工合成偶联KLH的CCit-Vim短肽作为抗原诱导剂具有较强的免疫原性,能诱导DBA1/J小鼠发生关节炎[6]。但由于该环瓜氨酸化蛋白短肽诱导性关节炎模型在关节炎发病特点、免疫学、病理学特征方面与CIA以及人类RA尚存在诸多差异,导致该小鼠模型目前尚不能成为一个理想的RA动物模型。为进一步揭示该合成短肽的致关节炎作用,建立更加符合人类RA病情特点的RA模型,我们选择与人类亲缘关系更接近、且更加适合采用现代影像学检查手段的灵长类大动物猕猴作为实验动物进行造模。本次研究发现,偶联KLH的CCit-Vim短肽不仅能诱导小鼠发生关节炎,也能诱导非人灵长类猕猴产生更接近人类RA病情发展的关节炎症状。首次免疫后CCV+K-IA组猕猴体重出现减轻、行动迟缓,第4周可触及双手指间部分关节僵硬无法屈伸,持续加重直至第6周开始出现畸形,且受累关节数逐渐增多,并由手关节逐渐发展至足关节。相较于RA鼠、兔等动物模型,CCV+K-IA诱导猕猴发生的关节炎症状、部位与人类RA更加接近,且始终高于正常水平的CRP也提示关节持续处于炎症的活动期,造成关节炎发病的持续时间更长。但CCV+K-IA猕猴早期并没有出现关节红肿、发热痛的急性关节炎表现,而突出表现为缓慢发展的关节变形,直至实验观察后期出现典型关节畸形的功能障碍,这一点与临床上一部分RA患者关节肿痛不明显、而疾病后期关节变形显著是相符合的。
现代RA的临床治疗中,影像监测成为RA病情活动判断的重要指标。其中关节X线的使用最为广泛,对评估关节的骨质破坏具有重要的意义,但对早期病变如滑膜增生、软骨侵蚀缺乏敏感性,而关节超声则对滑膜、软骨、关节积液、肌腱等早期病变能清楚分辨[15],并可以清楚显示滑膜内的血流信号[16]。CCV+K-IA组的X线平片上能观察到双手指间关节间隙狭窄,部分可见关节软组织肿胀、关节端骨质疏松、关节表面骨质破坏。关节超声则显示双手指间关节、双足跖趾关节及腕关节可探查到滑膜炎和肌腱炎的存在。双手X线和关节超声两次检查结果对比显示,CCV+K-IA猕猴较前次检查时受累关节数有所增加且关节滑膜炎病变程度加重,其中手关节破坏先于足关节,这些特征都与临床RA非常相似。双手X线和关节超声定量评分结果均显示,CCV+K-IA组与CIA组差异无统计学意义。我们选取观察到影像学改变的关节部位组织进行切片染色,其病理实质可见大量滑膜细胞和明显的炎症细胞浸润,以及不同程度的滑膜增生和骨质破坏,提示CCV+K-IA猕猴即使到了关节变形的后期改变时其病变关节仍处于关节滑膜炎的活动期,这与临床观察到持续加重的关节畸形也相符合,更好地模拟了人类RA呈慢性滑膜炎症及进展性骨质破坏的特点。
两组猕猴产生了不同水平的抗CCit-Vim短肽抗体、抗CCP抗体,说明CCit-Vim短肽作为抗原诱导剂引起了猕猴免疫系统的应答反应。CCV+K-IA组猕猴产生抗CCit-Vim短肽抗体的水平显著高于CIA组,这说明偶联KLH的CCit-Vim短肽能够诱导猕猴产生免疫应答并产生特异性的抗CCit-Vim抗体,提示CCit-Vim+KLH偶联肽具有较强的免疫原性,能够引起强免疫系统针对短肽中瓜氨酸抗原表位的应答能力,产生大量的ACPAs以产生关节炎。针对血清中的抗CCP抗体,CCV+K-IA组与CIA组产生了相似的抗体水平,一方面提示CⅡ可能含有CCP的抗原决定簇,两者存在较多的同源性,能够诱导猕猴产生抗CCP抗体;另一方面,在我们前期小鼠关节炎模型的研究中,CIA组反而较CCV+K-IA组产生了更高的抗CCP抗体水平,提示了动物种属遗传背景对造模成功的重要性。CCV+K-IA组与CIA组第4、8周的血清TNF-α、IL-6水平比较两组间差异无显著统计学意义,但第12周CCV+K-IA组产生了较CIA组更高的血清IL-6水平,说明CCV+K-IA组比CIA组处于一个时间更长的炎症反应过程,提示我们延长造模周期可能使CCV+K-IA组产生更多ACPAs,从而导致更严重的骨损伤。TNF-α、IL-6是RA重要的炎症因子,抗TNF-α和抗IL-6单抗治疗RA已在临床得到广泛证实。CCV+K-IA有可能作为针对IL-6靶点的药物治疗模型。
综上所述,本研究首次在非人灵长类大动物猕猴上,以人工合成的CCit-Vim作为抗原诱导剂研制环瓜氨酸化蛋白短肽诱导性关节炎模型。尽管该模型关节炎发病率未能达到100%,但其慢性进行性骨质破坏、关节变形等关节炎表现,以及免疫学、影像学、病理学特征与人类RA已非常相似。与既往的几种瓜氨酸化蛋白诱导性鼠模型相比,该模型能更好地模拟人类RA产生症状的关节部位,且慢性持续性的关节滑膜炎和持续进展的骨质破坏也体现了人类RA慢性侵蚀性的病理特点,可在RA的发病机制、病理研究、新药研发和药理药效学研究等方面发挥重要平台作用。

