结直肠癌组织RPN11与Ki67的表达及其临床病理学意义
王晓林,金玲玲,张瑶,曹仕琼
(华中科技大学同济医学院附属梨园医院1消化内科,2内分泌科,武汉 430077)
结直肠癌是全球第三大常见癌症,约占所有新发肿瘤的10.0%,是男性癌症相关死亡的第四大常见原因及女性死亡的第三大常见原因[1]。有统计显示,早期确诊治疗的结直肠癌5年生存率可达90%,肿瘤组织浸润局部淋巴结时5年生存率仍可达71%,当发生远处组织转移时5年生存率只有13%[2],而我国结直肠癌的早期检出率非常低。结直肠癌有一个很长的、可检测的潜伏期,从抑癌基因突变到出现结肠镜下可以发现的腺瘤这个过程需要将近10年[3]。RPN11是蛋白酶体19S调节颗粒中的重要组成部分之一,具有去泛素化酶活性,也是酵母蛋白酶体中唯一不可缺少的去泛素化酶。有研究表明[4],RPN11与细胞分裂的周期有一定的相关性,降低RPN11的表达可以引起细胞凋亡率的提高和细胞周期抑制。Ki67,也称为MKi67,是位于人类第10号染色体上,是肿瘤细胞的增殖相关核标记物,甚至有研究表明,Ki67免疫染色阳性是癌症诊断的金标准[5]。因此,Ki67表达可以用来判断细胞增殖活性及分化潜能。
目前,国内外关于RPN11与结直肠癌的相关性研究较少,RPN11是否参与结直肠癌细胞增殖也尚未证实;Ki67可以用来判断肿瘤细胞的增殖,但尚无关于RPN11、Ki67对肿瘤细胞增殖相关性的研究。本实验采用免疫组织化学方法检测RPN11与Ki67在结直肠癌中的表达,并分析两者之间的相关性,研究它们在结直肠癌发生、发展中的作用以及与癌细胞增殖的相关性。
材料与方法
1 组织标本收集及临床资料
选取华中科技大学同济医学院附属梨园医院2015至2017年病理科存档石蜡包埋组织38例及普外科2018年4月至2018年9月手术切除的结直肠癌组织18例,同时取距离肿瘤>10cm正常组织15例作为对照。新鲜组织标本取于术后30min内,取肿瘤组织、正常组织各一份,分别置于4%多聚甲醛中固定用于制作石蜡切片。所有病例信息资料齐全,均无代谢性疾病、帕金森病、自身免疫性疾病或其他肿瘤疾病史,术前均未进行放化疗等肿瘤疾病相关性治疗。其中男性患者31例,女性患者25例;有淋巴结及远处转移这20例,无转移者36例;左半结肠癌22例,右半结肠癌19例,直肠癌15例;肿瘤分期I-Ⅱ期36例,Ⅲ-Ⅳ期20例;所有组织经病理证实均为腺癌除外1例印戒细胞癌,其中高中级分化结直肠癌34例,低级分化结直肠癌22例,所有正常结直肠组织均经病理证实无肿瘤浸润。
2 材料
兔抗人PSMD14多克隆抗体(12059-1-AP)、兔抗人Ki67多克隆抗体(12059-1-AP)、HRP标记山羊抗兔二抗(SA00001-2)均购自武汉三鹰公司(proteintech);免疫组织化学SABC试剂盒(SA1022)、DAB显色试剂盒(AR1022)购自武汉博士德生物。
3 免疫组织化学染色
采用免疫组织化学SABC法进行所有56例标本均由 4% 多聚甲醛固定,常规脱水,透明,石蜡包埋,3~5μm 连续石蜡切片,烤片,脱蜡,入水,破膜(2%Triton X-100),加3% H2O2于37℃温箱中避光反应30 min,PBS 清洗;用pH6. 0柠檬酸液微波热修复,PBS清洗;滴加5% BSA并放于37℃温箱中反应30min,甩去液体,滴加一抗(1:150),37℃孵2h)或4℃过夜),PBS清洗; 滴加二抗,37℃温箱孵育30min,PBS清洗; 加SABC液37℃孵育30min,PBS清洗;滴加DAB显色液,自来水冲洗,苏木素复染,自来水冲洗,脱水,透明,封片。以PBS代替一抗为阴性对照。
4 结果判断方法
每例切片随机抽取5个高倍镜视野,细胞阳性率计算方法为:0%~5%,1分; 6%~50%,2分;51%~75%,3分;76%~100%,4分;染色强度评分为:无色,0 分;淡黄色,1分; 棕黄色,2分;棕褐色,3分。两者得分相乘,≤8分为低表达;>8分为高表达。
5 统计学分析
采用SPSS19.0软件进行统计分析,其中相关性分析采用Spearman等级相关分析,运用χ2检验分析RPN11、Ki67的表达与临床病理参数的关系。
结 果
1 RPN11与Ki67在结直肠癌组织表达增强
RPN11主要定位于细胞质和细胞核,为棕黄色颗粒(图1),RPN11在结直肠癌组织细胞核中呈棕黄色至棕褐色颗粒样着色,部分细胞质中也可见棕黄色颗粒样着色(图1A),在正常结直肠组织中表达较少,部分细胞核中可以观察到黄色颗粒样着色,细胞质中极少(图1B)。RPN11在结直肠癌组织中表达的阳性率50.0%(28/56)明显高于正常结直肠组织15. 0% (3/20)(0.01<P<0.05)。Ki67主要定位于细胞核为棕黄色颗粒(图2),Ki67在结直肠癌组织细胞核中呈棕黄色至棕褐色颗粒样着色(图2A),在正常结直肠组织表达较少,部分细胞核中可以观察到黄色颗粒样着色(图2B)。Ki67在结直肠癌组织中表达的阳性率66.1%(37/56)明显高于正常结直肠组织15. 0%(3/20)(0.01<P<0.05)。Spearman等级相关性分析,两者在结直肠癌组织中的表达呈正相关(表1) 。
2 RPN11与Ki67在结直肠癌中的表达与结直肠癌临床病理特征的关系
χ2检验显示,RPN11和Kid7的表达在不同性别、年龄、部位,差异无统计学意义,而在不同临床分期、分化程度、有无淋巴结转移间具有显著差异(0.01<P<0.05)(表2) 。

图1 RPN11在结直肠癌组织(A)及正常结直肠组织(B)中表达的免疫组织化学检测。 比例尺,20μmFig. 1 Immunohistochemical examination for expression of RPN11 in colorectal cancer tissues (A) and normal colorectal tissues (B). Scale bar, 20μm

图2 Ki67在结直肠癌组织(A)及正常结直肠组织(B)中表达的免疫组织化学检测。 比例尺,20μmFig. 2 Immunohistochemical examination for expression of Ki67 in colorectal cancer tissues (A) and normal colorectal tissues (B). Scale bar, 20μm
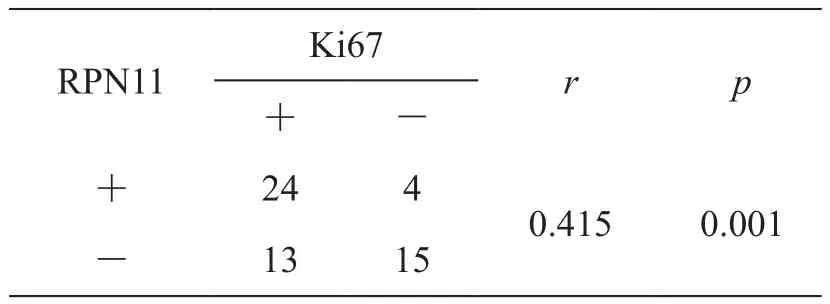
表1 RPN11与Ki67在结直肠癌组织中表达的相关性Tab. 1 Correlation between expression of RPN11 and Ki67 in colorectal cancer tissues
讨 论
RPN11又称PSMD14/poh1,是26S蛋白酶体的重要组成之一。26S蛋白酶体由一个20S核心颗粒(CP)和两个19S调节颗粒(RP)组成,RPN11是蛋白酶体19S调节颗粒盖子结构中的特异性去泛素化酶,在调节多种信号通路中发挥关键作用,包括维持蛋白质稳定性,双链DNA断裂修复,胚胎干细胞分化和细胞增殖等[4,6]。因此,RPN11成为近年来开发新型肿瘤药物的热门靶点之一。关于RPN11在肿瘤表达及作用的研究越来越多,Wang等[7]的研究表明,超活化的POH1-E2F1能调节促进肝癌的发展;Luo等[4]的研究表明,RPN11在乳腺癌的发生发展中起到重要作用,并可能参与乳腺癌细胞周期的调控;另外有研究证明[8],敲低RPN11将显著阻断SNAIL诱导的食管癌,抑制体外肿瘤细胞的迁移和侵袭及体内肿瘤的转移,并且食管癌患者RPN11高表达水平预示其预后不良;最近的一项研究[10]指出,RPN11与肝癌、食管癌等都有密切相关性,RPN11的高表达可能与肿瘤的预后不佳密切相关。敲低RPN11则可以增强蛋白质的稳定性、减弱其降解,增加p53和Bim的表达诱导细胞凋亡。

表2 RPN11、Ki67在结直肠癌中的表达与临床病理特征的相关性Tab. 2 Correlation between the expression of RPN11 and Ki67 in colorectal cancer and clinicopathological features
在本实验中,RPN11在正常结直肠癌组织中主要表达于细胞胞质,也可见于细胞核,呈棕黄色颗粒;结直肠癌组织中RPN11表达率较正常组织显著增高。推测RPN11高表达与结直肠癌肿瘤的发生发展密切相关,进一步证实RPN11可能参与了肿瘤细胞的异常增殖。
Ki67蛋白由两条多肽链组成,其编码基因位于人类10号染色体长臂上,存在于增殖活跃的细胞的G1、S、G2和M期中,而G0期则没有表达,可以用来反映细胞群体增殖活性,Ki67是较为确定的细胞增殖的标记基因之一[5,11]。Ki67与多数肿瘤有着密切关系,一项回顾性研究[12]表明,实施新型化疗方案的乳腺癌患者中Ki67高表达的患者对化疗更加敏感。一篇关于Ki67和胃肠道间质瘤的meta分析中指出,Ki67可能是该肿瘤恶性风险的指标之一[13],Verma等[14]的研究显示Ki67在口腔鳞状细胞癌中高表达,并且与肿瘤的侵袭性有一定相关。
本实验结果显示,Ki67在正常结直肠癌组织中主要表达于细胞核,呈棕黄色颗粒;结直肠癌组织中Ki67表达率较正常组织显著增高,这一结果与胡晓舒[15]等关于结直肠癌中Ki67表达情况的研究结果相同。结合既往研究,我们进一步证实Ki67参与了结直肠癌肿瘤细胞的异常增殖。
通过分析患者的临床病理特征发现,结直肠癌组织中RPN11、Ki67的阳性表达率均与患者的年龄、性别、肿瘤部位均无明显相关性,而与肿瘤的分化程度、临床分期、是否有淋巴结转移有关,即分化程度越低、临床分期越晚及转移越多,则RPN11、Ki67的表达量越高,提示RPN11和Ki67可能参与结直肠癌的侵袭和转移,与结直肠癌的恶性程度及临床分期相关,这将为临床治疗和预后提供一定的指导意义。
相关性研究分析显示,RPN11和Ki67在结直肠癌组织中的表达呈正相关,提示RPN11与Ki67共同促进结直肠癌的发生发展,浸润转移。Ki67是目前较为肯定的增殖细胞标记基因[11],并且参与肿瘤细胞的周期调控,而RPN11的高表达也与恶性肿瘤细胞的增殖有一定的关系,因此我们推测,两者可能共同参与结直肠癌肿瘤细胞的增殖,并且可能在调控结直肠癌细胞的细胞周期中起到协同作用。已有研究表明,敲低RPN11将导致26S蛋白酶体的功能受损,使活跃增殖的肿瘤细胞的细胞周期停滞和死亡,这可能为克服硼替佐米耐药提供新的思路[9]。Pan Li等[16]的一项关于结直肠癌患者的研究显示,晚期结直肠癌患者中高Ki-67表达的患者比低Ki-67表达的患者预后更好,但早期患者的预后与 Ki-67的表达差异无显著统计学差异。近年来,靶向RNA干扰(RNAi)的技术受到广泛的关注,研究已经证实,siRNA介导的Ki67敲低导致体外细胞增殖的有效和特异性抑制[5]。因此,研究RPN11与Ki67在结直肠癌中的表达和相互作用将为研究结直肠癌的治疗和预后提供新的方向。

