耐碳青霉烯肺炎克雷伯菌对替加环素不同体外药敏试验方法学评估
杨柳 刘建华 张智洁 刘勇 秦晓松
(中国医科大学附属盛京医院检验科,沈阳 110004)
肺炎克雷伯菌是寄居于人体呼吸道及肠道的条件致病菌,为革兰阴性肠杆菌科细菌,常造成严重的院内感染,如败血症、尿路感染、腹腔内感染等。随着抗生素的广泛使用,细菌耐药现象日益严重。碳青霉烯类抗生素,即亚胺培南、美罗培南等,具有抗菌活性强、抗菌谱广、对超广谱β-内酰胺酶(extended spectrum β-lactamases,ESBLs)稳定等特点,常用来治疗多重耐药肺炎克雷伯菌导致的严重感染。然而,自从碳青霉烯酶的发现,使这些细菌对几乎除了替加环素(tigecycline,TIG)及多黏菌素外的所有抗生素高度耐药,因此,替加环素引起了学者的高度重视,被认为是治疗耐碳青霉烯肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumoniae,CRKP)感染的最后一道防线[1]。
替加环素是为抵抗四环素类抗生素耐药而对米诺环素进行修饰而成的衍生物,是一种新型的甘氨酰环素类抗生素。2005年,美国食品与药品监督管理局(Food and Drug Administration,FDA)批准替加环素治疗复杂的腹腔感染、复杂的皮肤和软组织感染以及社区获得性细菌性肺炎[2]。2012年在我国批准上市。但目前,我国所采用的美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)制定的标准中尚无替加环素的体外药敏试验的操作指南及结果判定标准,并且替加环素的理化性质不稳定,进行体外药敏试验时对环境要求较高,因此,临床实验室常采用的药敏方法在对替加环素耐药性评估方面往往会出现偏差。为了向临床合理应用替加环素治疗CRKP感染提供可靠的依据,评价替加环素对CRKP不同体外药敏试验的方法学尤为重要。
本研究共收集辽宁省内多家大型三甲医院分离的CRKP 269株,分别采用微量肉汤稀释法、KB纸片扩散法、Vitek-2仪器法及E试验法检测其对替加环素的耐药表型,比较检测结果的差异性,对不同体外药敏试验的方法学进行评价,且本研究首次对国产药敏纸片及E试验药敏试验条进行评估,旨在初步了解辽宁地区CRKP对替加环素的耐药情况,更严谨地为临床合理用药提供依据。
1 材料与方法
1.1 菌株来源
收集辽宁省多家大型三甲医院自2011年1月—2016年12月住院患者非重复CRKP共269株,其中中国医科大学附属盛京医院41株、辽宁省人民医院144株、大连医科大学附属第一医院38株、大连市中心医院20株、中国医科大学附属第一医院10株、中国人民解放军第202医院9株、辽阳市中心医院5株、本溪市中心医院1株、辽宁中医药大学附属医院1株。在受试菌株中,46.5%(125/269)来源于重症监护病房,11.2%(31/269)来源于呼吸内科,9.7%(26/269)来源于急诊科,5.2%(14/269)来源于神经外科,4.8%(13/269)来源于神经内科。受试菌株标本类型包括:痰液66.9%(180/269),血液11.9%(32/269),尿液7.1%(19/269),其他14.1%(38/269)。标准质控菌株为大肠埃希菌ATCC25922。
1.2 仪器与试剂
Vitek-2全自动细菌鉴定与药敏分析仪及革兰阴性细菌药物敏感性卡AST-N335(法国Bio-Merieux公司),替加环素标准品(Toronto Research Chemicals),替加环素药敏纸片及替加环素E试验法药敏试验条(温州市康泰生物科技有限公司),M-H肉汤(英国Oxoid公司),MH琼脂培养基(沈阳彦程生物制品有限公司)。纸片扩散法、E-试验法及微量肉汤稀释法所用M-H琼脂或96孔板均需置于37℃恒温孵箱,避光培养16~18h后读取药敏结果,判读实验结果时质控菌株ATCC25922抑菌圈直径范围应为20~27mm,MIC值范围应为0.0~0.25μg/mL以证明在控[3]。
1.3 结果判读标准
本研究参照FDA肠杆菌科标准及欧洲药敏试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)标准[4-5]对结果进行判读(表1)。
1.4 数据分析
以微量肉汤稀释法为金标准,比较KB纸片扩散法、Vitek-2仪器法及E试验法的一致性。基本一致率(essential agreement,EA):被评估方法所得MIC值与金标准MIC值相同或者相差±1个稀释度的菌株百分比。分类一致率(categorical agreement,CA):被评估方法药敏试验结果(敏感、中介、耐药)与金标准一致的菌株百分比。小误差(minor error,mE):被评估方法将中介判定为敏感或耐药。大误差(major error,ME):被评估方法将敏感判定为耐药。重大误差(very major error,VME):被评估方法将耐药判定为敏感。根据CLSI要求,可接受误差范围为:EA和CA≥90%,VME≤1.5%,ME≤3%,mE≤10%[6]。
2 结果
2.1 4种药敏试验方法测定CRKP对替加环素的敏感性分布
269株CRKP经微量肉汤稀释法测得替加环素MIC50和MIC90分别为0.5和1μg/mL,E试验法的MIC50和MIC90较微量肉汤稀释法均低1个稀释度(0.25和0.5μg/mL),而Vitek-2法的MIC90较微量肉汤稀释法高出2个稀释度。按照FDA及EUCAST判定标准,E试验法敏感率最高,分别为100%(269/269)、98.9%(266/269);Vitek-2法耐药率最高,分别为8.6%(23/269)、13.4%(36/269);纸片扩散法的中介率最高,分别为11.9%(32/269)、46.5%(125/269)。4种药敏试验方法测定CRKP对替加环素的敏感性分布见表2。

表1 替加环素对肺炎克雷伯菌药敏判定标准Tab.1 Interpretation criteria of tigecycline for Klebsiella pneumoniae
2.2 3种方法与微量肉汤稀释法检测结果比较
以微量肉汤稀释法为参考方法,E试验法的EA为90.0%(242/269),多数菌株MIC值较微量肉汤稀释法低1~2个稀释度。按FDA判定标准,E试验法的CA最高,为97.4%(262/269),Vitek-2法和纸片扩散法的CA较低,分别为87.4%(235/269)、85.9%(231/269),但均未出现VME。Vitek-2法的EA较低,为61.7%(166/269)且ME最高,为6.3%(17/269)。按EUCAST判定标准,E试验法CA仍最高,为92.9%(250/269),而纸片扩散法CA最低,仅为46.5%(125/269)。E试验法VME最高,为1.9%(5/269),E试验法、Vitek-2法、纸片扩散法的ME分别为0%(0/269)、7.4%(20/269)、5.6%(15/269),见表3。
微量肉汤稀释法测定替加环素MIC<2μg/mL的CRKP,即较敏感的菌株共251株,E试验法测得绝大多数MIC值与微量肉汤稀释法相同或相差±1个稀释度,MIC值低于微量肉汤稀释法2个稀释度的占5.6%(14/251);Vitek-2法测得大多数MIC值高于微量肉汤稀释法,其中高于微量肉汤稀释法1~3个稀释度的分别占40.2%(101/251)、27.5%(69/251)和10.4%(26/251)。微量肉汤稀释法测定替加环素MIC≥2μg/mL的CRKP,即较耐药的菌株共18株,E试验法测得所有结果均低于微量肉汤稀释法,其中低于微量肉汤稀释法1~4个稀释度的分别占33.3%(6/18)、50%(9/18)、11.1%(2/18)和5.6%(1/18);Vitek-2法测大多数MIC值高于微量肉汤稀释法,其中高于微量肉汤稀释法1~2个稀释度的分别占33.3%(6/18)和44.4%(8/18),见表4。

表2 4种药敏试验方法测定CRKP对替加环素的敏感性分布[%(株)]Tab.2 Comparison of interpretative results and MIC50 and MIC90 of CRKP to tigecycline by susceptibility testing methods [%(No.)]
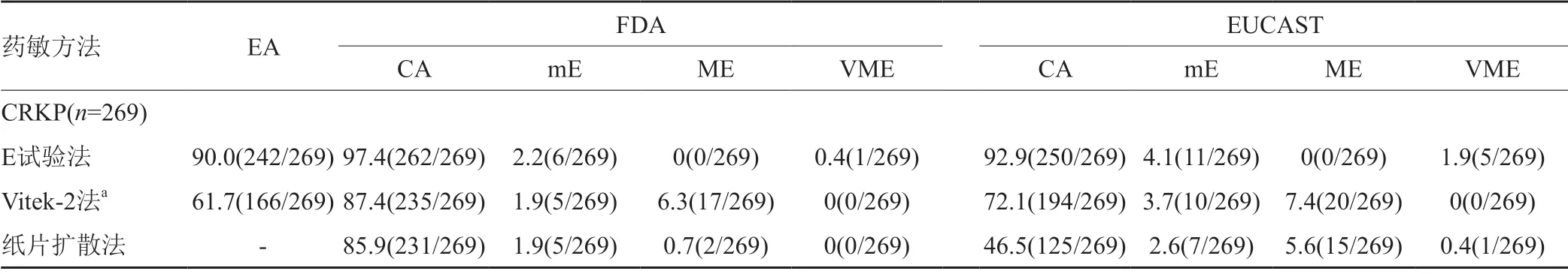
表3 E试验法、Vitek-2法、纸片扩散法与微量肉汤稀释法检测结果比较[%(株)]Tab.3 Incidence of errors for selected testing methods [%(No.)]
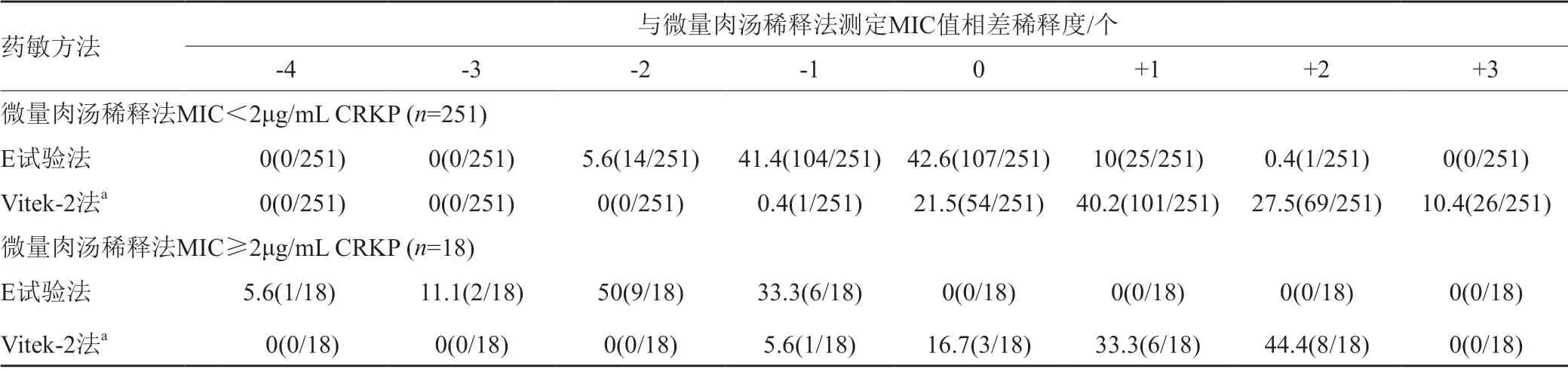
表4 E试验法、Vitek-2法与微量肉汤稀释法MIC值比较[%(株)]Tab.4 Comparison of MIC values between E-test method,Vitek-2 method and broth microdilution method [%(No.)]
3 讨论
目前,由CRKP引起的感染的治疗并未标准化,且通常取决于临床微生物学实验室提供的药敏试验结果。替加环素越来越多地应用于这些感染的治疗,评估其对CRKP的抗菌活性十分重要,因此,确保临床常用药敏试验方法的准确性是尤为必要的。
本研究中,微量肉汤稀释法结果显示,替加环素对CRKP保持较高的抗菌活性,MIC50和MIC90分别为0.5和1μg/mL;E试验法的敏感率最高,为100%/98.9%(FDA/EUCAST判定标准),且无耐药菌株产生,此法较微量肉汤稀释法MIC值普遍低1~2个稀释度;Vitek-2法的耐药率最高,为8.6%/13.4%(FDA/EUCAST判定标准),多数菌株检测MIC结果明显高于微量肉汤稀释法,此结果与相关研究报道相符[7-8]。纸片扩散法的中介率和耐药率都较高,分别为11.9%/46.5%和2.6%/10%(FDA/EUCAST判定标准)。
E试验法、Vitek-2法、纸片扩散法与微量肉汤稀释法检测结果比较发现,E试验法的EA与CA均符合CLSI标准,即大于90%,无ME,但存在VME,可能是由于E试验法所测MIC值稀释度普遍低于微量肉汤稀释法,尤其是耐药性较高的CRKP,出现VME的可能性更大。Vitek-2法为国内微生物实验室常用的药敏检测方法,但本研究结果显示,其EA与CA均较低,EA仅为61.7%,显著低于CLSI参考标准,无VME,但ME较高,为6.3%/7.4%(FDA/EUCAST判定标准)。类似的研究报道表明[9],Vitek-2法适合检测对替加环素敏感的大肠埃希菌,但对MIC>2μg/mL的菌株,Vitek-2法测得的替加环素的敏感率会显著低于微量肉汤稀释法。纸片扩散法的CA最低,为85.9%/46.5%(FDA/EUCAST判定标准),按FDA标准,纸片扩散法的mE、ME均在参考范围内,且无VME。但纸片扩散法易受多种因素影响,如预温育时间、接种菌含量、抗生素含量及其扩散能力、琼脂厚度、纸片保存条件等等,因此,此法仍需大量临床样本加以验证。
微量肉汤稀释法测得MIC值≥2μg/mL的CRKP共18株,其中E试验法经反复复核后,测得MIC值低于微量肉汤稀释法1~4个稀释度的分别占33.3%(6/18)、50%(9/18)、11.1%(2/18)和5.6%(1/18),而微量肉汤稀释法测得MIC值<2μg/mL的251株CRKP中,绝大部分菌株E试验法测得的MIC值相同或降低1个稀释度。可见,对于耐药性越高的CRKP,E试验法与微量肉汤稀释法的一致性越低,VME较高,对临床用药的指导意义也随之减低;而微量肉汤稀释法测得MIC值≥2μg/mL的18株CRKP中,Vitek-2法测定MIC值中≥8μg/mL的CRKP高达14株,对于微量肉汤稀释法测得MIC值为1μg/mL的25株CRKP中,Vitek-2法测定仍有14株MIC值≥4μg/mL。可见,对于敏感性越高的CRKP,Vitek-2法所测结果与微量肉汤稀释法的一致性越低,ME较高,而对于非敏感的CRKP,Vitek-2法与微量肉汤稀释法的一致性较高。总之,类似研究同样可发现当微量肉汤稀释法测得CRKP敏感率较高时,E试验法与微量肉汤稀释法的一致性较高[10];当微量肉汤稀释法测得CRKP耐药率较高时,Vitek-2法的结果与微量肉汤稀释法一致性较高[11]。因此,微生物实验室应严格监测医院及地区的耐药趋势,必要时采用微量肉汤稀释法进一步确认。
综上所述,微量肉汤稀释法是目前被认为检测替加环素体外药物敏感性的金标准方法,但操作较繁琐且对药物及培养基等要求较高,我国已有明确的替加环素体外药敏试验的专家共识[2],操作时应严格遵照执行;纸片扩散法测定结果错误率较高,并不适合单独用于临床样本检测;E试验法虽然与微量肉汤稀释法的一致性较高,但对于替加环素耐药的CRKP,其测定MIC值显著偏低,可见,国产药敏纸片及E试验条均需要进一步验证;Vitek-2法ME较高,其测定MIC值显著高于微量肉汤稀释法。因此,CRKP对替加环素耐药性检测的几种常用药敏试验方法均有其局限性,可考虑联合检测,对于结果不一致的情况,均应参考微量肉汤稀释法。
本次研究收集了辽宁省内多家大型三甲医院的CRKP,药敏试验结果发现,绝大多数CRKP对替加环素仍保持较高的敏感性,可见,替加环素对于临床治疗CRKP感染仍是一个重要的手段。

