无创CT血流储备分数的研究进展
杨国建 孙福成
100730 北京医院心内科 国家老年医学中心
中国心血管病患病率处于持续上升阶段,依据以往调查,推算目前中国冠心病现患人数1 100万[1],占用着大量的医疗资源。经导管冠状动脉造影(catheter-based invasive coronary angiography,CCA)是目前诊断冠心病的金标准,但凭借目测评估的冠状动脉狭窄程度并不能完全代表心肌缺血的严重程度,而且有研究证实稳定型冠心病患者单纯以解剖狭窄程度作为血运重建指征是不能改善预后的[2]。血流储备分数(fractional flow reserve,FFR)是一项从生理功能方面评估冠状动脉狭窄严重程度的技术,它在CCA检查中通过测量最大血流(充血)时狭窄病变远端的压力(导丝压力)和近端的压力(主动脉压力),并计算压力比,得出结果为通过病变的血流比例,即为FFR数值,正常值为1,目前认为<0.8提示病变可引起心肌缺血[3]。将FFR和冠状动脉解剖狭窄程度结合起来综合评估,可以改善预后并能减少不必要的血运重建[4]。
但是,CCA毕竟是一项有创检查,有一定的手术并发症风险[5],在这方面无创检查技术则有一定的优势。冠状动脉CT血管造影(coronary computed tomography angiography,CCTA)已成为一种重要的冠心病无创诊断方法,在低中危患者中甚至可以替代诊断性CCA[6]。CCTA在冠心病诊断方面有很高的敏感性和阴性预测价值[7],但其特异性和阳性预测价值相对较低,尤其是在中度狭窄或临界病变中[8-10]。
那么,有没有一种既没有创伤又能把解剖狭窄和功能狭窄综合评估的技术手段呢?CT-FFR技术应运而生,它利用CCTA提供的血管狭窄程度等数据信息模拟计算出各病变的FFR数值,从解剖和功能两个方面综合评估冠状动脉狭窄程度[11-12],同时又是无创手段,有很好的应用前景,并于2014年11月26日得到美国食品药品监督管理局(FDA)批准。本文将对CT-FFR技术做一综述。
1 CT-FFR的原理
目前,CT-FFR主要有两种计算方法:计算流体动力学(computational fluid dynamics,CFD)和人工智能机器深度学习(artificial intelligence deep machine learning)。
1.1 CFD方法
首先通过整理CCTA测得的各支血管的正常及病变部分的管腔横截面积等数据,建立一个三维的冠状动脉血管树模型[11]。之前的生物模型研究证实,物体的质量和它的解剖及生理是直接相关的[13],另外Choy等[14]的研究证实冠状动脉血流和心肌质量是成比例的,而心肌质量可通过CCTA测得的数据计算得到[11]。因此,冠状动脉的血流和阻力可利用血管树模型中血管直径及对应心肌质量等数据计算出来。利用同样的计算方法,最大血流(充血)状态时的血流、阻力、压力等数据也可得到。在CCA中测量FFR时,最大血流状态是通过静脉或冠状动脉注射腺苷来获得的[3],而在CT-FFR中只能通过模拟计算。之前的大量有创FFR研究证实,注射腺苷后冠状动脉微循环阻力会下降[15]。利用这些数据中的微循环阻力下降的规律可以模拟计算出冠状动脉血管树模型中最大血流状态时的流速、压力等[11]。这种血流计算方法虽然听起来挺简单,实际上是非常复杂的数学模型和方程,需要测量数百万个数据,所以对计算机性能要求很高,所需时间也较长,这也是限制其临床应用的最主要因素。HeartFlow是目前唯一获FDA认证的CFD模型软件。
1.2 人工智能机器深度学习计算方法
近年随着大数据和人工智能技术的兴起,深度学习的人工智能程序将计算速度和计算机精度进一步提高。首先,人工智能利用多层神经网络等技术对已有的冠状动脉解剖和对应的血流动力学数据库进行深度学习和训练,提取与血流动力学相关的必要的形态特征,掌握冠状动脉血管树的形态特征和对应血流动力学参数之间的联系和规律。学习和训练完成后,输入CCTA测得的解剖形态数据,人工智能就可以很快地推算出相应的血流动力学参数,得到FFR数值[16]。这种方法不需实时计算,所以用时较短,对计算机性能要求也比较低,临床可行性高。目前有多家公司正在研发这种计算方法的软件,包括德国西门子公司的cFFR软件(cFFR,version2.0-3.0)[17]和中国科亚医疗公司的深脉分数(DEEPVESSEL FFR)[18]等,北京安贞医院周玉杰团队的单中心研究结果显示,DEEPVESSEL FFR软件诊断心肌缺血的准确度为89.2%、敏感度为94%、特异度为84%,阳性预测值87%、阴性预测值92%,而每位患者的平均计算时间仅需(120±13)s,大大提高了工作效率[18]。与HeartFlow软件相比,这类新的人工智能深度学习软件对心肌缺血诊断的准确性相似,但明显缩短了计算时间,具有更高的临床可行性,但还需更多的临床试验去证实。
2 CT-FFR的早期相关研究
最早的关于CT-FFR的较大规模的3个多中心前瞻性研究均是使用HeartFlow软件,结果都证实了CT-FFR的诊断价值及与有创FFR的良好相关性,为HeartFlow软件通过FDA认证提供了重要依据。
2.1 DISCOVER-FLOW研究[19]
该研究共入组了103例CCTA发现至少一支血管狭窄>50%的患者,先进行有创冠状动脉造影并按照常规流程对某处病变进行FFR测量,然后对同一病变进行CT-FFR测量,过程是双盲的,最后分析两者之间的相关性。结果显示,在评价单支血管时,CT-FFR相对FFR的准确度、敏感度和特异度分别为84.3%、87.9%和82.2%,而评估单个患者时,其相对准确度、敏感度和特异度分别为87.4%、92.6%和81.6%。而且CT-FFR与有创FFR具有良好的相关性,其Spearman秩相关系数为0.717,Pearson相关系数为0.678(均为P<0.0001)。
2.2 DeFACTO研究[20]
该研究入组了252例可疑或确诊的冠心病患者,均完成了CCA和CCTA检查。在CCA中对狭窄程度为30%~90%的病变进行FFR测量,然后对同一病变进行CT-FFR测量,过程也是双盲的。规定FFR和CT-FFR都以≤0.8为阳性标准。以患者为分析对象时,CT-FFR的相对敏感度、特异度和准确度分别为90%、54%和73%,虽然没有达到预设的主要终点,但结果显示CT-FFR对缺血病变的综合诊断能力较单纯CCTA有明显提高:敏感度90%比84%、特异度54%比42%、准确度73%比64%。而在中度狭窄(30%~70%)的亚组分析中,CT-FFR和单纯CCTA的诊断准确度分别为71%和57%,提升程度更加明显。这个结果再次证实了CT-FFR的诊断价值。
2.3 NXT研究[21]
该研究入组了251例怀疑冠心病的患者,先行CCTA,后做CCA,其中100例之后入组的患者要求CCTA在直径≥2 mm的血管中至少有一处狭窄30%~90%的病变,对同一病变由不同试验室分别测定CT-FFR和有创FFR。FFR和CT-FFR还是以≤0.8为阳性标准。以患者为分析对象,CT-FFR的相对敏感度、特异度、阴性预测值和阳性预测值分别为86%、79%、93%和65%,诊断准确度为81%。而以血管为分析对象,CT-FFR的相对敏感度、特异度、阴性预测值和阳性预测值分别为84%、86%、95%和61%,诊断准确度为86%。与DeFACTO研究的结果类似,CT-FFR比单纯CCTA对心肌缺血病变的各项诊断能力都有所提高,其中最具代表性的一项数据是CT-FFR正确识别出了68%的单纯CCTA假阳性结果,即CCTA提示为重度狭窄的患者中,68%的患者CT-FFR测量值≥0.8,最终有创FFR测量值也是≥0.8。应用到临床中可以有效减少不必要的有创冠状动脉造影,节约大量资源(表1、2)。
3 CT-FFR的临床应用前景
3.1 临床应用中的优势
目前来看,CT-FFR最适用于低中危患者的冠心病评估:对可疑冠心病先行CCTA,然后测定狭窄>30%病变的CT-FFR,根据CT-FFR值决定是否进一步行有创冠状动脉造影。图1为推荐的CT-FFR临床工作流程。如前所述,CT-FFR较单纯CCTA特异性提高,降低了假阳性率,避免了不必要的有创冠状动脉造影。

表1 以血管为分析对象时的研究结果对比(%)
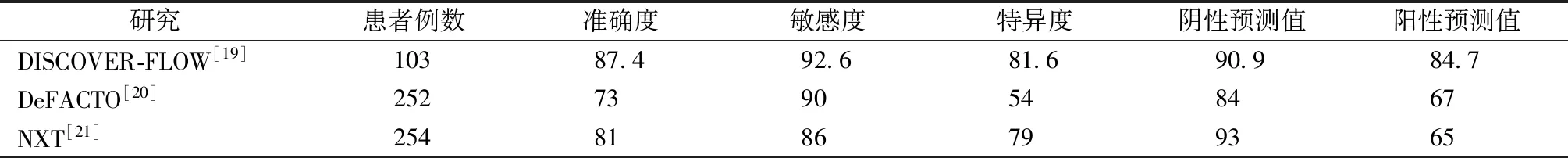
表2 以患者为分析对象时的研究结果对比(%)

图1 CT-FFR的临床工作流程
2015年公布的PLATFORM研究是为了验证在稳定型胸痛患者中CT-FFR指导的诊断流程与传统冠心病诊断流程相比是否能减少不必要的有创冠状动脉造影[22]。在11个中心共入组584例可疑冠心病患者,其中CT-FFR组297例,传统流程组(对照组)287例。CT-FFR组患者均进行CCTA检查,如有狭窄>30%病变予测定CT-FFR,CT-FFR数值<0.8则行有创冠状动脉造影检查。而对照组则按照传统习惯直接行有创冠状动脉造影或先行无创检查(包括单纯CCTA、负荷试验等)再决定是否行有创冠状动脉造影。结果显示,对照组行有创冠状动脉造影检查的患者中有73%未见明显狭窄,而CT-FFR组相应的比例仅有12%。另外,在90 d和1年随访时,根据CT-FFR结果取消有创冠状动脉造影的患者中未发生不良临床事件(包括死亡、心肌梗死、血运重建等)[22-23]。该研究证实了CT-FFR的临床可行性和安全性。Norgaard等[24]组织的一项单中心观察研究也得出了相似的结论。另外,Hlatky等[25]对PLATFORM研究的数据中生活质量评分和医疗资源花费进一步分析发现,与对照组相比,CT-FFR组改善了患者生活质量并大大降低了医疗资源花费,两组人均花费分别为7 343美元和10 734美元。
ADVANCE注册研究[26]是2018年新发表的一项真实世界的多中心前瞻性研究,共入组了2015—2017年来自欧洲、北美和日本38家医疗机构的5 083例可疑稳定型冠心病患者,均进行了CCTA检查并至少有一处狭窄>30%。研究人员先根据CCTA结果给每位患者制定一项初步诊疗方案,包括进一步检查(主要指有创冠状动脉造影)、药物治疗、介入治疗或冠状动脉移植术,随后进行CT-FFR检测,再结合CCTA和CT-FFR的结果对诊疗方案进行调整。结果显示,结合了CT-FFR结果后66.9%的患者改变了诊疗方案,其中初步建议进一步检查(主要指有创冠状动脉造影)的患者中有70%未行有创冠状动脉造影,初步建议行介入治疗或冠状动脉移植术的患者中有25%未行有创冠状动脉造影,而且最终有创冠状动脉造影结果阴性(没有血管狭窄>50%)的比例在CT-FFR≤0.8组和CT-FFR>0.8组分别为14.4%和43.8%,CT-FFR≤0.8组行有创冠状动脉造影的患者中72.3%均进行了血运重建,表明CT-FFR可明显减少不必要的有创冠状动脉造影。在90 d随访时,CT-FFR>0.8的1 592例患者中无1例发生死亡、心肌梗死或紧急血运重建,表明CT-FFR>0.8与良好的短期预后相关。上述真实世界研究结果再次证实了CT-FFR的临床可行性和安全性。
3.2 临床应用中的限制
CT-FFR的临床应用也有一些不足和限制。因为CT-FFR计算是基于CCTA图像数据的,所以检查过程中患者的移动或呼吸幅度过大、血管弥漫钙化、先前置入过支架、人工瓣膜、时相选择不恰当等影响图像质量的因素也会降低CT-FFR的准确率[27-28]。在DeFACTO、NXT和PLATFORM研究中,有11%~13%的患者CCTA图像不适合行CT-FFR计算。另外,严重肥胖和有心房颤动等心律失常的患者不适合行CT-FFR检查,即使没有心律失常,也最好应用β受体阻滞剂把心室率控制在60~65次/min以内[29]。目前,HeartFlow是唯一通过美国FDA认证的软件,它对计算机性能要求很高,而且计算过程长达8 h,这就只能用于稳定型冠心病患者,不适合用于急诊胸痛的患者,新的计算方法(人工智能机器深度学习)有希望克服这个问题[30],但还需更多的研究证实其临床应用可行性。关于CT-FFR的正常范围,目前还无统一定论,大多数研究参考了有创FFR,设定≤0.8为异常值,这还需要进一步研究和讨论[31]。还有就是花费的问题,目前美国CT-FFR价格约为1 500美元,与单纯CCTA相比还是明显提高的。另外,CT-FFR指导临床策略的长期预后还需进一步的研究去评价。
4 小结
CCTA是目前临床上应用广泛的一种冠心病无创诊断方法,但有一定的假阳性率,导致一些不必要的有创冠状动脉造影。CT-FFR技术是通过对CCTA图像数据的进一步处理和计算对缺血做出功能性诊断,多项研究已经证实了其诊断稳定型冠心病的准确性及临床可行性和安全性。但由于图像质量及计算方法等问题,也有一些不足和限制。随着人工智能等技术的发展和更多的循证医学证据,相信CT-FFR在未来冠心病诊断等方面会有广阔的应用前景。
利益冲突:无

