微小RNA在双生子单冠心病患者中的差异表达
秦聪 杨飞
710032 西安,中国人民解放军空军军医大学第一附属医院(西京医院)心血管外科(秦聪);710032 陕西中医药大学附属西安中医脑病医院康复医学科(杨飞)
冠心病是临床常见疾病。近年来,随着微小RNA(microRNA,miR)组学的出现及双生子经典研究途径的发展,使冠心病调控因子的研究进入了全新阶段。为了寻找冠心病实际调控miRs,本研究首次在miR的基础上,引入双生子研究疾病基因特征的经典方法,以两对冠心病-健康双生子为研究对象,筛选出了冠心病发生调控的差异miRs,并初步分析了miRs在冠心病调控中的作用。
1 对象和方法
1.1 研究对象
选择在中国人民解放军空军军医大学第一附属医院(西京医院)就诊的两对男性冠心病-健康同卵双生子(经过DNA鉴定)作为研究对象,一般资料见表1。其中2例经询问病史、体格检查、心电图、心电图平板运动试验、冠状动脉造影检查明确诊断冠心病[1],且近3个月无疾病和用药史。其他2名健康者无冠心病临床症状、体征,经体检专家诊断、影像学检查均显示体健,且近3个月无疾病和用药史,为对照组。两对同卵双生子均无冠心病家族史。实验均知情,且通过医院伦理委员会批准。
1.2 实验方法
晨起空腹采集研究对象肘静脉血5 ml,使用TRIzol法提取总RNA,并用RNasey Mini Kit (QIAGEN)纯化。使用NanoDrop ND-1000测量纯化后的RNA浓度,电泳检测RNA完整性。使用Wash buffer kit (Exiqon)清洗芯片。通过对miR芯片和基因芯片质控点的计算,归一化处理原始数据,将处理后的数据按照4次重复取中间值做标准化,再计算研究组与对照组的比值,根据具体实验结果剔除信号过低的点,进行差异判断。使用差异倍数比值(fold change)和P值进行差异表达的miRs筛选。应用miR生物信息学软件MicroCosm、TargetScan和 MIRDB对芯片检测差异表达的miRs进行靶基因预测,选择至少两种软件交集的靶基因做进一步分析。采用在线分析软件DAVID对靶基因进行GO注释及富集KEGG通路分析。运用Cytoscate软件绘制冠心病miR和靶基因相互作用网络图像,通过分析网络寻找中心节点。
1.3 统计学方法
采用SPSS 11.0统计学软件进行数据分析。采用Student’st-test、Fisher精确概率法计算P值,P<0.05为差异有统计学意义。
2 结果
2.1 冠心病总RNA质量检测报告
在两对冠心病-健康者双生子中,对提取的总RNA进行紫外吸收法和琼脂糖凝胶电泳检测。结果显示,所有样本总RNA的OD260/OD280介于1.8~2.0之间,符合RNA质量标准,4个组织样本的总RNA均符合基因芯片的质量需要,见表2。
2.2 miR芯片表达数据的处理结果
对各组中各样本总RNA进行相应处理后与miRCURYTM LNA芯片进行杂交,并使用Axon公司的GenePix 4000B微阵列芯片信号扫描仪扫描,使用GenePix Pro V.6.0 软件读取扫描图像中的原始荧光信号强度。如图1显示,各组内各个重复实验的芯片之间一致性较高,芯片实验质量较好,各组芯片数据之间具有可比性且可信度较高。
2.3 筛选差异表达的miRs
利用差异倍数比值和P值(默认差异倍数比值≥2,P≤0.05)对两组样本进行差异表达miRs的挑选,结果在冠心病和健康者之间共筛选出43个显著差异表达的miRs(已经随机抽取验证),其中12条表达上调,31条表达下调,显著变化的有7条,主要为下调miRs,其中最为显著的hsa-miR-338-5p、hsa-miR-1066-5p、hsa-miR-3074-3p、hsa-miR-4505、hsa-miR-3658和hsa-miR-4459分别下调10倍以上,hsa-miR-4699-3p上调8倍以上,见表3。

表1 研究对象一般资料
注:a血脂参考值:总胆固醇<5.18 mmol/L,三酰甘油<1.7 mmol/L,低密度脂蛋白胆固醇<3.37 mmol/L,高密度脂蛋白胆固醇>1.04 mmol/L

表2 冠心病总RNA质量检测结果

图1 实验的芯片荧光信号强度相关性
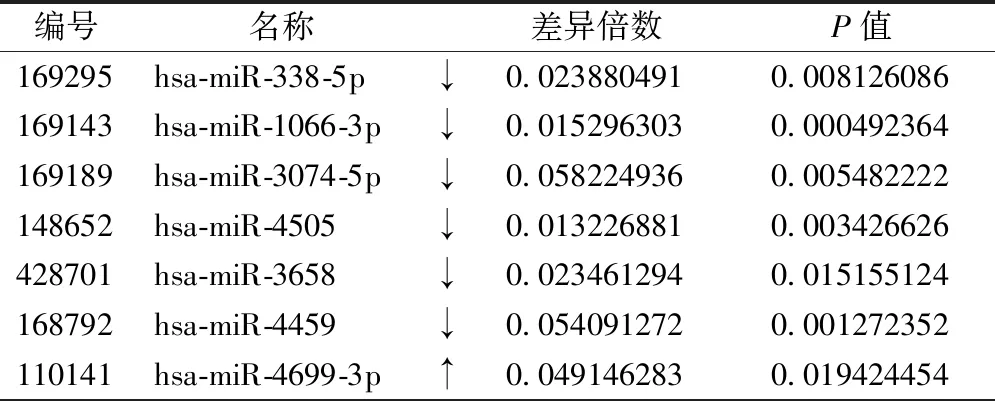
表3 冠心病患者差异表达显著的miRs信息
2.4 靶基因预测
分别从MirBase、TargetScan和MIRDB数据库调取显著差异表达miRs靶基因信息。筛选数据库中共有的miRs靶基因数据作为靶基因预测结果,见表4。

表4 miRs部分靶基因
2.5 差异表达miRs靶基因GO分析
在生物学过程方面(go biological process),差异表达miRs靶基因主要与转录、转录调控、信号转导、凋亡过程及生物合成等相关,见表5。

表5 差异表达miRs靶基因在生物学过程方面的分析结果
在分子功能方面(molecular function),差异表达miRs靶基因主要与离子结合、DNA结合、转录等相关,见表6。

表6 差异表达miRs靶基因在分子功能方面的分析结果
在细胞成分方面(go cell component),差异表达miRs靶基因主要与细胞核、细胞质、细胞器调控等有关,见表7。

表7 差异表达miRs靶基因在细胞成分方面的分析结果
2.6 差异表达miRs靶基因KEGG Pathway分析结果
通过对差异表达miRs靶基因进行Pathway通路分析,共有46条通路,显著差异表达miRs靶基因相关通路主要有T/B细胞受体信号通路、Toll样受体信号通路、JAK-STAT信号通路、Wnt信号通路和MAPK信号通路,见表8。
2.7 miR-DiffGene-Network调控网络
以miR为基础,通过靶基因预测,构建miR-靶基因-Network调控图后发现,一个靶基因可以受多个miRs调节,miR可以同时调控多个靶基因,其中TLR1、TLR2、CD180、MAPK、TLR8受hsa-miR-338-5p、hsa-miR-1066-3p、hsa-miR-3074-5p、hsa-miR-4699-3p、hsa-miR-4505、hsa-miR-3658和hsa-miR-4459的共同调节,每个miR同时调控着多个靶基因,见图2。

表8 部分差异表达miRs靶基因的相关通路和功能
从miR-DiffGene-Network调控网络图中可见,冠心病患者差异表达的hsa-miR-338-5p、hsa-miR-1066-3p、hsa-miR-3074-5p、hsa-miR-4699-3p、hsa-miR-4505、hsa-miR-3658和hsa-miR-4459调控了多个靶基因,如TLR1、TLR2、CD180、MAPK、TLR8、BCL10、PPARD、PLCB1、PPP3R1、DLG1、MAPK1、MAPK9、MAP3K8等,其中TLR1和TLR2均受到上述差异表达的miRs的调控。同时,hsa-miR-4699-3p调控了多个免疫基因,推测miR-4699-3p-TLR1/TLR2在冠心病调控网络中扮演着核心角色。
3 讨论
双生子方法一直是研究疾病特征的经典途径。双生子差异基因筛选,是评估遗传和环境对人类影响的最经典设计。同卵双生子自身基因变异小,产生的差异基因表达较少,作为病例或对照研究特异性状的基因表达具有潜在优势,是研究基因差异性的首选方法。Iwashita等[2]用患病-健康的同卵双生子筛选多发性骨髓瘤的差异表达基因,发现两者间仅有3.2%的基因存在差异。Munshi等[3]利用同卵双生子的骨髓制备成骨细胞样培养物进行全基因组基因表达实验,以探讨骨质疏松症的调控基因。由于同卵双生子差异基因变化较小,而基因是症状表型调控的基础,所以同卵双生子用于冠心病差异表达基因的筛选,对于其发病机制的研究,具有科学性和优越性。
miRNA组学是近年来一个新的研究领域,通过miR的鉴定和功能分析,为疾病的机制研究和治疗提供新的思路[4]。段练[5]、刘佳[6]的研究均发现,miR在冠心病症状调控中有重要作用,对预防冠心病心血管事件具有重要意义。然而即使如此,近年来miR在冠心病中的研究却无一个定性的结果。既往研究显示,冠心病患者存在大量的差异表达miR,后期生物学分析发现,大量的BP、MF、CC、KEGG pathway等对精确疾病的实际调控因子造成了干扰,给分析结果的可靠性带来了不确定因素。同时健康个体间存在差异表达miR,这些差异表达的miR可能与所研究疾病无关,但在常规研究途径中,个体间差异miR无法排除,这些与疾病无关的miR会造成大量的干扰调控因子,这些干扰调控因子很难判判断是否在疾病中起作用,最终使研究结果出现大量的相关数据,却无法得到一个定性的结果。针对这一问题,有专家提出加大样本量,严格控制筛查前的差异因素,来减少误差,但实践发现加大样本量不但增加了研究成本,反而会增加筛选的数据量,研究者始终无法摆脱大数据这一困境。且健康个体间差异因素始终无法解决,加上增加样本量所带来的费用投入,小样本量的实验又缺乏统计学意义,导致大量研究者不得不放弃冠心病miR的研究。近年来,同卵双生子经典研究途径的出现为冠心病miR研究带来了新希望。同卵双生子研究疾病基因特征的经典途径彻底解决了以上难题。双生子又称双胞胎,同卵双胞胎指两个胎儿由一个受精卵发育而成。它具有个体差异表达miR少、定性研究结果简单、需要研究样本量少、研究费用低等特性,适合于科学研究。同卵双胞胎是研究疾病差异表达基因的最佳途径,有效避免了个体间差异miR的干扰,极大地减少了筛查的样本量,降低了研究成本,减少了筛查的数据,为后期精确疾病调控因子奠定了基础。

图2 miR-靶基因-Network调控图
本研究中,对冠心病双生子miRNA组学的研究发现,冠心病患者差异miRs表达谱,在这些差异表达miRs中,发现43个miRs中有31个表达下调,12个表达上调,差异表达倍数在10倍以上者均出现在下调组中,分别为hsa-miR-338-5p、hsa-miR-1066-3p、hsa-miR-3074-5p、hsa-miR-4505、hsa-miR-3658和hsa-miR-4459,hsa-miR-4699-3p下调8倍。通过靶基因预测、构建网络调控图发现,TLR1、TLR2、MAPK和CD180均受到hsa-miR-338-5p、hsa-miR-1066-3p、hsa-miR-3074-5p、hsa-miR-4699-3p、hsa-miR-4505、hsa-miR-3658和hsa-miR-4459的调控,由此推测TLR1、TLR2、MAPK和CD180可能在冠心病的发病中扮演重要角色,除这4种靶基因外,本研究中还发现了其他多种可能与冠心病相关的靶基因,如PIK3R1、PLCG1、PPP3R1、PDK1、SOS2、AKT3和RAF1等,在冠心病中表达水平也发生了显著变化,这可能是冠心病发病机制未来研究的方向。
GO分析表明,“免疫应答与转录调控”是最显著富集的项目,“炎症反应”被定为最显著富集途径。其中TLR1、TLR2、CD180、MAPK、TLR8、BCL10、PPARD、PLCB1、PPP3R1、DLG1、MAPK1、MAPK9和MAP3K8等参与了“免疫应答”的调控,表明炎症与冠心病的发生密切相关[7-8]。KEGG显示,多条免疫通路如T/B细胞受体信号通路、Toll样受体信号通路、JAK-STAT信号通路等均参与了冠心病分子机制的调控,其中JAK-STAT信号通路中参与调控的靶基因数最多,包含了TLR1、TLR2、CD180和MAPK等。TLR1/2通路活化可促进外周血单核细胞(peripheral blood mononuclear cell,PBMC)增殖,并增强PBMC对脐带间充质干细胞(umbilical cord mesenchymal stem cell,UCMSC)的免疫杀伤效应,荧光定量PCR结果表明UCMSC中多个免疫相关因子被TLR1/2明显诱导,如白细胞介素(IL-2、IL-6、IL-10、IL-12)、干扰素γ、核因子κB、肿瘤坏死因子α;TLR1/2不影响UCMSC的定向分化能力。因此,TLR1/2可改变UCMSC的免疫状态,在一定程度上诱导针对UCMSC的免疫攻击[9]。骆菲菲等[10]研究发现,激活TLR1/2可有效上调荷瘤机体CD8+T细胞TLR1和TLR2分子的基因和蛋白水平,促进CD8+T细胞分泌功能性细胞因子干扰素γ、IL-2,这一效应依赖于核因子κB和P38通路。表明TLR1/2信号直接作用于荷瘤小鼠的CD8+T细胞并促进其功能,该研究既丰富了TLR的作用范围,也为基于TLR激动剂的肿瘤生物治疗提供了实验依据。JAK1-STAT3信号途径参与了免疫调节,JAK1和STAT3属于促炎基因[11]。在冠心病研究中发现,JAK1和STAT3基因共同受到hsa-miR-4699-3p的调节,而在冠心病中hsa-miR-4699-3p的表达是上调的,其可能抑制了JAK1和STAT3基因的翻译表达,影响JAK1-STAT3信号途径,达到减轻或抗炎的作用,从而修复免疫稳态的紊乱。推测hsa-miR-4699-3p属于炎症修复基因,是机体免疫紊乱自我修复分子。
本研究利用双生子经典途径最终发现,冠心病的发生与miR调控的炎症因子密切相关,其中miR-4699-3p-TLR1/TLR2的调控关系可能成为今后冠心病基因治疗的靶点。
利益冲突:无

