大兴安岭森林演替过程中凋落物分解与DOC释放研究
潘思涵 程宇琪 杜 浩 杨宇娜 王雨晴 张成福
( 内蒙古农业大学沙漠治理学院,内蒙古 呼和浩特 010020)
森林土壤有机碳(SOC)贮量的微小变化可显著引起大气中CO2浓度的改变[1-2]。溶解有机碳(DOC)是SOC中最活跃、最易迁移的部分。土壤中DOC动态影响SOC的储量,也与森林CO2通量存在密切的相关性。DOC在SOC中虽然只占很小部分,但它参与土壤中大量的生物化学进程,是土壤微生物的能量和养分来源[3-4]。因此,DOC的移动是生态系统中营养物质的重要迁移方式,影响着系统中营养物质的有效性[5]。凋落物是森林生态系统的重要组成部分,陆地生态系统每年产生约1 000亿t的有机物,其中约90%以不同的凋落物形式返回到生态系统中[6]。凋落物分解过程是生物地球化学循环中的重要环节,也是森林生态系统中养分归还的主要途径[7]。凋落物分解作用作为生态系统物质循环和能量流动的关键过程,受到广泛关注。影响植物凋落物分解的因素众多,有气候、凋落物的基质质量和功能性状、碎屑食物网等,其过程包括水溶性化合物的淋溶、土壤动物的破碎、微生物对有机物的分解转化等[8-9]。在不同的空间尺度上,影响凋落物的分解速度的因子表现出明显的差异:在小范围内,凋落物化学成分和土壤中分解者的群落组成对分解过程影响较大[10],而在大尺度上,气候因素对凋落物的分解起决定性作用[11]。
近年来,众多学者对凋落物的分解和DOC释放做了相关研究。王行等[12]通过室内模拟增温对不同生境条件下林分凋落物分解的研究中发现,季节变化与不同植物凋落物的化学成分对枯落物的分解速率有显著影响。董雄德[13]在室内研究温度和氮沉降对林分枯落物分解的影响机制中发现,氮沉降和温度升高加快了凋落叶的分解。马元丹等[14]通过室内研究发现,酸雨对毛竹(Phyllostachys heterocycla cv. Pubescens)凋落物分解速率有显著影响。张琴等[15]发现,在红松(Pinus koraiensis)阔叶林中阔叶树种叶凋落物分解速率大于针叶树种。湛贤等[16]的研究发现,随着林分类型不同,凋落物分解过程中释放的DOC量不同,并且DOC含量随着分解的进行而降低。赵晶晶等[17]的通过室内研究发现,大兴安岭不同树种凋落叶在酸雨胁迫条件下的分解速率和DOC释放有明显差异。Kuiters等[18]发现阔叶林比针叶林产生更多地DOC,而Currie等[19]则得出相反结果。Zhang等[20]基于数学模型分析,发现DOC的产生不仅与树种有关,同时与每年森林的凋落量有关,而森林每年产生的枯落物量依赖于森林年龄和树种组成。范跃新等[21]研究了中亚热带常绿阔叶林不同演替阶段矿质土壤DOC浓度的变化,发现演替初期DOC含量较低,中期最高,后期DOC含量有所降低,DOC浓度随土层加深而降低。到目前为止,有关凋落物分解和DOC释放的研究中,室内试验均以单个植物中为研究对象,而野外试验以林分为对象,这些研究都无法确定不同凋落物层释放DOC的情况。通过本项试验,探究不同森林演替阶段不同凋落物层凋落物分解和释放DOC的动态,为天然林保护工程实施后土壤环境的改变提供参考。
1 研究区概况
研究区地处呼伦贝尔市北部,大兴安岭北段西坡,位于北纬 50°05′01″~53°33′25″,东经121°11′02″~127°01′17″,是我国四大重点国有林区之一,属寒温带大陆性季风气候,年平均气温为-5.5 ℃,年降水量为400~500 mm,无霜期80~90 d,冻结期210 d以上。植被类型为北方针叶林,主要树种有兴安落叶松(Larix gmelinii)、樟子松(Pinus sylvestris var. mongolica)、云杉(Picea koraiensis)、 白 桦 (Betula platyphylla)和 山 杨(Populus davidiana)等。土壤类型有棕色针叶林土、灰色森林土及河滩森林土、草甸土、沼泽土等。
2 研究方法
2.1 样地选取
大兴安岭兴安落叶松林火烧后天然林典型的演替序列为火烧迹地(HS)、灌丛(GC)、白桦林(BH)、白桦落叶松混交林(BL)、落叶松林(LY),样地土壤都为棕色针叶林土。为测定不同演替阶段凋落物的分解与释放DOC的量,通过“空间代替时间”方法[22],在根河林业局管辖的林区范围内选择相应的5个演替阶段的样地作为研究对象。各样地基本情况见表1。
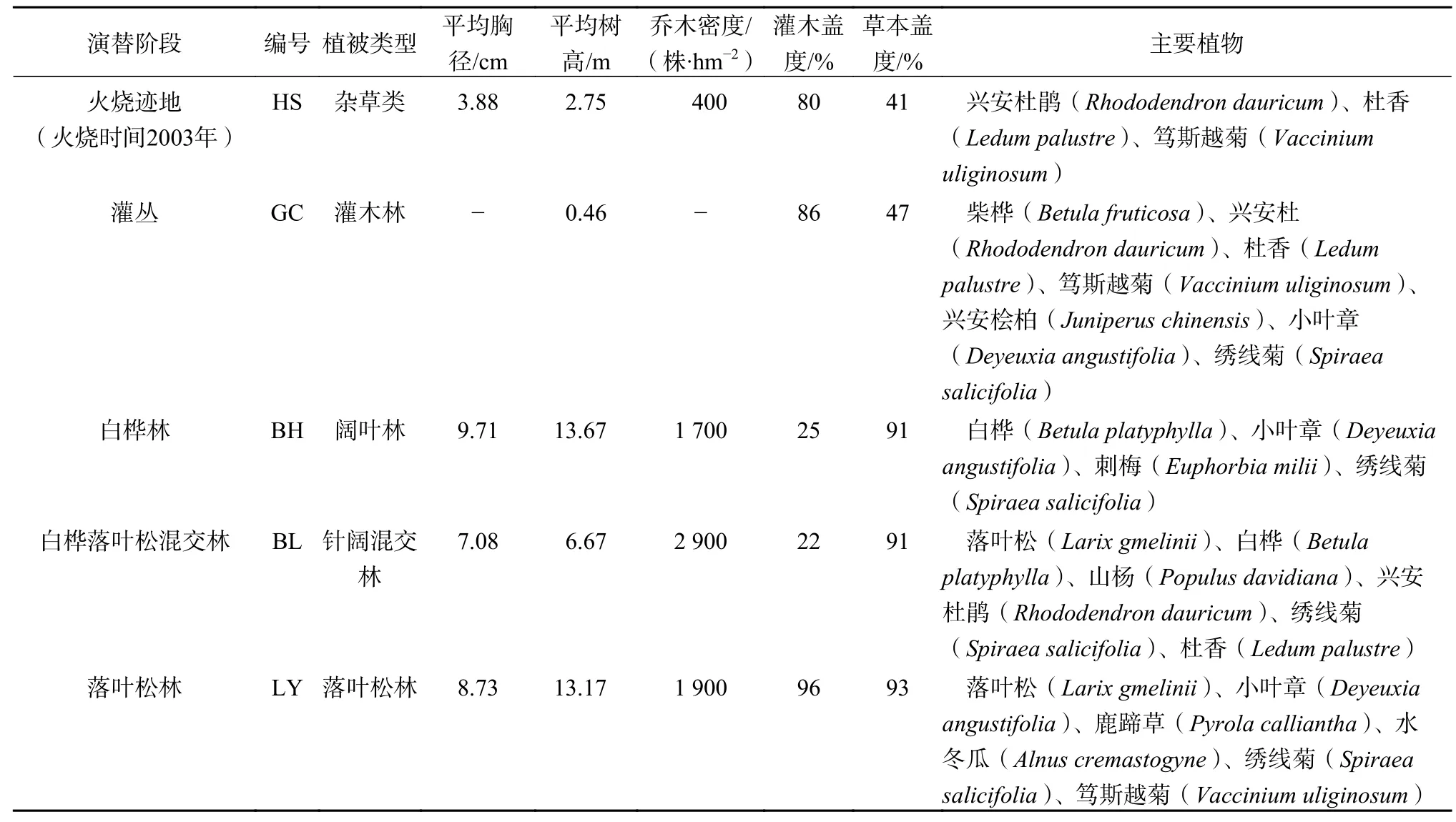
表 1 各样地基本情况和主要植被特征Table 1 Basic conditions and main vegetation characteristics in each plot
2.2 凋落物采样
每个样地通过“Z”型分3个带采取土样,上下2带各3个样点,中间带1个样点,共7个土壤采样点。3个带间距为50 m,上下2带中样点距离也为50 m。每个样点取30 cm×30 cm的凋落物,共计取35块凋落物,在确保凋落物完整的情况下带回实验室,进行分层处理。凋落物共分3层:最上层为未分解层(L层),中间层为发酵层(F层),最下层为腐殖质层(H层)。
2.3 凋落物分解与DOC释放试验
凋落物在分层后使其自然风干,将同一样地同层的凋落物混合均匀,分别称取20 g装入尼龙网袋(孔径为0.5 mm,大小为15 cm×10 cm)中。为测定凋落物分解和DOC释放对于温度的响应,将装好凋落物的尼龙网袋放在湿度相同(75%)的3个温度梯度12、24、36 ℃的恒温箱进行培养。培养的样品每隔15 d取出,浸泡于500 mL的蒸馏水中1 h,然后将获得的浸出液用玻璃纤维滤膜(0.45 μm)过滤,用于测定不同培养时长下的DOC含量。试验持续195 d,直到凋落物层释放的DOC浓度接近恒定为止。试验结束后,将网袋中剩余的凋落物样品在其自然风干后称质量,用于计算各凋落物样品的分解速率。凋落物分解过程中释放的DOC质量为DOC浓度乘以浸泡溶液的体积(500 mL)。
2.4 DOC浓度的测定
将获得的浸出液过滤,然后采用TELEDYNE TEKMAR TOC Torch仪器测定滤液的DOC浓度。试验样品来自5个演替序列的3层凋落物,分3个温度梯度进行培养试验,故每次测定的样品数为45个。试验持续195 d,每隔15 d测定1次DOC浓度,共测定13次,试验总计测定的样品数为585个。
2.5 分解速率计算方法
分解速率根据Olson指数衰减模型[23]计算,模型见式(1)。在应用Olson指数衰减模型时,先对公式进行自然对数转换,然后利用线性拟合得到分解速率常数k值。

式中:t为分解时间(d),Wt为分解t时长后凋落物的残留量(g),W0为凋落物的初始重量(g)。
2.6 分析方法
运用Excel 2010整理后并对凋落叶分解速率、DOC浓度进行运算,运用SPSS软件对凋落物的分解速率与凋落物在分解中释放的DOC量进行相关性分析。
3 结果与分析
3.1 凋落物分解速率变化特征
各演替阶段凋落物分解速率见表2。对于同一演替阶段,L、F、H层凋落物分解速率总体表现为随温度降低而变慢,即36 ℃凋落物分解速率>24 ℃凋落物分解速率>12 ℃凋落物分解速率。但在GC阶段,3个分层的凋落物最大的分解速率都出现在24 ℃。在LY阶段,F层在24 ℃分解速率最高,H层在12 ℃时分解速率最高。对于同一演替阶段,凋落物分解速率在3个温度梯度下总体表现为L层>F层和H层。但LY阶段H层分解速率在12 ℃时最快,F层较快,而L层最慢。
随着演替序列的进行,凋落物分解速率呈先增加后减少的趋势,但随着温度和凋落物分层的不同,分解速率最大值出现的演替阶段不同(表2)。在36 ℃时,L、F层凋落物的分解速率在BH阶段最快,而在其他阶段较慢。H层凋落物的分解速率在GC阶段最快,而在其他阶段较慢。在24 ℃时,L层、F层、H层凋落物的分解速率均在GC阶段最快,而在其他阶段较慢。在12 ℃时,L层分解速率在GC阶段最快。F层分解速率在BL阶段最慢,而H层分解速率在HS和BH阶段较慢。

表 2 各演替阶段凋落物分解速率Table 2 Litter decomposition rate in each succession stage
3.2 凋落物释放DOC的变化特征
不同温度下凋落物层释放DOC量见图1。随着温度降低,DOC的释放量总体呈下降趋势,即36 ℃时凋落物 DOC释放量>24 ℃时凋落物DOC释放量>12 ℃时凋落物DOC释放量。对于不同的凋落物分层,DOC的释放量不同,表现为L层>F层和H层。随着森林演替,L、F、H各凋落物层总体表现为先增加后降低的趋势,但DOC的最大释放量随着温度的不同有一定的差异。当温度为36 ℃和12 ℃时,在BH阶段DOC释放量最大。当温度为24 ℃时,BL阶段释放量最大。

图 1 不同温度下凋落物层释放DOC量Fig. 1 The amount of DOC released from litter layers at different temperatures
3.3 凋落物释放DOC随时间变化的特征
凋落物在培养过程中随时间变化释放DOC的动态过程见图2。所有演替阶段在3个温度培养下凋落物层随时间变化所释放的DOC浓度普遍呈现先升高后降低的趋势;L层大多在30 d达到最大值,F层和H层达到最大值较L层晚,多数在45 d时达到。培养实验进行到195 d时,各凋落物层释放的DOC浓度普遍趋于平缓,部分样品释放的DOC浓度已趋于0 mg/L。

图 2 各演替阶段凋落物分解释放DOC随时间变化趋势Fig. 2 Litter decomposition and release of DOC over time in each succession stage
在DOC浓度达到最大值前,凋落物释放的DOC浓度随着温度的升高而升高;在DOC浓度达到最大值后,凋落物释放的DOC浓度随着温度的升高下降速度加快。温度越高,各凋落物释放的DOC的浓度的最大值越大。对于不同分层的凋落物,在整个培养阶段,为L层>F层和H层。
3.4 凋落物层分解速率与DOC释放的关系
凋落物的分解速率与凋落物在分解中释放的DOC量的关系见图3。由图3可知,5个样地的凋落物的分解速率基本在0.002 5~0.005 0之间,凋落物的释放DOC量基本在20~160 mg之间。凋落物分解速率与释放DOC量的相关系数为r=0.683(P<0.01)。所以凋落物的分解速率与凋落物在分解中释放的DOC量呈极显著正相关。这表明凋落物的分解速率越快,其释放的DOC量就越多。
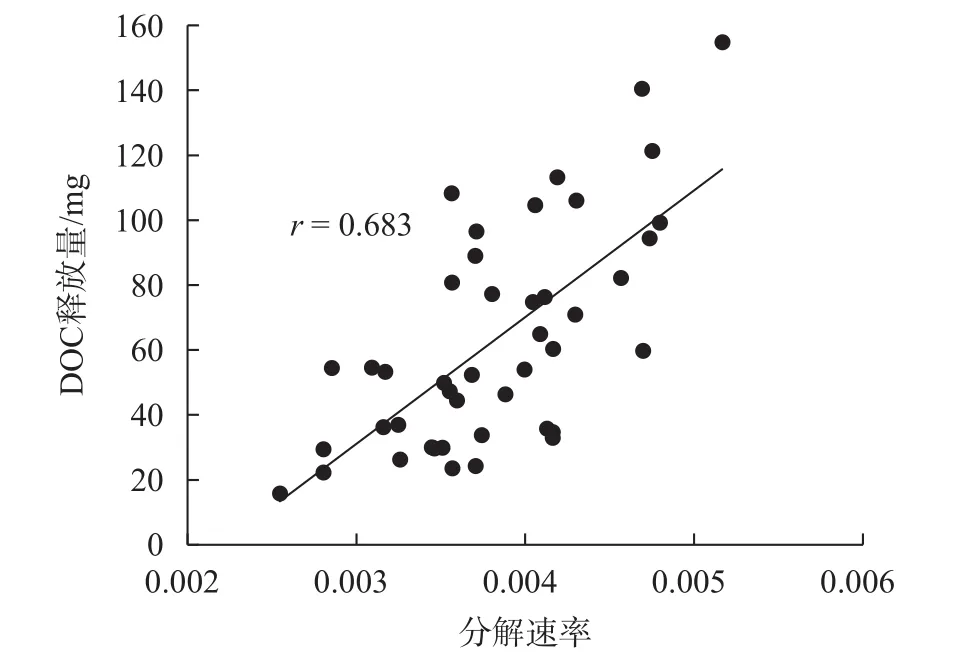
图 3 凋落物分解速率与DOC释放量相关关系Fig. 3 Correlation between litter decomposition rate and DOC release
4 结论与讨论
4.1 影响凋落物分解速率的因素
火烧后森林植被的恢复演替是一个自然过程。凋落物分解参与陆地生态系统碳循环,其分解速率是衡量凋落物分解快慢和养分循环效率的关键指标[24]。本研究采用“空间代替时间法”,研究在火烧后森林演替过程中凋落物分解速率、释放的DOC的变化以及温度和不同凋落物分层对其的影响。
研究结果表明,随着演替序列的进行,凋落物分解速率呈先增大后减小的趋势,但随着温度和凋落物分层的不同,分解速率最大值出现的演替阶段不同。大兴安岭地区森林火烧后的次生演替中,树木种类经历了由低到高再降低的过程,土壤中细菌种类相应地也有先增多后减少的动态变化[25]。出现这一变化趋势可能与凋落物种类的多样性有关,凋落物种类的多样性及土壤理化性质等决定了土壤微生物的多样性[25]。土壤微生物和土壤动物对凋落物分解贡献量分别为52%~78%和22%~48%[26]。土壤微生物较为活跃,对凋落物进行粉碎、采食,凋落物粉碎以后加大了与微生物的接触面积,加速养分的循环和流动[27]。凋落物分解速率除了受微生物因素的影响,还受其他外界因素和自身因素的影响。刘白贵等[28]的研究发现,较低的气温会减缓凋落物的淋溶速率,降低微生物和土壤动物的活性。林开敏等[29]的研究发现通常阔叶树种分解速率大于针叶凋落物分解速率。郭培培等[30]研究发现,阔叶树种凋落叶中C和木质素的含量大多比针叶树种的少,与本研究的研究结果是一致的。
在不同温度的情况下,同一演替阶段相同层的凋落物的分解速率随温度升高而加快。温度对于灌丛和落叶松林的分解速率影响并不明显,出现这一现象可能与这2个样地的凋落物的化学特性有关[17,31]。研究结果表明,在36 ℃凋落物层随演替进行分解速率的变化与牛晓燕等[25]研究大兴安岭不同森林演替阶段土壤细菌种类的数量和物种多样性的变化规律大致相似的,而在24 ℃和12 ℃情况下,有一定差异。在36 ℃分解速率与土壤微生物表现出一致性,其原因可能为温度较高的情况下,凋落物分解过程中微生物对凋落物层分解的影响占主导地位,而在温度较低情况下,其他因子的作用也表现出来,弱化了温度的主导作用。
在凋落物不同分层的情况下,凋落物分解速率的顺序为L层>F层和H层。本研究的结果与陈庆强等[32]的一致,即凋落物上层0~10 cm更新速率最高,向下层逐渐递减。凋落物层不同分层分解速率与不同凋落物层所含的凋落物成分有关:L层主要由新鲜凋落物组成,含有较多的容易分解的糖分等有机化学物质;F层所含有机物以纤维素和半纤维素为主,分解速度较慢;而H层所含物质以木质素为主,分解速度缓慢[31]。在灌丛演替阶段,F层和H层的分解速率差异并不大,可能与灌丛凋落物F层和H层所含凋落物化学成分相近有关。
4.2 影响凋落物分解释放DOC量的因素
在不同演替阶段凋落物分解释放DOC的量总体呈先增加后减小趋势。从3层凋落物总体释放量来看,BH与BL 2个样地的凋落物DOC释放量显著高于其他样地,GC与HS 2个样地的凋落物DOC释放量较低。从本研究结果看,凋落物的DOC释放量与分解速率呈正相关,这表明凋落物分解速率越快,其释放的DOC就越多。随着演替的进行,各凋落物释放的DOC都呈现先增加后减小的趋势是与其凋落物分解速率一致的。在各演替阶段,凋落物物理与化学性质发生变化,对凋落物的分解速率和DOC的释放造成一定影响。肖好燕等[33]和谌贤等[34]的研究发现,林分自身性质对凋落物分解过程中DOC的含量影响很大,林分类型通过改变凋落物的数量和质量、微生物群落的结构和活性、微生物残体和代谢产物以及根系分泌物和根系周转等因素影响了凋落物DOC的含量和空间分布[35]。本研究中的一个特殊情形是GC演替阶段,凋落物分解速度快,而DOC释放量小,这可能与GC的凋落物分解速度快,而其产生的可溶性的碳的分解速度也快有关。
随着温度降低,DOC的释放量总体呈下降趋势,即36 ℃时凋落物DOC释放量>24 ℃时凋落物DOC释放量>12 ℃时凋落物DOC释放量。这与Liechty等[36]发现一致,即在阔叶林中森林凋落物DOC通量与土壤温度呈正相关关系。温度的升高会导致土壤微生物的活性提高,凋落物的分解速率也会增大。从而凋落物释放的DOC也会增加。
不同分层凋落物DOC释放量呈现L层>F层和H层的规律,这与谌贤等[16]的研究结果一致,这是由于新鲜凋落物层中含有大量的可溶性有机物质,会释放更多的DOC[37]。新鲜凋落物层含有大量的可溶性有机物质,可直接溶解于水中形成DOC。另外,新鲜凋落物含有大量易分解化学物质,分解速率快,也会产生大量DOC[37]。凋落物中DOC与C的比率随着分解阶段的进行而逐渐降低,这表明L层DOC释放率高,而F和H层释放DOC率变小[29]。因此,L层释放的DOC量会大于F和H层。
4.3 影响凋落物分解释放DOC随时间变化的因素
凋落物在3个温度的培养下释放的DOC随时间基本表现出先升高后降低,最后趋于平稳状态的趋势。凋落物释放的DOC浓度随温度的升高而升高,L层释放的DOC大于F层和H层,DOC从凋落物中释放是受凋落物的分解来控制的。在凋落物培养的前期,凋落物中的微生物种群数量呈逐渐增加的趋势,在培养达到一定时间后其微生物数量达到饱和。在此培养前期,微生物种群数量是限制凋落物的分解和DOC的释放的因子。在培养的后期,凋落物的化学成分是凋落物分解和DOC释放的限制因素[17]。随着凋落物的不断分解,容易被微生物利用的有机物(糖类、蛋白质等)逐渐减少,难分解的大分子凋落物(纤维素、木质素等)比例增加。自然界中,只有少数微生物能产生分解大分子凋落物所需的酶,而只有当易分解的有机物缺乏时这些微生物才产生这样的酶[38]。在有机物分解过程中,凋落物中难分解的物质的比例在逐渐增加,因而导致在分解中期释放的DOC较少,在后期更少。随着温度升高,微生物活性增强,相应的有机物质分解速度快DOC释放的量也大。L层较其他层含有更多已被微生物分解的凋落物,因而分解速度更快,释放的DOC也更多。本研究中F层和H层的分解速率和DOC释放未发现有明显的差异,表明在大兴安岭林区,这2个凋落物层的化学成分相近。
4.4 室内试验与野外试验的互补性
本项研究在室内利用恒温箱控制温度和湿度条件下,每隔15 d测定1次凋落物层释放DOC的浓度。马元丹等[14]和赵晶晶等[17]采用室内试验的方法,研究了在温度与酸度控制条件下凋落物分解和DOC释放。张德强等[39]、张琴等[15]在野外天然条件下,研究了凋落物的分解。野外试验的优点是真实的自然环境,凋落物分解试验结果更接近自然状态下凋落物的分解情况。但在野外条件下,影响凋落物分解的环境因素,如温度、酸度、湿度等,无法控制,因而很难区分每个因子在分解过程中所起的作用。室内试验的缺点是控制条件下,环境因子在整个试验过程中都恒量,这与野外变化的环境条件有明显的不同,可能会导致试验结果与天然条件下有一定差异。但室内试验的优点是由于环境条件可控,因而很容易明确每个因子所起的作用。
目前大多数凋落物分解和DOC释放的试验研究都采用野外实验的方法,采用室内实验研究的较少。本研究采用室内实验的方法在控制温度与湿度条件下研究了凋落物层分解释放DOC的过程,其结果可为弄清天然森林生长与演替过程中凋落物分解与DOC释放机制方面的研究提供一定的参考。
4.5 结论
1)随森林演替,凋落物分解和DOC释放呈先升高后降低趋势,但随着温度和凋落物的不同,最大值出现的演替阶段不同。
2)除GC阶段外,凋落物分解与DOC释放的速率均随温度升高而增加,表现为36 ℃时凋落物分解速率与DOC释放量>24 ℃时凋落物分解速率与DOC释放量>12 ℃时凋落物分解速率与DOC释放量。
3)凋落物分解速率和DOC释放量表现为L层>F层和H层。
4)凋落物分解速率与分解过程中DOC的释放量呈正相关。
5)在整个培养过程中,凋落物释放DOC浓度均呈现先升高后降低,最后趋于平稳下降状态。
[ 参 考 文 献 ]
[1]Dixon R K, Solomon A M, Brown S, et al. Carbon pools and flux of global forest ecosystems [J]. Science,1994, 263(5144): 185-190.
[2]Sundquist E T. The global carbon dioxide budget [J].Science, 1993, 259(5097): 934-941.
[3]Fujii K, Uemura M, Hayakawa C, et al. Fluxes of dissolved organic carbon in two tropical forest ecosystems of East Kalimantan, Indonesia [J]. Geoderma,2009, 152(1/2): 127-136.
[4]杨君珑, 张学丽, 曹兵, 等. 宁夏罗山典型植被类型的土壤活性有机碳组分研究 [J]. 西部林业科学, 2017,46(4): 61-66.
[5]黄倩, 吴靖霆, 陈杰, 等. 土壤吸附可溶性有机碳研究进展 [J]. 土壤, 2015, 47(3): 446-452.
[6]Maisto G, de Marco A, Meola A, et al. Nutrient dynamics in litter mixtures of four Mediterranean maquis species decomposing in situ [J]. Soil Biology and Biochemistry, 2011, 43(3): 520-530.
[7]Kaiser K, Guggenberger G. The role of DOM sorption to mineral surfaces in the preservation of organic matter in soils [J]. Organic Geochemistry, 2000, 31(7/8):711-725.
[8]Berg B, Mcclaugherty C. Plant litter: decomposition,humusformation, carbon sequestration[M]. Berlin:Springer, 2008.
[9]郭剑芬, 杨玉盛, 陈光水, 等. 森林凋落物分解研究进展 [J]. 林业科学, 2006, 42(4): 93-100.
[10]Boyero L, Pearson R G, Gessner M O, et al. A global experiment suggests climate warming will not accelerate litter decomposition in streams but might reduce carbon sequestration [J]. Ecology Letters, 2011, 14(3):289-294.
[11]Cebrian J. Patterns in the fate of production in plant communities [J]. The American Naturalist, 1999,154(4): 449-468.
[12]王行, 闫鹏飞, 展鹏飞, 等. 植物质量、模拟增温及生境对凋落物分解的相对贡献 [J]. 应用生态学报,2018, 29(2): 474-482.
[13]董雄德. 温度和氮沉降驱动的凋落物分解机制[D].哈尔滨: 黑龙江大学, 2018.
[14]马元丹, 江洪, 余树全, 等. 模拟酸雨对毛竹凋落物分解的影响 [J]. 中山大学学报(自然科学版), 2010,49(2): 95-99.
[15]张琴, 范秀华. 红松阔叶林4种凋落物分解速率及其营养动态 [J]. 东北林业大学学报, 2014, 42(12):59-62, 88.
[16]谌贤, 刘洋, 邓静, 等. 川西亚高山森林凋落物不同分解阶段碳氮磷化学计量特征及种间差异 [J]. 植物研究, 2017, 37(2): 216-226.
[17]赵晶晶, 杜其霖, 国润才, 等. 模拟酸雨对大兴安岭3个树种凋落叶分解速率和溶解有机碳的影响 [J].浙江林业科技, 2017, 37(5): 10-15.
[18]Kuiters A T, Mulder W. Water-soluble organic matter in forest soils: I. Complexing properties and implications for soil equilibria [J]. Plant & Soil, 1993, 152(2):215-224.
[19]Currie W S, Aber J D. Modelling leaching as a decomposition process in humid montane forests [J]. Ecology,1997, 78(6): 1844-1860.
[20]Zhang C F, Jamieson R C, Meng F R, et al. Long-term forest-floor litter dynamics in Canada's boreal forest:Comparison of two model formulations [J]. Ecological Modelling, 2011, 222(6): 1236-1244.
[21]范跃新, 杨玉盛, 杨智杰, 等. 中亚热带常绿阔叶林不同演替阶段土壤活性有机碳含量及季节动态 [J]. 生态学报, 2013, 33(18): 5751-5759.
[22]范玮熠, 王孝安, 郭华. 黄土高原子午岭植物群落演替系列分析 [J]. 生态学报, 2006, 26(3): 706-714.
[23]Olson J S. Energy storage and the balance of producers and decomposers in ecological systems [J]. Ecology,1963, 44(2): 322-331.
[24]Taylor B R, Parkinson D, Parsons W F J. Nitrogen and lignin content as predictors of litter decay rates: a microcosm test [J]. Ecology, 1989, 70(1): 97-104.
[25]牛晓燕, 刘志强, 赵晶晶, 等. 大兴安岭森林火烧后不同演替阶段土壤细菌多样性动态 [J]. 微生物学通报,2017, 44(8): 1825-1833.
[26]武海涛, 吕宪国, 杨青, 等. 土壤动物主要生态特征与生态功能研究进展 [J]. 土壤学报, 2006, 43(2):314-323.
[27]杨民英. 基于界面结构的岩溶生态系统枯落物研究[D]. 昆明: 云南师范大学, 2017.
[28]刘白贵, 仝川, 罗榕婷. 闽江河口湿地3种主要植物冬春季枯落物分解特征 [J]. 福建师范大学学报(自然科学版), 2008, 24(2): 80-85.
[29]林开敏, 章志琴, 叶发茂, 等. 杉木人工林下杉木、楠木和木荷叶凋落物分解特征及营养元素含量变化的动态分析 [J]. 植物资源与环境学报, 2010, 19(2):34-39.
[30]郭培培, 江洪, 余树全, 等. 亚热带6种针叶和阔叶树种凋落叶分解比较 [J]. 应用与环境生物学报, 2009,15(5): 655-659.
[31]Zhang C F, Meng F R, Bhatti J S, et al. Modeling forest leaf-litter decomposition and N mineralization in litterbags, placed across Canada: A 5-model comparison [J]. Ecological Modelling, 2008, 219(3/4):342-360.
[32]陈庆强, 孙彦敏, 沈承德, 等. 华南亚热带山地土壤有机质更新特征定量研究 [J]. 地理科学, 2002, 22(2):196-201.
[33]肖好燕, 刘宝, 余再鹏, 等. 亚热带典型林分对表层和深层土壤可溶性有机碳、氮的影响 [J]. 应用生态学报, 2016, 27(4): 1031-1038.
[34]谌贤, 刘洋, 唐实玉, 等. 川西亚高山森林凋落物不同分解阶段基质质量特征 [J]. 西北植物学报, 2017,37(3): 586-594.
[35]Ashagrie Y, Zech W, Guggenberger G. Transformation of a Podocarpus falcatus dominated natural forest into a monoculture Eucalyptus globulus plantation at Munesa, Ethiopia: soil organic C, N and S dynamics in primary particle and aggregate-size fractions [J]. Agriculture, Ecosystems & Environment, 2005, 106(1):89-98.
[36]Liechty H O, Kuuseoks E, Mroz G D. Dissolved organic carbon in northern hardwood stands with differing acidic inputs and temperature regimes [J]. Journal of Environment Quality, 1995, 24(5): 927.
[37]Don A, Kalbitz K. Amounts and degradability of dissolved organic carbon from foliar litter at different decomposition stages [J]. Soil Biology and Biochemistry,2005, 37(12): 2171-2179.
[38]ChapinⅢ F S, Maston P A, Mooney H A. Principles of Terrestrial Ecosystem Ecology[M]. New York: Springer, 2002.
[39]张德强, 叶万辉, 余清发, 等. 鼎湖山演替系列中代表性森林凋落物研究 [J]. 生态学报, 2000, 20(6):938-944.

