根癌农杆菌介导山葡萄VaCBF3基因转化欧美杨111的研究
冯连荣 矫丽曼 王占斌 赵继梅 尹 杰 宋立志 梁德军
( 1. 辽宁省杨树研究所,辽宁 营口 115213;2. 东北林业大学林学院,黑龙江 哈尔滨 150040)
杨树是辽宁省平原地区的主要造林树种[1],近年来受异常气候(极端干旱、寒潮等)影响,辽宁杨树接连发生大面积灾害,其中2006年、2009年、2013年杨树灾害发生规模较大,损失严重,一些含有南方型美洲黑杨基因的杨树品种受灾较重,其中欧美杨107(Populus×euramericana cv.‘ Neva’)、 欧 美 杨 108( P.×euramericana cv.‘Guariento’)几乎全军覆没[2]。除气候因素外,树种抗逆性差是杨树发生灾害的主要内在因素,所以培育耐低温杨树品种、提高杨树抗寒性是杨树生产迫切需求。目前杨树抗寒育种主要依靠人工杂交和天然杂种选育,不仅周期长而且对提高植物抗寒性的作用不大。
近年来,大量的抗逆基因被分离,作为林木基因工程研究的模式植物[3],杨树转抗逆基因研究取得了重大进展,但关于抗寒方面的研究仍处于探索阶段,开展了一些导入单一的功能基因如拟南芥(Arabidopsis thaliana)Fe-SOD基因[4]、胡萝卜(Daucus carota)抗冻蛋白基因[5]、毛白杨(P. tomentosa)油酸去饱和酶基因FAD基因[6]和转录因子基因如拟南芥CBF1(CRT/DRE binding factor) 基 因[7]、 银 腺 杨 MBF1(multiprotein bridging factor)基因[8]的研究,这些研究均获得了阳性转基因植株,并在一定程度上提高了转基因植株的抗寒性。CBF(CRT/DRE binding factor)转录因子是一类受低温诱导的反式作用因子[9],属于AP2/ERF家族,可以与COR(cold-regulated)基因启动子中的CRT/DRE(C-repeat/dehydration responsive element)等顺式作用元件特异性结合[10],激活低温和脱水响应基因的表达,促进脯氨酸、可溶性糖类等物质的积累[11],从而提高植物的抗寒性。目前已经在陆地棉(Gossypium hirsutum)[12]、哈密大枣(Zizyphus jujuba)[13]、番茄(Lycopersicon esculentum)[14]、黄瓜(Chcumis satires)[15]、 茄 子 ( Solanum melongena)[16]、 苜蓿(Medicago sativa)[17]等植物中得到了应用。CBF转录因子基因在杨树转化上的报道还比较少,目前仅可见毛果杨CBF/DREB1基因家族生物信息分析[18]、胡杨CBF基因家族的鉴定及表达特性分析[19]及大青杨PuCBF转化烟草[20]等方面的少数报道。笔者利用RT-PCR方法克隆得到山葡萄(Vitis amurensis)CBF3(VaCBF3)基因[21]并分别构建了由组成型启动子CaMV 35S启动子和拟南芥rd29A基因启动子驱动的植物表达载体[22],确定了转化过程中抗生素使用浓度[23]。本研究通过农杆菌介导的叶盘法建立了欧美杨111(P. euramericana ‘Bellotto’)高效遗传转化体系,旨在为欧美杨111号抗寒育种及应用提供参考及扩繁材料。
1 材料与方法
1.1 材料来源
1.1.1 受体材料
欧美杨111 当年生枝条采自辽宁省杨树研究所基因库,经室内消毒、外植体接种获得无菌组培苗。组培苗培养于(25±1)℃条件下培养,光周期12 h/d,光照强度2 000~2 500 lx。
1.1.2 菌株和质粒
工程菌为根癌农杆菌(Agrobacterium tumiefaciens)LBA4404,携带有拟南芥rd29A基因启动子调控的VaCBF3基因植物表达载体质粒。质粒大小约为11.9 kb,其上携带卡那霉素抗性标记基因,见图1。

图 1 质粒图谱Fig. 1 The plasmid profile
1.1.3 培养基
遗传转化用培养基:
Ⅰ欧美杨111叶片分化培养基:MS+6-BA 0.5 mg/L+NAA 0.5 mg/L;
Ⅱ欧美杨111茎段生根培养基:1/2MS+IBA 0.4 mg/L;
Ⅲ脱菌分化培养基:MS+6-BA 0.5 mg/L+NAA 0.5 mg/L+Kan 10 mg/L;
Ⅳ选择生根培养基:1/2MS+IBA0.4 mg/L+Kan 20 mg/L+Cef 50 mg/L;
每升培养基中加蔗糖20 g,琼脂6 g,用1 mol/L NaOH调节pH至6.0~6.5,121 ℃ 0.1 MPa灭菌20 min备用。
LB液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,用5 mol/L NaOH调pH至7.0,121 ℃ 0.1 MPa灭菌20 min备用。
1.1.4 酶及生化试剂
Taq DNA Polymerase购自Thermo公司;TIANGEN DNAsecure新型植物基因组DNA提取试剂盒购自北京天根生化科技有限公司;卡那霉素购自Sigma公司;其他生化试剂均为国产分析纯。
引物序列为:
RD1 为:5′-GCAAGCTTA ACGCATGATTTGATGGAGGA-3′;
RD2 为:5′-GCTCTAGACTTTCCAATAGAAGTAATC-3′
C1 为:5′-GCGGATCTAGAATGGAATCGGAGCGT-3′;
C2 为:5′-GGCGGTACCTCAAGCTATGCATCCAAC-3′。
RD1/RD2扩增拟南芥rd29A基因启动子,片段长度945 bp;C1/C2扩增山葡萄CBF3(VaCBF3)基因,片段长度854 bp;RD1/C2扩增rd29A基因启动子+VaCBF3基因,片段长度1 799 bp。
1.2 实验方法
1.2.1 农杆菌介导目的基因遗传转化及抗性植株的获得
以欧美杨111无菌组培苗叶片为外植体,采用农杆菌介导法[24]转化山葡萄VaCBF3基因。选择完全展开、深绿色的叶片,用手术剪刀剪2~3下,剪断主脉,叶面朝上接种至培养基Ⅰ上进行预培养。于超净工作台上,将工程菌菌液(OD600≈0.5)转入至50 mL离心管中,3 000 r/min,4 ℃离心5 min,去除上清液,将收集到的菌液用LB液体培养基稀释至终浓度为OD600≈0.5,然后将预培养的叶片放入到稀释好的菌液中,侵染2~10 min,侵染期间不停的摇动,使菌液与叶片充分接触。侵染过的叶片取出后置于无菌干燥的滤纸上,吸附叶片其表面的残余菌液,然后接种到培养基Ⅰ上,25 ℃黑暗条件下共培养,当叶片边缘隐约可见菌斑时,共培养结束。将经过共培养的外植体转移到加有选择压的脱菌分化培养基Ⅲ上,25 ℃条件下进行选择培养。如果获得抗性不定芽,将抗性芽剪下继代扩繁培养。选择培养3~4周后,将抗性芽转入相应的附加选择压的分化培养基中令其生长或诱导分化。将获得的长至2~3 cm的抗性芽切下,接种到选择生根培养基Ⅳ中,进行生根筛选,培养条件同上,2周后可长出不定根。
1.2.2 不同因素对欧美杨111转化的影响
采用单因素实验设计,研究预培养时间、菌液浓度、侵染时间、共培养时间对转化的影响。转化基本条件为:外植体预培养时间为3 d,菌液浓度为OD600=0.2,侵染时间为4 min,共培养时间为3 d。以转化基本条件为基础,预培养时间设置为:1、2、3、4、5 d;菌液浓度为:0.1、0.2、0.3、0.4、0.5;侵染时间:2、4、6、8、10 min;共培养时间:1、2、3、4、5 d。每个处理侵染叶片20~31个,3次重复,使用Excel、DPS 15.0软件对数据进行整理分析。
1.2.3 抗性植株分子检测
采用天根快捷型植物DNA提取试剂盒提取抗性植株和对照植株叶片总DNA,操作步骤按说明书进行,DNA于-20 ℃下储存备用。
以提取的总DNA为模板,未转化对照植株DNA为阴性对照,质粒DNA为阳性对照,RD1/RD2和C1/C2及RD1/C2为引物进行PCR扩增。反应体系(25 μL):10×PCR Buffer 2.5 μL、dNTP(2.5 mmol/L) 2.0 μL、上游引物(10 μmol/L)0.5 μL、下游引物(10 μmol/L)0.5 μL、模板 1.0 μL、Taq 酶 0.25 μL、ddH2O 加 至 25 μL。 反 应 条 件为:94 ℃ 预变性 5 min,94 ℃ 变性 30 s,53 ℃退火30 s,72 ℃延伸45 s,72 ℃延伸10 min,反应30个循环,4 ℃终止反应。反应结束后,取6 μL反应产物经0.8%琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 不同因素对欧美杨111转化的影响
2.1.1 预培养时间
预培养时间对欧美杨111叶片分化和转化的影响,结果见图2a:随着预培养时间的增加,抗性芽率逐渐提高,预培养1 d时抗性芽率为0,可能是由于叶片的伤口还未来得及修复,农杆菌的毒害作用使叶片从伤口处迅速褐化死亡。当预培养时间为3 d时,抗性芽率达到最高12.34%,随后呈现下降趋势。原因可能是随着预培养时间的延长,叶片边缘细胞已经出现芽的分化,叶片切口快要愈合,创伤产生的酚类等vir基因诱导物减少,不利于农杆菌从伤口侵入,降低转化率。因此,在进行欧美杨111遗传转化时,预培养时间以3 d为宜。
2.1.2 菌液浓度
农杆菌的浓度和侵染时间直接影响T-DNA向植物细胞的转移几率[23]。农杆菌一般菌液浓度范围是OD600=0.1~0.5。本研究将菌液浓度分别稀释至0.1、0.2、0.3、0.4和0.5,结果见图2b:随着菌液浓度的增加,欧美杨111叶片产生的抗性芽率随之提高。当菌液浓度为0.3~0.4时,抗性率达到较大值9.68%~11.36%,随后又转为下降趋势,菌液浓度过高,菌体本身易相互凝结,不利于在外植体附着,从而降低转化率,而浓度过低时不利于基因的转入。因此,适宜于欧美杨111转化的农杆菌菌液浓度为0.3~0.4。
2.1.3 侵染时间
侵染时间的长短对影响转化效率具有一定的影响。本研究将侵染时间设置为2、4、6、8 min和10 min,结果表明:侵染时间在2~4 min之间时,欧美杨111叶片抗性芽得率较高,分别达到12.12%和19.05%,之后随着侵染时间的延长,抗性芽率逐渐降低,见图2c,可能是由于侵染时间过长,农杆菌过度繁殖、毒性过强而使外植体缺氧软腐。因此,适宜于欧美杨111转化的侵染时间为2~4 min。

图 2 不同因素与欧美杨111叶片抗性芽率的关系Fig. 2 The relationship between different factors and the rate of leaves resistant bud of P. euramericana 'Bellotto'
2.1.4 共培养时间
农杆菌与受伤部位共存16 h后才能诱发受体材料产生肿瘤,完成T-DNA完成转移和整合[24]。因此,对欧美杨111的遗传转化共培养时间必须长于16 h。本研究将预培养时间设置为1、2、3、4、5 d,分析共培养时间对欧美杨111转化的影响,结果见图2d:随着共培养时间的延长,抗性芽率增加,当共培养时间为3 d时,抗性芽率达到最大值5.26%,随后抗性芽率降低,共培养时间为5 d时,抗性芽率更是降低为0。共培养时间过长时,长时间黑暗培养导致产生白化芽,白化芽转入到选择性培养基后,叶片和芽很快死亡,无法获得抗性芽。因此,对于欧美杨111叶片的遗传转化,共培养时间在3 d时比较合适。
2.2 抗性植株的分子检测
2.2.1 抗性植株总DNA提取
提取 66株抗性植株的DNA,DNA取5 μL DNA溶液混合1 μL上样缓冲液加入到凝胶点样孔,在约5 V/cm电场中电泳,使用凝胶成像系统观察、拍照,1~21号抗性植株DNA电泳结果见图3:电泳结果显示提取的欧美杨111总DNA质量较好,条带清晰,杂质较少,虽有DNA降解,但也可以作为PCR反应的模板。

图 3 欧美杨111 DNA电泳Fig. 3 The DNA electrophoretogram of P. euramericana 'Bellotto'
2.2.2 抗性植株的PCR检测
欧美杨111抗性植株叶片总DNA经RD1/RD2、C1/C2和RD1/C2 3对引物进行PCR测,其中有4株阳性植株(图4)分别扩增出目的条带,片段大小分别约为:950、850 bp和1 800 bp。其中的1号、2号植株PCR产物检测见图5,并对1号,2号PCR扩增产物进行了测序,测序结果经过BLAST比对,与目的基因片段进行序列比对(表1),片段一致性达到了99%~100%,可以初步判断目的基因片段导入到受体材料中。

图 4 转VaCBF3基因欧美杨111抗性芽及阳性植株Fig. 4 The resistant buds and positive plants of P. euramericana 'Bellotto' with transforming VaCBF3 gene

图 5 PCR产物检测Fig. 5 Detection of PCR products
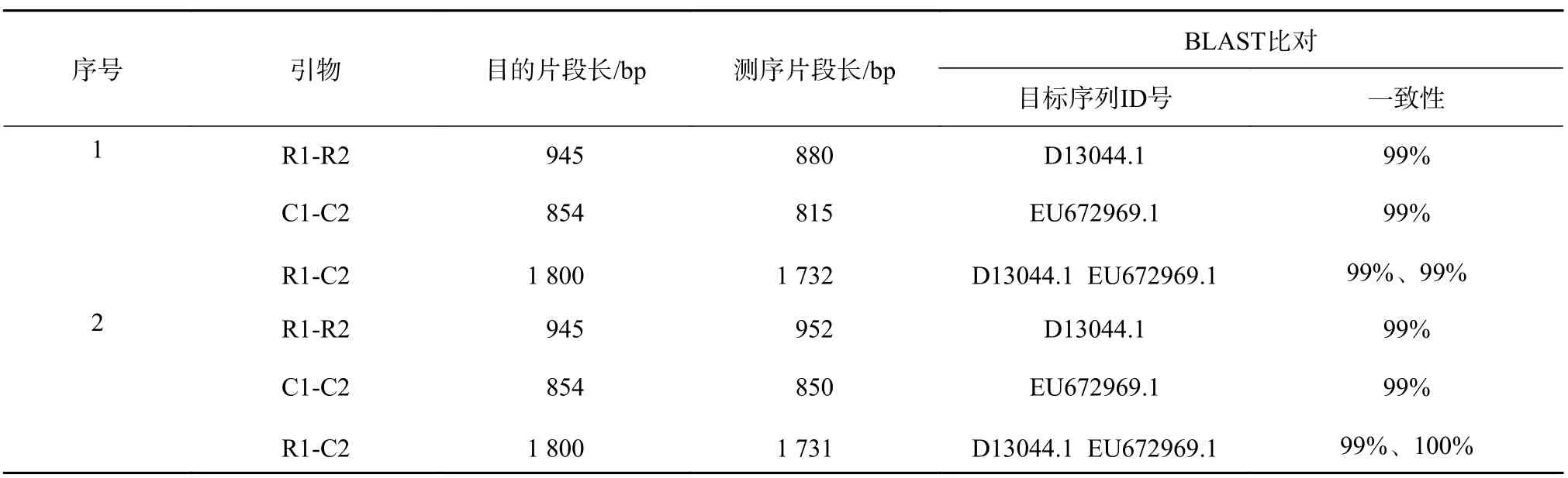
表 1 转基因1、2号植株PCR产物测序结果Table 1 The sequencing results of PCR products in transgenic plants 1 and 2
3 结论与讨论
根癌农杆菌介导的遗传转化系统,是当今杨树遗传转化的主要方法[25]。转化成功与否受杨树基因型、外植体类型、培养条件、抗生素等因素影响。建立高效的遗传转化体系,是提高转化效率的重要环节,除了确定受体材料对抗生素的敏感性,还需要筛选转化过程中适宜的预培养时间、菌液浓度、侵染时间和共培养时间等。甄成[26]研究毛果杨(P. trichocarpa)茎段最佳侵染条件为菌液浓度OD600=0.4,侵染时间为20 min,共培养时间为2 d,在侵染及共培养过程中添加80 μmol/L的乙酰丁香酮,转化率为26.7%。朱伟康[27]确定转Bt基因欧洲黑杨(P. nigra)遗传转化最佳条件为:菌液浓度OD600=0.3,侵染时间10 min,共培养时间2 d,转化率为18.0%。赵芳方[28]确定毛白杨(P. tomentosa)最佳遗传转化体系为菌液浓度OD600=1.0,侵染时间为9 min,共培养时间为25 h。孙伟博等[29]采用正交实验设计研究‘南林895杨’(P. delotides×P. euramericana cv. ‘Nanlin895’)合适的遗传转化体系为:预培养3 d,菌液浓度OD600=0.8,侵染8 min,共培养3 d。本研究采用单因素实验筛选出欧美杨111遗传转化过程中适宜的预培养时间为3 d,适宜菌液浓度为OD600≈0.3~0.4之间,适宜侵染时间为2~4 min,适宜共培养时间为3 d,转化效率为5.26%~19.05%。但本研究只是采用单因素梯度实验方法来探索预培养时间等影响转化效率的4个关键因素的最佳水平,不能确定各因素间的交互作用,还有待于进一步的优化。另外提高转化效率的另一种有效手段是在农杆菌培养、农杆菌和外植体共培养的培养基中添加vir基因诱导物,如乙酰丁香酮、羟基乙酰丁香酮等[21],其中以乙酰丁香酮效果最佳,使用较为广泛,使用浓度一般为20~200 μmol/L[20],有待于在下一步优化过程中进行尝试。
本研究利用农杆菌介导法将山葡萄VaCBF3基因导入到欧美杨111中,获得4株抗性植株,初步证明VaCBF3基因已经整合到欧美杨111基因组中。下一步需要进一步在RNA水平、蛋白水平进行分子检测,并进一步验证VaCBF3的表达水平、表达稳定性,同时通过测试电导率、丙二醛、可溶性糖等抗寒生理指标,在生理上明确VaCBF3基因对提高杨树抗寒性的作用。CBF转录因子是一个冷适应过程中的关键性调控因子,CBF的发现为基因工程改良植物耐逆性提供了一种全新的技术途径。在南方植物北移,换季节种植等基因改良品种方面具有重要应用价值。
[ 参 考 文 献 ]
[1]梁德军. 辽宁省杨树主要造林品种[M]. 沈阳: 辽宁大学出版社, 2017.
[2]刘巍, 蔄胜军, 纪纯阳, 等. 辽宁省杨树灾害发生的原因及对策 [J]. 防护林科技, 2014(6): 70-73.
[3]丁莉萍, 王宏芝, 魏建华. 杨树转基因研究进展及展望 [J]. 林业科学研究, 2016, 29(1): 124-132.
[4]Arisi A C M, Cornic G, Jouanin L, et al. Overexpression of iron superoxide dismutase in transformed poplar modifies the regulation of photosynthesis at low CO2partial pressures or following exposure to the prooxidant herbicide methyl viologen [J]. Plant Physiology, 1998, 117(2): 565-574.
[5]李春霞. 抗冻蛋白基因对山杨等植物遗传转化的研究[D]. 哈尔滨: 东北林业大学, 2003.
[6]Benedict C, Skinner J S, Meng R G, et al. The CBF1-dependent low temperature signalling pathway, regulon and increase in freeze tolerance are conserved in Populus spp. [J]. Plant, Cell and Environment, 2006,29(7): 1259-1272.
[7]周洲. 转脂肪酸去饱和酶基因PtFAD2和PtFAD3银腺杨84K的抗寒性研究[D]. 北京: 中国林业科学研究院, 2007.
[8]许东. 杨树抗寒转录因子PlMBF1b的克隆及功能分析[D]. 泰安: 山东农业大学, 2016.
[9]Stockinger E J, Gilmour S J, Thomashow M F. Arabidopsis thaliana CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE, a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit [J]. Proceedings of the National Academy of Sciences, 1997, 94(3): 1035-1040.
[10]李健, 王雅晴, 刘洋, 等. CBF转录因子在植物抗逆和生长发育中的重要功能 [J]. 植物生理学报, 2017,53(12): 2045-2056.
[11]Gilmour S J, Sebolt A M, Salazar M P, et al. Overexpression of the Arabidopsis CBF3Transcriptional activator mimics multiple biochemical changes associated with cold acclimation [J]. Plant Physiology, 2000,124(4): 1854-1865.
[12]马刘峰, 陈芸, 任羽, 等. 棉花CBF2基因克隆和超表达CBF2棉花增强抗冷性 [J]. 植物生理学报, 2018,54(2): 255-264.
[13]高启明, 王斌, 赛买提·吐尔逊, 等. 农杆菌介导的CBF基因转化哈密大枣 [J]. 北方园艺, 2016(18):94-98.
[14]王沛文, 朱文哲, 刘阳, 等. 多毛番茄冷诱导转录因子CBF1转化番茄的研究 [J]. 江苏农业科学, 2015,43(4): 30-35.
[15]谭克, 赵福顺, 吴慧杰, 等. 冷诱导基因转录因子CBF1转入黄瓜的研究 [J]. 北方园艺, 2015(9): 79-82.
[16]孟平红, 万发香, 王永清, 等. 冷诱导转录因子CBF3转化茄子的初步研究 [J]. 中国蔬菜, 2013(10): 36-43.
[17]徐春波, 王勇, 赵海霞, 等. 冷诱导转录因子AtCBF1转化紫花苜蓿的研究 [J]. 草业学报, 2012, 21(4):168-174.
[18]丁咚, 陈亚娟, 崔进荣, 等. 毛果杨 CBF/DREB1基因家族生物信息学分析 [J]. 西南农业学报, 2018, 31(3):457-461.
[19]贾会霞, 李建波, 孙佩, 等. 胡杨CBF基因家族的鉴定及表达特性分析 [J]. 分子植物育种, 2017, 15(2):492-500.
[20]姜洋. 大青杨PuCBF遗传转化基础及功能验证[D].哈尔滨: 东北林业大学, 2017.
[21]Wang Z B, Feng L R, Wang J J, et al. Vitis amuerensis CBF3gene isolation, sequence analysis and expression [J]. Agricultural Sciences in China, 2010,9(8): 1127-1132.
[22]冯连荣, 王占斌, 宋立志. 2种启动子驱动下的VaCBF3基因植物表达载体构建 [J]. 沈阳农业大学学报, 2011, 42(5): 559-564.
[23]冯连荣, 张兴芬, 尹杰, 等. 杨树农杆菌介导遗传转化中抗生素浓度的筛选 [J]. 西南林业大学学报, 2014,34(4): 31-35.
[24]王关林, 方宏筠. 植物基因工程 [M]. 2 版. 北京: 科学出版社, 2002
[25]冯连荣, 宋立志, 张妍, 等. 根癌农杆菌介导杨树遗传转化的影响因素 [J]. 西北林学院学报, 2015, 30(3):120-126.
[26]甄成. 毛果杨组培再生及遗传转化体系研究[D]. 哈尔滨: 东北林业大学, 2016.
[27]朱伟康. 转Bt基因欧洲黑杨组织培养再生体系优化及其TA29-Barnase基因遗传转化[D]. 杨凌: 西北农林科技大学, 2016
[28]赵芳方. 毛白杨再生体系的建立及Barnase基因转化的初步研究[D]. 郑州: 郑州大学, 2014.
[29]孙伟博, 于娟, 潘惠新, 等. ‘南林895杨’遗传转化体系的优化 [J]. 林业科技开发, 2013, 27(6): 85-88.

