妊娠期暴发性1型糖尿病1例报告及文献回顾
张璐瑶,杨茂光,沈 鸿,程 妍,李 沫,付希英,蔡寒青
(吉林大学第二医院 内分泌科,吉林 长春130041)
妊娠期暴发性1型糖尿病(fulminant type 1 diabetes mellitus,F1DM)往往起病急骤,多合并糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)、多脏器功能损害,病情危重,常易出现死胎等不良情况,临床诊治存在一定困难,近期我院收治妊娠期暴发性1型糖尿病1例,现将诊治情况报告如下。
1 临床资料
30岁女患,孕2产1,21岁结婚,2006年12月剖宫产1健康女婴,出生体重2.9 kg。末次月经2017年3月28日,2017年11月10日于妊娠32 3/7周因“多饮、多尿4天,呕吐、恶心伴呼吸困难19 h”急诊入院。发病前4天无明显诱因出现口渴、多饮、多尿,每日饮水量大于3000 ml,尿量相应增加,无明显多食、消瘦。入院前1天因自觉胎动减少就诊于当地医院,胎心监测未见明显异常。当地化验尿常规:尿糖3+,未在意。自行居家监测空腹指尖毛细血管血糖17.8 mmol/L,当日晚餐后随机血糖为23.0 mmol/L,仍未重视。当晚于入院19 h前出现恶心、呕吐伴呼吸困难、乏力、大汗,呕吐为胃内容物,无呕血、黑便及腹痛、腹泻,无发热,无意识障碍,再次自测随机指尖血糖达24.0 mmol/L,仍未及时就医,直至次日就诊于我院,急诊以“DKA”收入我院ICU。既往慢性支气管炎病史20年,皮肤湿疹2个月。妊娠期间产检未行75 g葡萄糖耐量试验,但自述起病前1个月内曾多次自我监测空腹及餐后2 h指尖毛细血管血糖无增高。外祖母于73岁时患2型糖尿病,母亲于57岁时患2型糖尿病,现口服二甲双胍治疗;舅父1人、姨母3人均于50余岁患2型糖尿病,家族中无耳聋病史者。
入院查体:体温36.3℃,脉搏118次/分,呼吸25次/分,血压120/75 mmHg.一般状态差,意识清,精神萎靡,平车推入病房,查体配合。全身皮肤黏膜干燥,全身散在分布红色丘疹,面色潮红,口唇无发绀。甲状腺未触及肿大,呼吸急促深大,双肺呼吸音清,未闻及干湿性啰音。心率118次/分,节律整,各瓣膜听诊区未闻及杂音。腹部膨隆,无明显压痛。四肢肌力V级,双侧巴彬斯基征阴性。辅助检查:产科三维彩超:宫内单活胎,胎儿超声孕龄约32周1天,胎儿脐带绕颈一周。急检动脉血气分析:PH 7.02,PaCO210 mmHg,PaO2148 mmHg,HCO3-<3.0 mmol/L,BE未测出,Lac 2.4 mmol/L。空腹血糖22.01 mmol/L,HbA1c 6.0%,血常规:WBC 32.3×109/L(3.5-9.5),NE 88.1%(40-75),LYM 8.4%(20-50),M 2.9%(3-10),Eos 0.2%(0.4-8.0),Bas 0.4%(0-1),RBC 5.94×1012/L(3.8-5.1),Hb168 g/L(115-150),PLT 371×1012/L(125-350)。尿常规:尿糖3+,酮体3+,潜血2+,蛋白1+。CRP 12.67 mg/L(<5.0),降钙素原0.03 ng/ml(0-0.5);血离子:K+5.62 mmol/L(3.5-5.3),Na+131.2 mmol/L(137-147),Cl-96.6 mmol/L(99-110)。血淀粉酶264 U/L(35-135),脂肪酶289 U/L(13-60),乳酸脱氢酶458 U/L(120-250),α-羟丁酸脱氢酶319 U/L(72-182);血脂:TG 7.63 mmol/L(0.56-1.71),TC 8.19 mmol/L(2.9-5.17),LDL-C 2.98 mmol/L(2.7-3.4),HDL-C 1.64 mmol/L(0.9-1.68)。肝功能、ANA谱正常,抗双链DNA抗体阴性。血肌酐102 μmol/L(41-73),尿素氮9.74 mmol/L(2.6-7.5),血尿酸672 μmol/L(89-375)。心肌损伤标志物:肌钙蛋白 0.01 ng/ml(0-0.03),肌红蛋白208.20 ng/mL(14.3-65.8),肌酸激酶同工酶7.10 ng/mL(0.6-6.3);B型钠尿肽82 pg/ml(0-100)。临床诊断为“暴发性1型糖尿病、糖尿病酮症酸中毒、电解质紊乱-低钠、低氯、高钾血症”,给予患者积极静脉补液、胰岛素降糖、纠酸及对症支持治疗,患者上述症状明显好转,4天后转入内分泌科改为皮下胰岛素泵(门冬胰岛素)治疗,后复查血常规、尿常规、血淀粉酶、脂肪酶、肌红蛋白、肌酸激酶同工酶、血离子等各指标逐渐恢复正常。甲功正常,Tg、TgAb、TPOAb均阴性。1周后血糖平稳后评估胰岛功能:空腹C肽0.15 ng/mL(0.5-3.8),餐后1 hC肽0.16 ng/mL,餐后2hC肽0.17 ng/mL;胰岛相关自身抗体:IAA、ICA、GAD、IA-2Ab、ZnT8均阴性。出院后患者继续使用胰岛素泵,至临产前日胰岛素剂量为基础量24U,三餐前大剂量分别为早12U午10U晚12U,随访孕期血糖控制良好,每周两次胎心监护评分在8-10分,彩超示胎儿发育良好,2017年12月15日孕37 3/7周时于我院经剖宫产娩出一男性活婴,出生体重3180g。新生儿出生1 min后Apgar评分9分,出生5 min后Apgar评分10分,分娩后胰岛素剂量随即下调为基础量6U,三餐前剂量分别为2U-2U-2U。产后6周随访,FPG 11.14 mmol/L,HbA1c 6.6%,复测空腹C肽0.24 ng/mL,餐后1 h C肽0.32 ng/mL,餐后2 h C肽0.32 ng/mL。调整胰岛素泵基础率至10U/d,餐前量4-6U/餐。产后18周再次复查血糖控制良好(见图1,表1),但胰岛功能进一步减退(见表1),复测IAA、ICA、GAD、IA-2Ab、ZnT8仍均阴性,已自行调整胰岛素泵基础率8U,餐前量4-5U/餐。
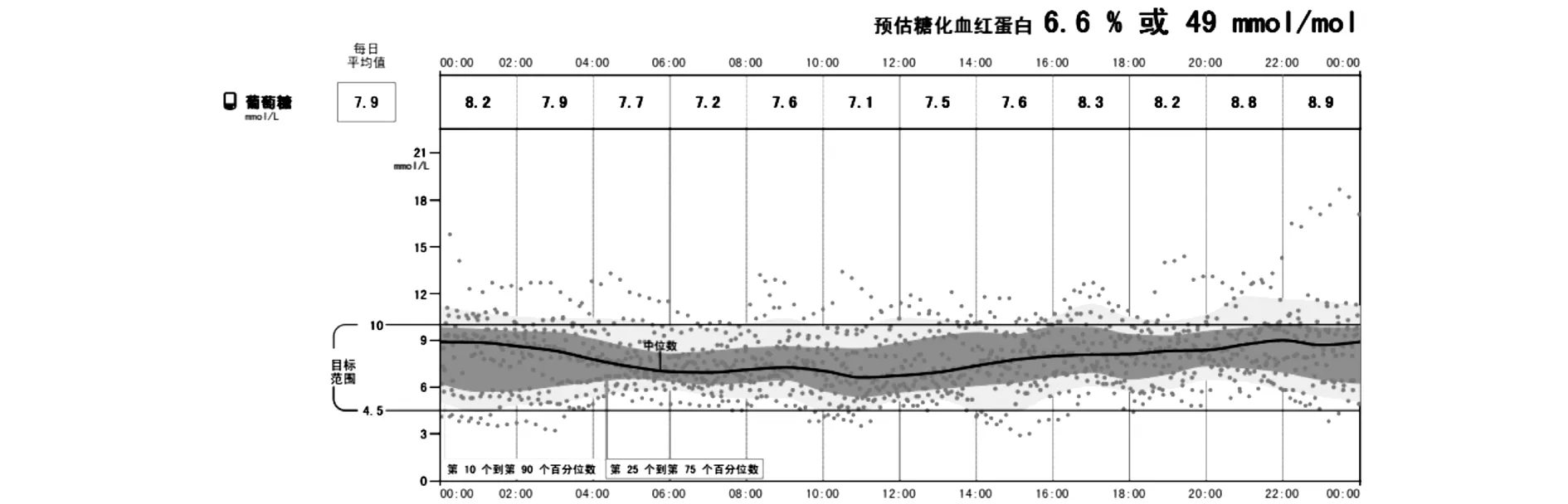
图1 产后18周时动态血糖持续监测情况
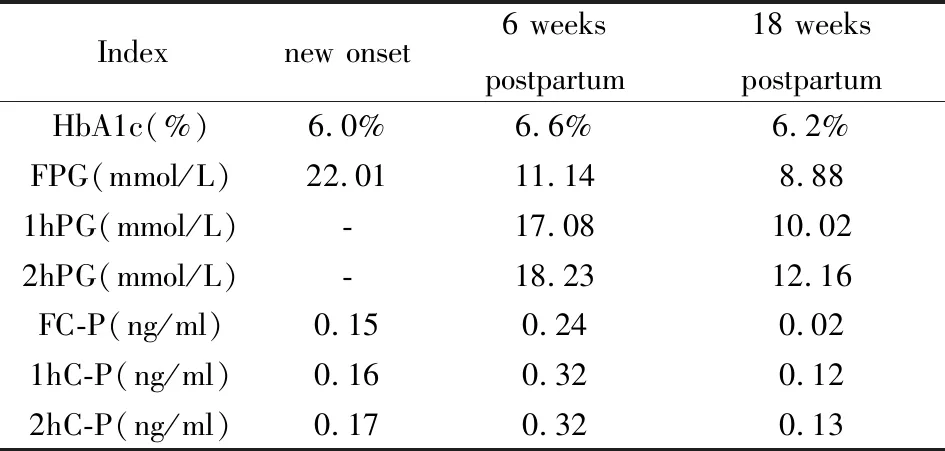
表1 起病时及产后6周和18周血糖及胰岛功能情况
2 讨论
暴发性1型糖尿病是一种特发性1型糖尿病亚型(1B型糖尿病),胰岛β细胞病理生理变化特征为超急性、完全不可逆性破坏,临床表现为血糖短时间内快速升高,并迅速发展为糖尿病酮症酸中毒,病情严重,患者存活率低,容易误诊,是内分泌疾病中罕见发病的急危重症。这一疾病最早由Imagawa在2000年发现[1];在日本,F1DM的患者人数占T1DM酮症酸中毒或酮症20%左右[2];在妊娠期间发生的T1DM几乎均可确诊为F1DM[3-5],妊娠中晚期以及分娩后两周内是发生F1DM的危险期,因此也被称为与妊娠相关的F1DM (Pregnancy-associated Fulminant type 1 diabetes,PF)。流产、早产、胎死宫内等是妊娠期暴发1型糖尿病胎儿常见的不良严重结局[6,7]。
目前该病的发病机制尚未明确,但现阶段较多学者认为该病的发病机制可能与遗传易感性、病毒感染、免疫功能以及妊娠等因素有关。有研究表明[8],该疾病的发生与病毒感染和遗传易感性相关,F1DM的发生是建立在遗传基础上,而病毒感染是导致该疾病发生的诱因。Imagawa和Ikegami[9]对207例F1DM患者进行研究表明,有32.6%的患者DRB1*04:05- DQB1*04:01基础表达水平异常,明显高于健康对照组的14.2%(OR=2.917)。F1DM患者也可能合并有其他自身免疫系统相关疾病,Wang等[10]研究表明在F1DM患者的血清中检测到GAD抗原反应T细胞表达水平升高,这一研究结果表明F1DM患者存在细胞免疫功能异常。
目前国际上多采用日本学者Imagawa提出的诊断标准[11]:(1)糖代谢紊乱1周后进展为糖尿病酮症或酮症酸中毒;(2)初诊时血糖水平≥16 mmol/L且 HbA1C <8.7%;(3)尿C肽<10 μg/dL或空腹C肽<0.1 nmol/L(0.3 ng/mL)、胰高血糖素兴奋后或进食后C肽<0.17 nmol/L(0.5 ng/mL)。符合以上标准即可诊断为暴发性1型糖尿病,若患者符合(2)、(3)标准且病程不超过1周,可高度怀疑患者为暴发性1型糖尿病。其他临床特征包括:胰岛相关抗体为阴性;起病前可发生发热、上呼吸道感染、消化道症状等前驱症状;出现胰淀粉酶、转氨酶升高;本病好发于妊娠期或分娩期;患者胰岛功能较差;可出现横纹肌溶解;肾脏损害等。
本病例为青年女性,于妊娠32周余急性起病,否认糖尿病病史,妊娠期虽未行OGTT筛查,但发病前1个月内曾多次自测空腹血糖及餐后2 h的指尖毛细血管血糖均在正常范围内。出现口渴、多饮、多尿症状后4天即迅速发展成为糖尿病酮症酸中毒,入院后测空腹血糖22.01 mmol/L,但HbA1c仅为6.0%,补充检查发现胰岛自身抗体IAA、ICA、GAD、IA-2Ab、ZnT8、ICA-IGg均为阴性,而胰岛功能极差。该患起病前无明显胃肠功能紊乱及上呼吸道感染病史,但有皮肤湿疹病史2个月,考虑可能与F1DM起病可能有关。该患有明确的2型糖尿病家族史,据统计暴发性1型糖尿病患者中约1/160有1型糖尿病家族史,约25/119有2型糖尿病家族史[2]。此外妊娠期合并F1DM者,若发展为DKA,其死胎率要明显高于糖尿病妊娠并发酮症酸中毒者[12],一旦确诊,需终身使用胰岛素治疗,本例经及时救治并长期胰岛素泵强化治疗,患者最终剖宫产1健康男活婴,预后较好。产后随访,血糖始终控制理想,但胰岛功能仅短期略有改善,产后18周进一步下降,复测胰岛自身抗体始终阴性,符合F1DM临床诊断。通过该例妊娠期F1DM诊治经过,提示临床要注意识别这种特殊类型糖尿病的发生,及时诊断、积极治疗可改善母婴预后。

