自然发酵驼乳对乙醇诱导的小鼠急性肝损伤的保护作用
乔向宇,明 亮,伊 丽,何 静,吉日木图,2,*
(1.内蒙古农业大学,乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;2.内蒙古骆驼研究院,内蒙古阿拉善 750306)
急性酒精性肝损伤是酒精性肝病(Alcoholic Liver Disease,ALD)的早期发病形式,ALD的疾病谱包含单纯的脂肪变性、酒精性脂肪性肝炎、酒精性肝纤维化、酒精性肝硬化以及肝细胞癌,这些病理变化能够单独存在顺序发生,也可以同时存在或部分重叠[1]。一项基于全球2800万人的流行病学调查结果显示,饮酒是导致死亡(早逝)和伤残调整寿命年(DALYs)的主要风险因素。2016年,全球有约280万人因饮酒死亡,其中我国因饮酒导致的死亡人数就占其中的四分之一,远远高于其他国家[2]。细胞受损,炎症应答,氧化应激[3],肠道内微生态失调[4]被认为是影响酒精性肝损伤的关键因素。
近年来,有研究者利用从自然发酵驼乳中分离的乳酸菌发酵鲜驼乳以及鲜牛乳,通过体外测定抗氧化能力发现,发酵驼乳具有更强的自由基清除能力,且抗氧化能力显著高于发酵牛乳[5]。通过对益生菌的研究发现,其能够用于预防和治疗与肠道细菌产物相关和肠道泄露相关的疾病,其中,鼠李糖乳酸杆菌已经成功地应用于治疗酒精诱导的大鼠肝损伤[6]。自然发酵驼乳中蕴含丰富的乳酸菌资源,在保护乙醇诱导的肝损伤方面还未有研究报道。
本实验研究自然发酵驼乳对乙醇诱导的小鼠急性肝损伤的保护作用,并从机体炎症应答水平、肝脏氧化应激程度和脂肪变性三方面初步探讨其发挥作用的机制,为进一步开发利用自然发酵驼乳提供实验依据。
1 材料与方法
1.1 材料与仪器
SPF级CD-1(ICR)小鼠 雄性,体重(21~23) g,许可证号:SCXK(京)2016-0006,饲养于本实验室IVC动物实验系统内,环境温度(22±2) ℃,湿度50%~60%,小鼠自由进食和饮水,昼夜交替周期为12 h 北京维通利华实验动物技术有限公司;自然发酵驼乳 内蒙古自治区巴彦淖尔市所属的牧区;天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)测定试剂盒 北京九强生物技术股份有限公司;肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-1β(Interleukin-1β,IL-1β)、丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、甘油三酯(Triglyceride,TG)、总胆固醇(Total Cholesterol,TC)等ELISA测定试剂盒 上海酶联生物科技有限公司;95%乙醇溶液(AR)、石蜡、甲醛、二甲苯、无水乙醇、氨水 上海国药集团;苏木素、伊红 BASO公司;中性树脂 北京索莱宝公司。
ZJ-4IVC动物实验系统 苏州冯氏实验动物设备有限公司;2014-181Ab真空冷冻干燥机 上海东富龙科技股份有限公司;5810R台式高速冷冻离心机 Eppendorf;3100全自动生化分析仪 Hitachi;Bead Ruptor12组织研磨匀浆仪 Omni;SynergyH1多功能微孔板检测仪 BioTek;SQ2125石蜡切片机 Leica;PPTHK-21B摊片机 Leica;DS-Ri2显微图象分析系统 Nikon;GHP-9270隔水式恒温培养箱 上海一恒科学仪器有限公司;DK-8AX电热恒温水槽 上海一恒科学仪器有限公司;FE28台式pH计 Mettler;各型号微量加样器 Eppendorf。
1.2 实验方法
1.2.1 自然发酵驼乳的处理 本实验所用自然发酵驼乳采自内蒙古自治区巴彦淖尔市所属的牧区。新鲜驼乳经采集、简单过滤后,65 ℃加热30 min,并与约3%发酵好的自然发酵驼乳(老酸奶)混合均匀后敞口放置于环境中,自然发酵3 d之后采集样品,样品置于4 ℃冰盒中运送至实验室。经测,自然发酵驼乳的滴定酸度为77.3 °T,pH为5.13。样品经离心脱脂(3500 r/min,40 min)后,真空冷冻干燥成粉,存放于-20 ℃备用。
1.2.2 动物分组、给药以及造模 24只ICR小鼠待其体重增长到(38±4) g时,随机分为3组(每组8只),即正常组(NC)、模型组(MC)、自然发酵驼乳组(FCM)。NC组和MC组每日灌胃0.3 mL灭菌ddH2O;FCM组每日灌胃脱脂自然发酵驼乳粉溶液,按照6 g/kg(BW)的剂量计算并称取自然发酵驼乳粉,溶于0.3 mL灭菌ddH2O中进行灌胃。每日灌胃2次,连续灌胃2周。造模最后一次灌胃结束后,禁食不禁水6 h,分3次按照总剂量为7.3 g/kg剂量灌胃体积分数为50%的酒精溶液进行造模,间隔1 h(见图1)[7-9]。酒精灌胃结束后继续禁食不禁水6 h,经异氟烷麻醉取血后,颈椎脱臼法处死小鼠进行取材。
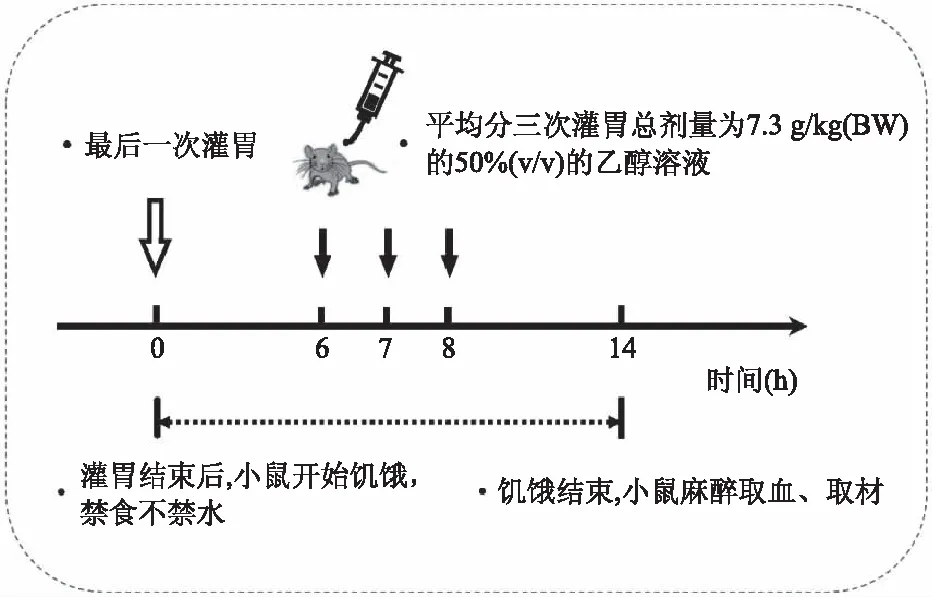
图1 造模流程图
1.2.3 体重及脏器指数的测定 小鼠麻醉前,称取体质量,取材后准确称取小鼠肝脏湿重,按照下述公式计算肝脏指数:

1.2.4 血清指标(ALT、AST、TNF-α、IL-1β以及IL-6)的检测 小鼠眼眶采血后,常温下静置4~6 h后离心分离血清(4 ℃,3000 r/min,20 min),用全自动生化分析仪测定血清中ALT和AST的活性,按照ELISA试剂盒说明书测定血清中TNF-α、IL-1β以及IL-6的含量。
1.2.5 肝组织相关指标的检测 取约0.100 g肝组织,按照肝组织∶PBS=1∶9 (m/m)加入预冷的PBS(pH7.4),置于匀浆仪上进行冰浴匀浆,匀浆速度2.90 m/s,匀浆时间15 s。匀浆完毕后离心(4 ℃,3000 r/min,20 min)收集上清备用。上清液按照ELISA试剂盒说明书检测小鼠肝脏组织中MDA、SOD、GSH-Px、以及TG和TC的含量和活性。
1.2.6 肝脏组织病理学检测 肝组织制作石蜡切片进行HE染色:将新鲜的肝脏左叶组织边缘部分切除,PBS冲洗后,将中央均匀的组织切分为1.5 cm×1.5 cm×0.3 cm大小的组织块,置于4%多聚甲醛溶液(PFA)中固定48 h。固定后的组织用PBS冲洗,去除残留的固定液和杂质。依次用50%、70%、85%、95%以及无水乙醇进行梯度脱水,每个浓度下脱水2 h。脱水的组织经2次二甲苯透明、3次浸蜡后进行石蜡包埋。将石蜡包埋的组织块制作为4~7 μm厚的石蜡切片,切片经脱蜡、脱水后进行HE染色,切片透明后用中性树脂封片。
1.3 数据处理

2 结果与分析
2.1 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏指数和肝功指标的影响
表1的结果显示,与对照组比较,模型组的ALT和AST水平极显著增加(p<0.01),表明模型组的肝细胞受损,模型建立成功。模型组的肝脏指数较正常组有增大的趋势,但是差异不显著(p>0.05)。与模型组相比,自然发酵驼乳组的ALT水平显著下降(p<0.05),AST具有下降趋势,但没有显著性差异(p>0.05)。自然发酵驼乳组的肝指数低于模型组,但是高于对照组,三组之间均没有显著性差异。
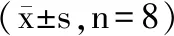
表1 小鼠体重,肝脏指数及肝功指标Table 1 Mouse body weight,liver index and serum
2.2 自然发酵驼乳对急性酒精性肝损伤小鼠机体炎症反应的影响
图2的结果显示,与对照组比较,模型组小鼠血清中的TNF-α、IL-1β以及IL-6的含量均显著高于对照组(p<0.05或p<0.01),其中IL-1β和IL-6具有极显著差异(p<0.01)。与模型组相比,自然发酵驼乳组小鼠TNF-α、IL-1β以及IL-6的含量极显著降低(p<0.01)。此外,自然发酵驼乳组上述三个指标的含量与正常组相比,均没有显著差异(p>0.05)。

图2 自然发酵驼乳对急性酒精性肝损伤小鼠体内炎症反应的影响
2.3 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏MDA含量和SOD、GSH-Px活性的影响
表2的结果显示,模型组肝脏内的MDA含量极显著高于正常组(p<0.01),这表明短时间内灌胃大量酒精后,小鼠肝脏内的脂质过氧化程度增加;而自然发酵驼乳组的MDA含量与模型组相比,显著降低(p<0.05),这说明灌胃自然发酵驼乳能够改善因单次大量饮酒所致的肝脏氧化应激水平的增加,能够显著降低肝脏内的氧化应激水平。与正常组比较,模型组小鼠肝脏内SOD的含量显著降低(p<0.05),这可能是肝脏内氧化应激迅速增加,消耗了肝脏中发挥抗氧化作用的SOD所致;与模型组相比,灌胃了自然发酵驼乳组的小鼠体内SOD活性则显著增加(p<0.05)。自然发酵驼乳组GSH-Px的酶活显著高于模型组(p<0.05),模型组中的含量低于正常组,但差异不显著(p>0.05)。上述实验结果与Soleymanzadeh等[5]的实验结果一致,说明自然发酵驼乳具有抗氧化作用。
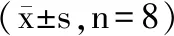
表2 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏MDA含量、SOD和GSH-Px活性的影响Table 2 Effects of naturally fermented camel milk on liver MDA contents,SOD and GSH-Px activities in acute alcoholic liver injury
2.4 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏TG和TC的影响
由图3可以得出,模型组小鼠肝脏中TG和TC的含量极显著升高(p<0.01),这说明在肝细胞中有脂质的积累,这符合急性酒精性肝损伤早期的发病特征[10]。自然发酵驼乳组小鼠肝脏中的TG含量则极显著降低(p<0.01),并且接近于正常水平;TC的含量有降低的趋势但差异不显著(p>0.05)。该实验结果说明,灌胃了自然发酵驼乳后,能够有效缓解短时间内大量饮酒所致的脂质在肝脏中的堆积情况。

图3 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏TG和TC的影响
2.5 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏组织病理学的影响
如图4所示,光镜下可见,正常组小鼠肝细胞排列较为整齐,肝小叶结构完整,未见明显炎症细胞(A);模型组肝细胞排列紊乱,具有明显水肿现象,有大量炎症细胞浸润(图中以箭头标注),发生轻度脂肪变性(B);自然发酵驼乳组肝细胞排列较为整齐,无见明显水肿现象,炎症细胞浸润明显减少,脂肪变性程度减轻(C)。
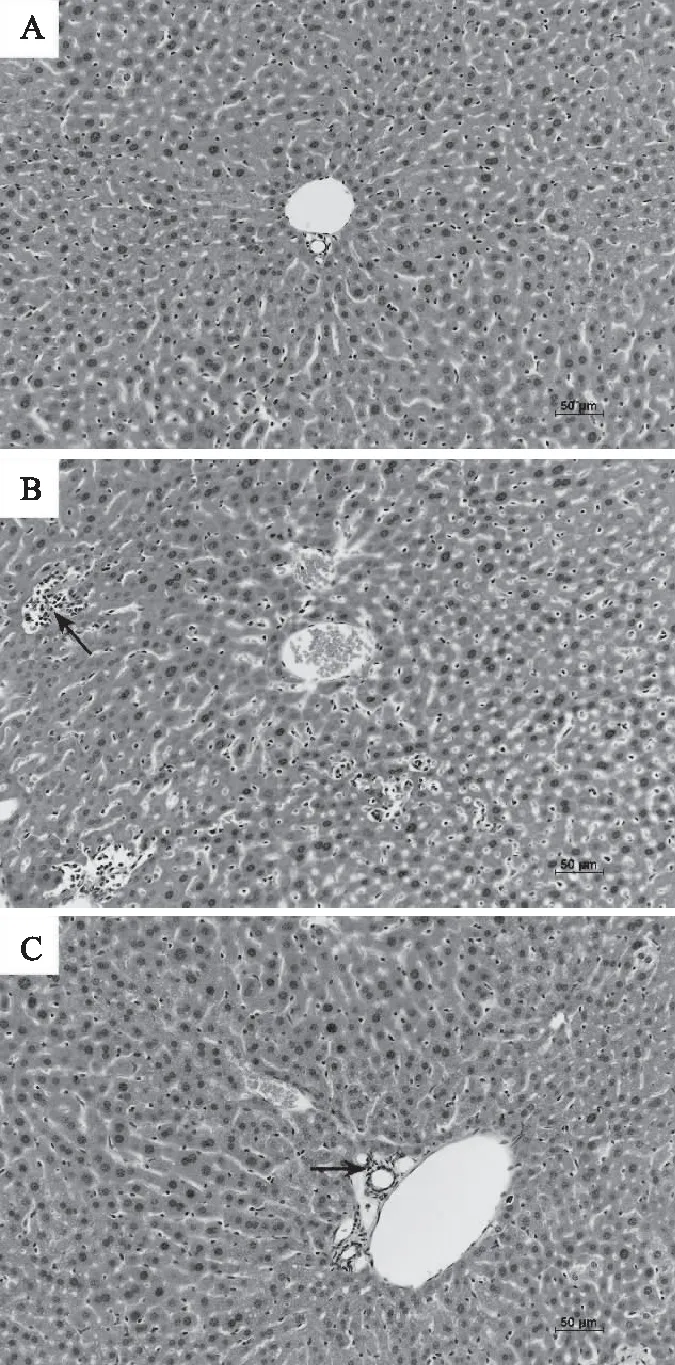
图4 自然发酵驼乳对急性酒精性肝损伤小鼠肝脏组织病理学的影响(HE,200×)
3 讨论与结论
自然发酵驼乳是指以新鲜驼乳为原料,经乳酸菌和酵母菌等微生物共同自然发酵形成的酸性(主要是乳酸)含乳饮料[11]。具有很高的营养价值和保健功效,主要流行于非洲、阿拉伯国家、中亚、印度、蒙古国以及我国的新疆、内蒙古等地区[12],并深受当地居民喜爱。
早前报道,抗生素或者益生菌的施用能够降低乙醇喂养的大鼠肝脏病变的严重程度[13-14]。自然发酵驼乳中益生菌种类丰富、数量巨大。张哲等[15]基于16S rRNA序列分析以及PacBio SMRT测序技术对内蒙古阿拉善盟传统发酵乳制品进行研究,从中分离到8株乳酸菌和5株酵母菌,其中乳杆菌为优势细菌属,克鲁维酵母菌属为优势真菌属。孙天松等[16]对新疆伊犁地区和蒙古国采集的发酵驼乳中乳酸菌和酵母菌进行计数发现,其中乳酸菌数为6.45×107~1.13×109CFU/mL,酵母菌数为7.75×102~4.6×107CFU/mL。此外,Forsyth等[6]发现灌胃益生菌能够预防和治疗与肠道细菌产物相关的疾病并抑制腐败菌的繁殖、增加肠道内益生菌的含量。长期灌胃益生菌数目巨大的自然发酵驼乳是否具有同样的作用,仍需进一步研究。
促炎细胞因子TNF-α以及IL-1β在ALD中发挥重要作用[17-18]。近些年的研究表明,ALD小鼠的肠道微生态平衡被打破[19-20],肠道通透性的增加使得内毒素(LPS)进入机体[21],通过与肝脏Kupffer细胞表面的TLR4(Toll-like Receptor 4)结合后,通过一系列生物化学信号级联反应[3,22]来促进上述细胞因子的释放。本实验的研究结果显示,自然发酵驼乳能够显著降低乙醇诱导的酒精性肝损伤小鼠血清中TNF-α、IL-1β以及IL-6炎症因子的含量。该结果表明,自然发酵驼乳能够逆转急性酒精性肝损伤小鼠体内的炎症应答情况,该实验结果与小鼠肝脏病理切片HE染色的结果相吻合。
氧化应激是早期ALD的关键机制之一,大量研究表明,乙醇的摄入会导致氧化应激的增加,这个过程会产生脂质过氧化产物,如丙二醛、4,4-羟基壬烯醛等[23]和自由基,如ROS和1-羟乙基自由基(HER)等,这些都是具有肝毒性的物质。但是由于生物体内有抗氧化物质(包括抗氧化酶类、非酶抗氧化剂如GSH、维生素E以及维生素C等)的存在,使得机体有一定的抗氧化和自由基清除能力。Beermann[24]等研究发现,运用乳酸菌水解乳酪蛋白,能够从中获得具有抗氧化活性的物质。乌仁图雅等[25]研究发现自然发酵驼乳能够显著降低小鼠血清、肝脏中MDA的含量,并提高肝脏、骨骼肌中T-SOD和GSH-Px活力,具有较强的抗氧化作用。本实验我们发现,自然发酵驼乳组肝脏中MDA含量显著降低(p<0.05),而SOD和GSH-Px的活性显著增加(p<0.05)。该结果说明,自然发酵驼乳能够抑制小鼠肝脏内脂质过氧化反应,并提高其抗氧化能力,改善氧化应激,进而减轻肝损伤。
此外,研究表明乙醇诱导的急性肝损伤前期氧化应激的增加,使得肝细胞内正常的脂代谢通路受到破坏[26-27],脂质在肝脏中的积累,进而发生脂肪变性。过氧化物酶体增殖物激活受体-α(Peroxisome proliferator-activated receptor-α,PPAR-α)是一种核激素受体,参与肝脏脂肪酸β氧化过程,并控制涉及脂肪转运和氧化作用等一系列基因的转录,Zn元素被认为是PPAR-α的激动剂[10]。据报道,鲜驼乳中富含Fe、Zn、Cu等微量元素,其中以Zn元素的含量最高[28]。Bahobail等[29]和Meldebekova等[30]发现鲜驼乳经过发酵后Zn元素的含量增加,从0.8 mg/100 g增加到0.99 mg/100 g[29]。本实验我们发现,自然发酵驼乳组小鼠肝脏中的TG含量明显降低(p<0.01),结合肝组织病理切片结果也可以说明,自然发酵驼乳能够减轻急性酒精性肝损伤前期的脂肪变性程度。我们推测,自然发酵驼乳中富含的Zn元素可能使其能够促进肝脏内脂肪的氧化作用,进而促进脂质的转运,并最终使得肝脏中TG的含量降低。
综上所述,本实验结果显示自然发酵驼乳能够保护小鼠肝脏免受乙醇诱导的肝损伤。这种保肝护肝作用可能是通过抑制小鼠体内的炎症反应、改善小鼠肝脏氧化应激程度以及减轻小鼠肝脏脂肪变性程度,从而使得肝脏细胞的结构和功能恢复正常来实现的。本研究的不足之处在于,未明确自然发酵驼乳中发挥保肝护肝作用的具体成分以及自然发酵驼乳中微生物的种类和构成,这两个问题有待进一步深入研究。

