普洱茶茶褐素对高糖饮食大鼠糖脂代谢关键酶及组织切片的影响
赵 丹,张婷婷,2,彭春秀,龚加顺,*
(1.云南农业大学食品科学技术学院,云南昆明 650201;2.文山学院(化学与工工程学院),云南文山 663000;3.云南农业大学园林园艺学院,云南昆明 650201)
普洱茶是我国特有的茶叶种类,最早产于我国云南省思茅地区和西双版纳地区,历史悠久,具有独特的风味和品质特征。云南普洱茶被称为历史名茶,以地理标志保护范围内的云南大叶种晒青茶为原料,并采用特定的固态发酵加工工艺制成[1]。茶叶是广受全球消费者喜爱的三大无酒精饮品之一[2]。作为一种绿色、自然、健康的饮品出现在日常生活中,同时由于茶叶具有降血脂、抗动脉硬化等保健功能受到消费者的喜爱,而茶叶中的成分也成为研究者关注的热点。其中茶叶的化学成分主要包括茶多酚、茶色素、蛋白质、茶多糖等[3]。
普洱茶茶色素主要活性成分茶褐素(Theabrownins,TB)是在普洱茶发酵过程中形成的[4],茶褐素是形成普洱茶独特口味和色泽的重要物质,具有显著的抗疲劳和降血脂效果,因此,茶褐素被认为是普洱茶重要的特征性成分。茶褐素是茶叶中以儿茶素为主的多酚类化合物氧化聚合而成的大分子水溶性色素,易溶于水,但不溶于乙醇、甲醇、乙酸乙酯、正丁醇、三氯甲烷等有机溶剂的高聚合物质[5]。茶褐素具有减肥、调节血脂异常、抗动脉粥样硬化、抗氧化等作用,在普洱熟茶中茶褐素含量平均为12%[5-12]。茶褐素含量的高低是区别普洱茶的品质的关键因素[13]。
张婷婷等[14]前期研究也发现63 d干预期结束后,与高糖模型组相比,茶褐素组能抑制高糖饮食大鼠体重、体脂的增加,不同程度地抑制了大鼠血清甘油三酯、空腹血糖的升高,尤其是高剂量茶褐素组效果显著(p<0.05),茶褐素具有抑制高糖饮食大鼠血糖升高及体重增加的功效。本研究旨在观察普洱茶茶褐素对高糖饮食大鼠糖脂代谢途径的多种关键酶活性指标及肝脏组织和胰腺组织切片的影响,为揭示普洱茶茶褐素调节糖脂代谢机制奠定基础。
1 材料与方法
1.1 材料与仪器
雄性SPF级SD大鼠60只,体重(160±20) g 昆明医科大学实验动物中心,许可证编号[SCXK(滇)K2015-0002];凤庆牌普洱茶熟茶 云南春茗茶业有限责任公司,产品标准(GB/T 14456.2-2008;生产日期:2012年);无水乙醇 天津市风船化学试剂科技有限公司;无水乙醚 天津市化学试剂三厂;马来酸罗格列酮 上海源叶生物科技有限公司;所用试剂 均为分析纯;空腹胰岛素(Fasting insulin,FINS)、丙酮酸激酶(Pyruvate kinase,PK)、葡萄糖激酶(Glucokinase,GK)、硬脂酰辅酶A脱氢酶-1(Stearoyl-CoA desaturase-1,SCD-1)、羟甲基戊二酰辅酶A(Hydroxy-methyl-glutarylcoenzymeA,HMG-COA)、激素敏感性脂肪酶(Hormone-sensitivelipase,HSL)、脂肪酸辅酶A连接酶(Fatty-acid-CoAligase,FACL)、脂肪酸合成酶(Fatty acid synthetase,FAS)、游离脂肪酸(Free fatty acids,FFA)、脂蛋白脂酶(Lipoprotein lipase,LPL)、乙酰辅酶A羧化酶(Acetyl CoA carboxylase,ACC)、肉碱棕榈酰转移酶-Ⅰ(Carnitinepalmitoyltransterase-Ⅰ,CPT-Ⅰ)、肉碱棕榈酰转移酶-Ⅱ(Carnitinepalmitoyltransterase-Ⅱ,CPT-Ⅱ)、瘦素(Leptin,LEP)、肿瘤坏死因子(Tumor necrosis factor,TNF-α)、白细胞介素-1(Interleukin-1,ILl-1)、白细胞介素-6(Interleukin-6,ILl-6)测定试剂盒 上海酶联生物科技有限公司;动物饲料 昆明医科大学动物实验中心,基础饲料主要成分为玉米、麦麸和豆粨,高糖饲料配方:85%的基础饲料,15%蔗糖。
OlympusAU5421型全自动生化仪 日本Olympus;ELX 808型酶标仪 美国伯腾公司;Forma902-80 ℃冰箱 Thermo Fisher Scientific;BS210S型电子天平 沈阳龙腾电子有限公司;RM2016型切片机 德国莱卡;KD-T型摊烤片机 浙江省金华市科迪仪器设备有限公司;OLYMPUS CHC型光学显微镜 日本OLYMPUS光学工业株式会社产品。
1.2 实验方法
1.2.1 普洱茶茶褐素的制备 普洱茶熟茶→10倍蒸馏水(95 ℃)浸提2次,每次30 min→过滤→合并滤液→减压浓缩(65 ℃,0.07 MPa)→乙醇(滤液∶无水乙醇=1∶4,V/V)醇沉6 h→离心(4000 r/min,20 min)→收集沉淀→蒸馏水溶解→真空冷冻干燥→粗茶褐素(供试样,茶褐素含量:75.3%)[12,15-16]。
1.2.2 大鼠分组及喂养方法 实验大鼠在空调动物饲养室中同室群笼喂养,自由进食和饮水,房间温度为20~25 ℃,湿度为45%~60%,12 h光照明暗交替。60只实验大鼠基础饲料适应喂养7 d后,进行称重和测定血清总胆固醇、血清甘油三酯、高密度脂蛋白、低密度脂蛋白、空腹血糖。根据体重、血清总胆固醇、血清甘油三酯、高密度脂蛋白、低密度脂蛋白、空腹血糖值无显著性差异的大鼠分成正常对照组、高糖模型组、茶褐素低、中、高剂量组及阳性(罗格列酮)对照组,每组10只大鼠,进行为期63 d的干预期。正常对照组饲喂正常饲料和饮用蒸馏水,其余各组饲喂高糖饲料和饮用15%的果糖水,其中不同剂量组按照设定的剂量每日经口灌胃茶褐素,阳性对照组每日经口灌胃罗格列酮,其他组别均给予相同剂量蒸馏水灌胃。
茶褐素灌胃剂量:龚加顺等[17]研究发现,受试物的 LD50>10 g/kg(95%可信限),属实际无毒级物质。敬明武等[18]报道茶色素的人体推荐量为每60 kg体质量2.7 g。根据“动物与人体的每千克体重剂量折算系数表”来计算大鼠灌胃的剂量,按照1、2、4倍设计低、中、高三个剂量组,即灌胃剂量为0.281、0.562、1.124 g/kg·bw[14];健康成人一次口服罗格列酮片4 mg,最大推荐剂量为每日8 mg,每日一次或分2次口服本实验选取人体最大剂量8 mg,即0.13 mg/kg·bw作为罗格列酮对照组大鼠的灌胃剂量[14]。
1.2.3 指标测定 每日观察大鼠活动情况及皮毛状况,记录动物死亡情况,每天记录大鼠的摄食量,每周称量大鼠体重。
动物喂养至63 d,禁食12 h后眼眶采血,3000 r/min低速离心机上离心15 min分离血清,吸取上清于-20 ℃保存,待测。测定血清中FINS、PK、GK、SCD-1、HMG-COA、HSL、FACL、FAS、FFA、LPL、ACC、CPT-Ⅰ、CPT-Ⅱ、LEP、TNF-α、ILl-1、ILl-6活性,严格按照上海酶联生物科技有限公司提供的大鼠酶联免疫分析试剂盒使用说明书进行。
1.2.4 肝脏和胰腺病理切片的制备 干预63 d后,大鼠脱颈椎处死,摘取新鲜胰腺和肝脏组织,肝脏组织称重后,从最大叶距边缘5 mm处取肝脏组织,并固定于10%的甲醛溶液中,脱水,石蜡包埋,切片,HE(苏木精-伊红染色)染色,电子显微镜观察[19-20]。
1.3 数据分析
统计分析及统计图制作分别在SPSS 19.0及Excel 2003上完成。计量资料以“均数±标准差”表示,所有数据先进行Grubbs检验,以排除过失误差,组间比较采用t检验,以p<0.05为有显著性差异。
2 结果与分析
2.1 普洱茶茶褐素对高糖饮食大鼠糖脂代谢关键酶活性的影响
2.1.1 FINS、HOMA-IR、HOMA-IS、HOMA-β关键指标的影响 由表1可看出,干预期63 d时,高糖模型组的FINS、HOMA-IR水平显著高于正常对照组(p<0.05),表明高糖饮食可以诱发大鼠的血清空腹胰岛素显著升高;阳性对照组、TB低、中、高剂量组与正常对照组的FINS、HOMA-IR水平均无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组与高糖模型组相比FINS分别降低18.30%、20.45%、21.62%、22.80%,在一定范围内,灌胃剂量越高,对预防高糖饮食大鼠FINS水平的升高效果越好;阳性对照组、TB低、中、高剂量组大鼠与高糖模型组相比HOMA-IR分别降低了18.26%、11.08%、18.86%、26.35%;表明大鼠饲喂高糖饲料,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可预防高糖饮食大鼠HOMA-IR水平的升高(p<0.05),且灌胃中剂量普洱茶茶褐素与灌胃罗格列酮对预防高糖饮食大鼠HOMA-IR水平升高的效果相似。

表1 普洱茶茶褐素对高糖饮食大鼠血清胰岛素关键指标的影响Table 1 Effect of TB extracted from pu-erh tea on the insulin and related index in ratswith high sugar diet
干预63 d后,高糖模型组的HOMA-IS指数显著低于正常对照组(p<0.05),TB高剂量组与正常对照组、阳性对照组和TB低、中剂量组的HOMA-IS指数相比均无显著性差异(p>0.05),阳性对照组和TB低、中、高剂量组大鼠与高糖模型组相比HOMA-IS水平分别升高了19.35%、12.90%、19.35%、32.26%;表明大鼠饲喂高糖饲料,饮用15%果糖水同时给予灌胃普洱茶茶褐素可预防高糖饮食大鼠HOMA-IS水平的降低,且灌胃中剂量普洱茶茶褐素与灌胃罗格列酮对预防高糖饮食大鼠HOMA-IS水平升高的效果相似。
干预63 d后,高糖型组的HOMA-β指数显著低于正常对照组(p<0.05);阳性对照组、TB中、高剂量组与正常对照组的HOMA-β指数相比均无显著性差异(p>0.05);阳性对照组和TB低、中、高剂量组大鼠HOMA-β水平与高糖模型组相比HOMA-β水平各升高了17.51%、4.63%、17.75%、24.15%;表明大鼠饲喂高糖饲料,饮用15%果糖水同时给予灌胃普洱茶茶褐素预防高糖饮食大鼠HOMA-β水平的降低,且灌胃中剂量普洱茶茶褐素与灌胃罗格列酮对预防高糖饮食大鼠HOMA-β水平升高的效果相似。
2.1.2 PK、GK、SCD、HMG-COA、HSL关键酶活性的影响 由表2可看出,干预63 d后,高糖模型组的PK活性显著低于正常对照组(p<0.05);阳性对照组、TB低、中、高剂量组的PK活性与正常对照组、高糖模型组相比均无显著性差(p>0.05),其中阳性对照组、TB低、中、高剂量组与高糖模型组相比PK活性分别升高了8.86%、3.47%、7.87%、18.12%,表明大鼠饲喂高糖饲料,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可增加大鼠血清的PK水平,且在一定范围内,灌胃剂量越高,对增加高糖饮食大鼠PK水平的升高效果越好。
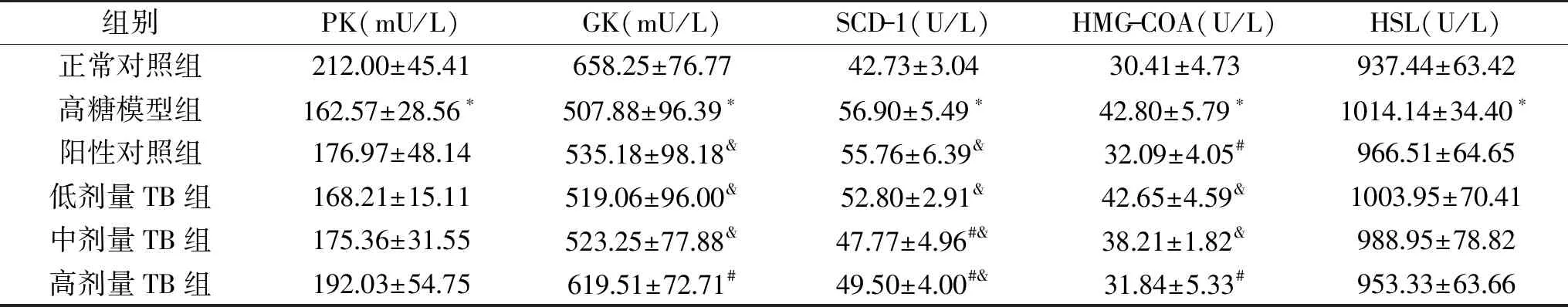
表2 普洱茶茶褐素对高糖饮食大鼠血清PK、GK、SCD、HMG-COA、HSL酶活性的影响Table 2 Effect of TB extracted from pu-erh tea on serum PK,GK,SCD,HMG-COA,HSL enzyme activity in rats with high sugar diet
干预63 d后,高糖模型组的GK活性显著低于正常对照组(p<0.05);阳性对照组、TB低、中剂量组的GK活性显著低于正常对照组(p<0.05),高剂量与正常对照无显著性差异(p>0.05);阳性对照组、TB低、中剂量组与高糖模型组相比无显著性差异(p>0.05),高剂量组显著高于高糖模型组(p<0.05),其中阳性对照组、TB低、中、高剂量组与高糖模型组相比,GK活性升高了5.38%、2.20%、3.03%、21.98%,表明大鼠饲喂高糖饲料,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可增加大鼠血清的GK水平,且在一定范围内,灌胃剂量越高,对增加高糖饮食大鼠GK水平的升高效果越好。
干预63 d后,高糖模型组的SCD-1水平显著高于正常对照组(p<0.05);TB中、高剂量组的SCD-1水平显著高于高糖模型组,并显著低于阳性对照组和高糖模型组(p<0.05);表明大鼠饲喂高糖饲料的同时给予灌胃普洱茶茶褐素可抑制SCD-1的活性,且在一定范围内,灌胃剂量越高,对抑制高糖饮食大鼠SCD-1水平的升高效果越好。
干预63 d后,高糖模型组的HMG-COA还原酶活性显著高于正常对照组(p<0.05);阳性对照组、TB高剂量组与正常对照组无显著性差异(p>0.05);阳性对照组和TB低、中、高剂量组与高糖模型组相比分别降低了25.02%、0.35%、10.72%、25.61%;表明大鼠饲喂高糖饲料,饮用15%果糖水的同时同时给予灌胃普洱茶茶褐素可抑制HMG-CoA还原酶的活性。
干预63 d后,高糖模型组的HSL水平显著高于正常对照组(p<0.05),阳性对照组、TB低、中、高剂量组大鼠的HSL水平与正常对照组和高糖模型组相比均无显著性差异(p>0.05)。
2.1.3 FACL、FAS、FFA、LPL关键酶活性的影响 由表3可知,干预63 d后,高糖模型组的FACL活性显著低于正常对照组(p<0.05);阳性对照组、TB低、中、高剂量组与正常对照组无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组显著高于高糖饮食对照组(p<0.05),分别升高了13.18%、12.73%、14.48%、15.36%,表明大鼠饲喂高糖饲料会降低大鼠血清FACL活性。
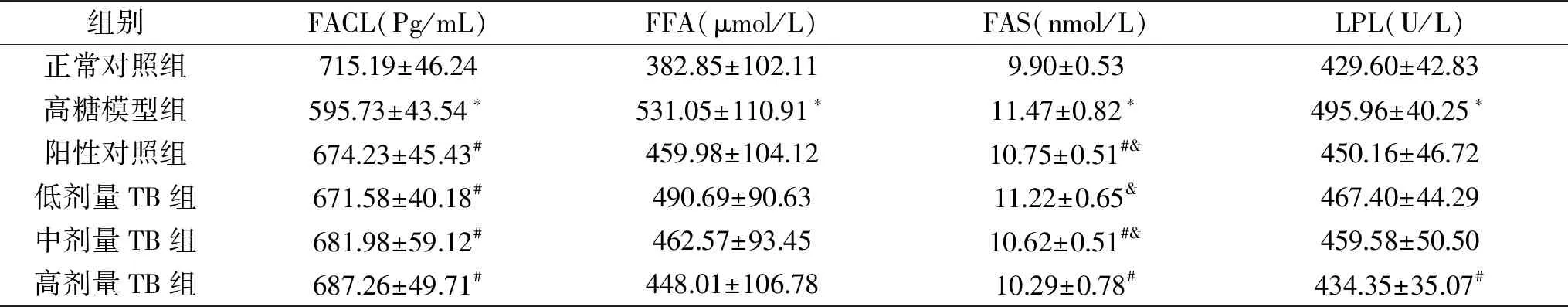
表3 普洱茶茶褐素对高糖饮食大鼠血清FACL、FAS、FFA、LPL酶活性的影响Table 3 Effect of TB extracted from pu-erh tea on serum FACL,FAS,FFA,LPL enzyme activity in rats with high sugardiet
干预63 d后,高糖模型组大鼠的FFA水平显著高于正常对照组(p<0.05);阳性对照组、TB低、中、高剂量组与正常对照组无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组与高糖模型组相比分别降低了13.38%、7.60%、12.90%、15.64%,表明大鼠饲喂高糖饲料,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可抑制大鼠血清的FFA水平。且在一定范围内,灌胃剂量越高,对抑制高糖饮食大鼠FFA水平的升高效果越好。
干预63 d后,高糖模型组大鼠的FAS、LPL活性显著高于正常对照组(p<0.05);阳性对照组、TB低、中量组FAS水平显著高于正常对照组(p<0.05),高剂量组与正常对照组无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组大鼠的FAS活性与高糖模型组相比各降低了6.28%、2.18%、7.41%、10.29%;表明大鼠饲喂高糖饲料的,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可抑制FAS的活性,且在一定范围内,灌胃剂量越高,对抑制高糖饮食大鼠FAS水平的升高效果越好。除高糖模型组外其他各组LPL水平与正常对照组无明显差异,阳性对照组、TB低、中、高剂量组大鼠的LPL活性与高糖模型组相比各降低了6.28%、2.18%、7.41%、10.29%;表明大鼠饲喂高糖饲料,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可抑制大鼠血清中LPL水平的升高。
2.1.4 LEP、ACC、CPT-Ⅰ、CPT-Ⅱ关键酶活性的影响 由表4可知,干预63 d后,高糖模型组的LEP水平显著高于正常对照组(p<0.05);阳性对照组、TB低、中、高剂量组与正常对照组无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组与高糖模型组相比分别降低了11.07%、6.58%、9.69%、12.11%;表明大鼠饲喂高糖饲料,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可抑制大鼠血清的LEP水平,且在一定范围内,灌胃剂量越高,对抑制高糖饮食大鼠LEP水平的升高效果越好。
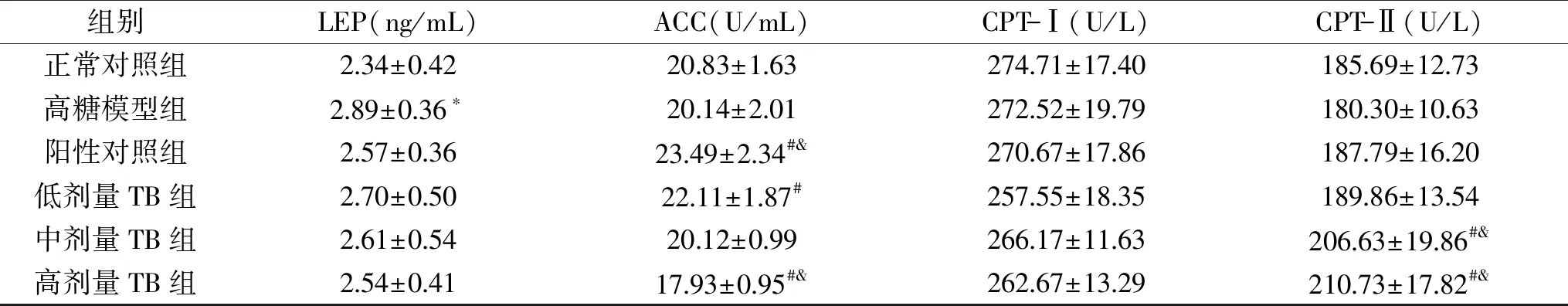
表4 普洱茶茶褐素对高糖饮食大鼠血清ACC、CPT-Ⅰ、CPT-Ⅱ、LEP酶活性的影响Table 4 Effect of TB extracted from pu-erh tea on serum ACC,CPT-Ⅰ,CPT-Ⅱ,LEP enzyme activity in rats with high sugar diet
干预63 d后,高糖模型组的ACC、CPT-Ⅰ、CPT-Ⅱ水平与正常对照组无显著性差异(p>0.05)。表明大鼠饲喂高糖饲料,同时饮用15%果糖水的对大鼠的ACC、CPT-Ⅰ、CPT-Ⅱ水平无明显影响。
2.1.5 TNF-α、IL-1β、IL-6关键炎症因子酶活性的影响 由表5可知,干预期63 d后,高糖模型组的TNF-α、IL-1β和IL-6水平均显著高于正常对照组(p<0.05)。除高糖模型组外,其余各组TNF-α水平与正常对照组均无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组与高糖模型组相比,TNF-α水平分别降低了15.94%、9.54%、11.31%、16.66%和;阳性对照组、TB中、高剂量组与正常对照组血清的IL-1β水平无显著性差异(p>0.05);阳性对照组、TB中、高剂量组与高糖模型组血清的IL-1β水平有显著性差异(p<0.05),分别降低了7.50%、6.94%、8.47%、13.30%。阳性对照组、TB低、中、高剂量组与正常对照组血清的IL-6水平无显著性差异(p>0.05);阳性对照组、TB低、中、高剂量组大鼠血清的IL-6水平与高糖模型组相比各降低了3.62%、1.39%、3.55%、4.60%;表明大鼠饲喂高糖饲料的,饮用15%果糖水的同时给予灌胃普洱茶茶褐素可抑制大鼠血清的TNF-α、IL-1β和IL-6水平。且在一定范围内,灌胃剂量越高,对抑制高糖饮食大鼠血清的TNF-α、IL-1β和IL-6水平升高效果越好。
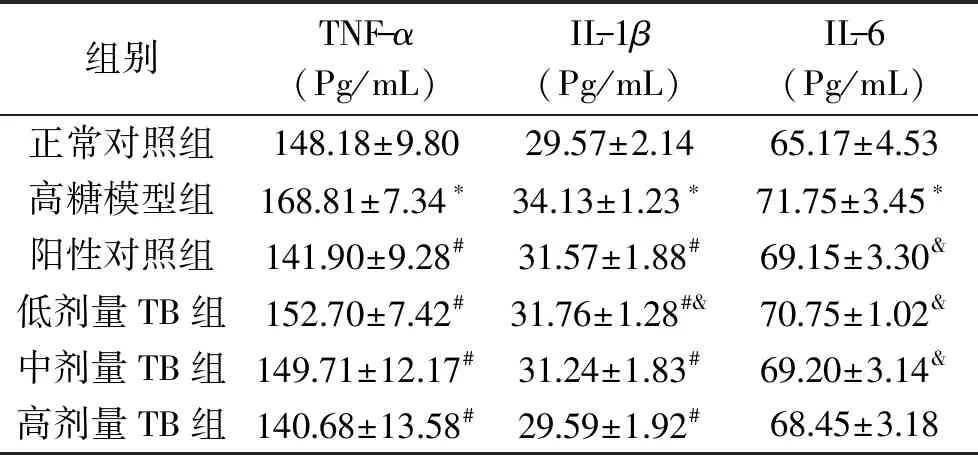
表5 普洱茶茶褐素对高糖饮食大鼠血清关键炎症因子的影响Table 5 Effect of TB extracted from pu-erh tea on the activity of serum key inflammatory factor in rats with high glucose diet
2.2 普洱茶茶褐素对高糖饮食大鼠肝脏切片的影响
由图1可看出,HE染色光镜下显示正常对照组(图1A)大鼠肝细胞围绕中央静脉呈放射状排列,形态正常;高糖模型组(图1B)大鼠肝细胞有一定病理改变,但不是很典型。说明一定条件下高糖饮食对大鼠肝脏病理性影响。灌胃不同剂量普洱茶茶褐素组(图1D、E、F),大鼠肝细胞排列整齐,形态正常。说明普洱茶茶褐素可以降低高糖饮食大鼠肝脏脂质沉积。

图1 普洱茶茶褐素对大鼠肝脏切片的影响
2.3 普洱茶茶褐素对高糖饮食大鼠胰腺切片的影响
由图2可知,HE染色光镜下显示正常对照组(图2A)胰腺腺泡及胰岛结构完好,胰岛多成圆形或椭圆形,细胞形态正常,未见炎症反应。高糖模型组(图2B)大鼠出现胰腺腺泡减少,胰岛细胞萎缩,部分胰岛形态不规则。罗格列酮对照组(图2C)胰腺腺泡略减少,部分病例胰岛细胞萎缩(2/5),部分病例胰岛细胞增生(2/5)。低剂量TB组(图2D)胰腺腺泡减少,胰岛细胞萎缩,胰岛形态不规则,近似于高糖模型组。中剂量TB组(图2E)胰腺腺泡减少,胰岛细胞萎缩,胰岛形态不规则。高剂量TB组(图2)胰腺腺泡略有减少,胰岛细胞萎缩,但胰岛形态较规则,个别病例见少量炎症细胞浸润。说明普洱茶茶褐素可以降低高糖饮食大鼠胰岛损害的程度,预防高血糖症的发生,且与剂量呈正相关。

图2 普洱茶茶褐素对大鼠胰腺切片的影响
3 结论
动物造模实验研究证实,高脂饮食模型以胆固醇升高为主[21],高糖饮食模型以TG升高为主。不同的饮食结构会对血脂的成分造成不同的影响,现今我国饮食主要以高糖为主[22],张婷婷等[14]前期研究显示,本实验动物模型TG显著升高(p<0.05),与报道一致,故高糖模型组造模成功。
在饲喂高糖饮食,饮用15%的果糖水的同时给予灌胃普洱茶茶褐素,高糖饮食条件能够增加大鼠体重、体脂、血清甘油三酯、空腹血糖的升高,能够有效抑制肾周脂肪的增加[14]。本实验研究也发现与高糖模型组相比,茶褐素能有效地抑制高糖饮食大鼠FINS、HOMA-IR、LPL、SCD-1、FAS、TNF-α、IL-1β、IL-6水平的升高;其中TB低、中、高剂量组不同程度降低HOMA-β、HSL、FFA、LEP水平,能有效增加高糖饮食大鼠GK、HMG-COA、HOMA-IS水平,增加PK、FACL水平;高糖饮食对大鼠血清ACC、CPT-Ⅰ、CPT-Ⅱ水平无显著影响(p>0.05);大鼠肝脏和胰腺HE染色后,在显微镜下观察高糖模型组都有一定程度的病变,灌胃茶褐素后能得到改善,说明普洱茶茶褐素可以降低高糖饮食大鼠肝脏脂质沉积,可以降低高糖饮食大鼠胰岛损害的程度,预防高血糖症的发生。
本实验结果为茶褐素调节糖脂代谢提供科学依据,但本次研究只局限于生理表层和关键酶活性表达方面,将来更需要通过蛋白质组学和代谢组学等实验进行对降血糖机制进一步评价分析,为茶褐素调节糖脂代谢机理提供进一步的理论帮助。

