基于氢化物原子荧光光谱法分析富硒酿酒葡萄与酿造产物中的硒
郑 宇,侯彤瑶,王宗义,*,李德美,李虎军,张竹琴,张亚东
(1.北京农学院,食品科学与工程学院,食品质量安全北京实验室,农产品有害微生物及农残安全检测与控制北京市重点实验室,北京北农葡萄酒工程技术中心,北京 102206;2.北京拓普威酿酒科技有限公司,北京 102413)
硒是一种具有抗氧化[1]、拮抗重金属[2]和抗癌[3]等多种生理功效的微量元素,硒缺乏[4-5]或过量[6]均会致病。最新调查显示,我国31%~69%的居民硒摄入量不足[7]。富硒食品是提高我国居民硒摄入量的一个重要途径。食品中硒可大体分为有机硒和无机硒,前者如硒蛋白、硒代氨基酸,后者如硒酸钠、亚硒酸钠,其中有机硒毒性低,且有更好的吸收率和利用率[8-9]。因此,硒相关检测方法的建立,对评价富硒食品的营养价值和质量安全,指导相关产品的开发具有重要意义。
目前,食品中硒的检测方法主要有氢化物发生-原子荧光光谱法(HG-AFS)、荧光分光光度法(FS)[10]、石墨炉原子吸收光谱法(GF-AAS)[11]、气相色谱法(GC)[12]和电感耦合等离子体质谱法(ICP-MS)[10,13-14],其中FS、GC法需要进行衍生,GF-AAS易在石墨炉灰化阶段造成硒损失而影响检测结果[15],应用报道较多的是HG-AFS和ICP-MS。无机硒、有机硒等形态分析,则需要高效液相色谱(HPLC)与HG-AFS、ICP-MS等进行联用解决[16-17],成本较高。对样品进行提取[18-19],HG-AFS测定无机硒,再通过总硒扣除无机硒来计算有机硒的方法较为简单,成本低,但提取液中的硒代氨基酸等有机硒能使无机硒的检出结果偏高,降低结果的可靠性。本文针对酿酒葡萄样品,拟通过优化消解还原条件和无机硒的提取分离方法,建立总硒、无机硒的检测方法,提高总硒测定的稳定性,克服硒代氨基酸对无机硒测定的干扰,并对施用富硒叶面肥的酿酒葡萄与酿造产物进行了追踪检测。
1 材料与方法
1.1 材料与仪器
三个品种的施硒肥酿酒葡萄、对照酿酒葡萄、酒渣、酒泥和成品葡萄酒 由北京拓普威葡萄酒公司采样提供,于冰箱中冷冻储存。其中美乐葡萄样品6个,对照样3个,水分含量为72.90%;品丽珠葡萄样品4个,对照样2个,水分含量74.48%;霞多丽葡萄样品1个,对照样品1个,水分含量为75.00%。各葡萄样品分别来自酒庄不同地块,花期前2次、坐果和转色期各3次施用富硒叶面肥,并于葡萄成熟期采摘;富硒叶面肥 主要成分为硒氨基酸螯合物(含有少量无机硒),安丘鑫海生物肥料有限公司;酒渣、酒泥、成品葡萄酒 来自施硒肥的美乐酿酒葡萄,其中酒渣采自酒精发酵后期,酒泥采自乳酸、苹果酸发酵后期,成品葡萄酒窖藏两个月,酒精度为14%。NaOH、NaBH4、HClO4、HNO3、HCOOH和盐酸 优级纯,国药集团化学试剂有限公司;GSB 04-1751-2004硒标准溶液(无机硒) 1000 μg/mL,国家有色金属及电子材料分析检测中心;GBW10046(GSB-24)河南小麦成分分析标准物质:硒含量为60±10 μg/kg 地球物理地球化学勘察研究所IGGE。
Cleanert PCX-SPE固相萃取柱(60 mg,3 mL) 天津博纳艾杰尔科技有限公司;AFS-9130 双道原子荧光光度计(配有AS-30自动进样系统) 北京吉天仪器有限公司;EHD 36消解炉(配有φ30 mm容积75 mL磨口玻璃带塞消解管) 北京莱伯泰科仪器股份有限公司;电热鼓风干燥箱 上海一恒科学仪器制造有限公司。
1.2 实验方法
1.2.1 葡萄样品的预处理 取500 g鲜葡萄于电热鼓风干燥箱中60 ℃烘干48~72 h至干燥恒重,同时计算初始水分含量,然后将样品粉碎,过40目筛,于玻璃封口样品瓶中4 ℃冰箱保存。
1.2.2 总硒测定的样品处理 称取干燥的葡萄试样0.5 g,解冻后的酒渣、酒泥试样1.0 g,精确至0.0001 g,于消解管中,加入HNO3-HClO4体积比为4∶1的混合酸10 mL,浸泡过夜(8~12 h),于消解仪上180 ℃带盖(有放气孔)消解至溶液无色(或清亮)透明,开盖赶酸,待冒白烟后,继续加热至溶液约为2 mL左右,取出冷却至室温,往消解管中加入3 mL 6 mol/L的盐酸,消解仪上100 ℃加热处理20 min,取出冷却,用纯水定容至10 mL容量瓶中待测。葡萄酒样品称样量为10 g,精确至0.001 g,加入混酸10 mL后,140 ℃处理2 h,升温至180 ℃进行消解,其他操作同上。
1.2.3 无机硒测定的样品处理 取0.5 g烘干的葡萄样品于50 mL离心管中,准确加水20 mL,常温下振荡浸提1 h后,10000 r/min离心10 min,上清液经玻璃棉过滤,用甲酸调节pH1~2后,取10 mL完全通过PCX固相萃取柱(3 mL甲醇,3 mL水活化),并收集于消解管中,按1.2.2葡萄酒的消解方法进行消解与还原。
1.2.4 无机硒提取溶液的选择与分离效果的验证
1.2.4.1 无机硒提取溶液的选择 取0.5 g酿酒葡萄样品添加40 μg/kg无机硒,按1.2.3的提取方法分别使用6 mol/L HCl(A)、0.1 mol/L HCl(B)、纯水(C)、0.5%(V/V)NH3·H2O(D)、0.5%(V/V)NH3·H2O-1 mol/L NH4H2PO4(39+1)(E)5种溶液进行提取,离心后,再按1.2.2葡萄酒消解方法进行消解还原,上机检测,通过W(提取率,%)=m(检测值)/M(实际添加值)×100,计算提取率。
1.2.4.2 无机硒分离效果验证 对0.5 g酿酒葡萄样品进行以下处理,分析荧光值变化。A.样品全消解(同1.2.2处理);B. 经20 mL超纯水提取1 h,10000 r/min离心10 min,取10 mL用甲酸调节pH后,过已活化的PCX柱,收集于消解管中进行消解(同1.2.3处理);C.同B提取,离心后取10 mL直接消解;D.添加40 μg/kg无机硒,同B提取,离心后取10 mL调节pH过柱消解;E. 同D添加,同B提取,离心后取10 mL直接消解;F. 添加40 μg/kg无机硒,80 μg/kg硒代氨基酸(硒代蛋氨酸与胱氨酸的混合物),同B提取,离心后取10 mL调节pH过柱消解;G.同F添加,同B提取,离心后取10 mL直接消解。
1.2.5 原子荧光分析
1.2.5.1 分析条件 载流溶液:5%(V/V)的盐酸;还原溶液:含1%(M/V)NaBH4、0.5%(M/V)NaOH的溶液;载气(Ar)流量:250 mL/min;屏蔽气(Ar)流量:800 mL/min;灯电流:120 mA;辅阴极电流:60 mA;负高压:300 V;原子化器高度:8 mm;进样体积1.0 mL。
1.2.5.2 定量检测 对浓度为0.25、0.5、1.0、2.0和4.00 μg/L的系列标准溶液(仪器自动用载流液稀释)和样品溶液、试剂空白溶液等上机检测,以荧光值对浓度做标准曲线,对样品溶液进行定量。对荧光值超出校准曲线范围的试样,将样液用载流液稀释后重新进行测定。
1.3 数据处理
使用Afs-9x系列原子荧光光度计工作站软件和Microsoft Excel 2007进行相关数据处理和t检验等统计分析。
2 结果与讨论
2.1 样品消解与还原条件的优化
预实验表明,按国标法推荐的样品量(0.5~3 g)和HNO3-HClO4用量(9+1,10 mL),酿酒葡萄样品不能消解完全,溶液浑浊且有较深颜色,需再补加混酸1~2次。苟体忠等[20]的研究显示当HNO3-HClO4体积比为2∶1时,植物样品的消解效果较佳,但后续赶酸时间过长。本实验,调整HNO3-HClO4体积比为4∶1,用量10 mL,样品消解彻底,溶液清亮,由于HNO3的相对用量减少,待赶酸至冒白烟时,恰约剩余2 mL,用时较短,较为适宜。进一步考察了消解温度,当设定温度低于170 ℃时消解速度过慢,高于190 ℃不易控制消解液体积,故本实验采用消解温度为180 ℃。此外,本实验在消解过程中于消解管上加盖(带有放气孔),混酸消解管内的回流,减少了消解液的蒸发损失。消解完成后,加入过量的盐酸,将六价硒还原为四价硒。
如图1所示,还原温度是影响测定结果稳定性的重要因素,当还原温度小于120 ℃时,测定荧光值平稳,当温度大于120 ℃,特别是将样液加热至再次冒白烟时,测定荧光值降低,这可能是硒元素形成硒挥发物损失所致[20],故本实验选择还原温度100 ℃;进一步对5~40 min还原时间进行考察,荧光值保持平稳,结果如图2所示,说明还原时间5~40 min 不影响检测结果,本实验使用还原时间为20 min。
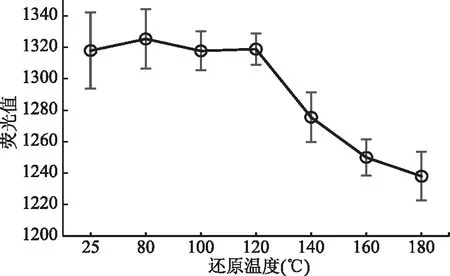
图1 还原温度对硒元素荧光值的影响
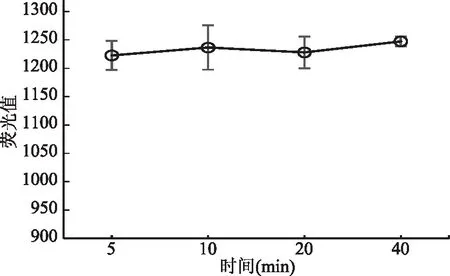
图2 还原时间对硒元素荧光值的影响
2.2 无机硒提取溶液的选择与分离效果的验证
2.2.1 无机硒提取溶液的选择 文献报道提取无机硒的溶剂有酸溶液[21]、水[22]和碱溶液[23];本文对5种提取溶剂的提取效果进行比较,计算提取率,结果见图3。提取液A、B效果较差;C、D和E的提取率均达80%以上,说明纯水和碱性溶液有更好的提取效果,再加入磷酸盐后,提取率进一步提高,这可能由于磷酸根离子参与样品基质对硒酸根、亚硒酸根离子的吸附竞争所致。本研究为更有利于后续离子交换对无机硒进行分离,选用纯水做提取溶剂。
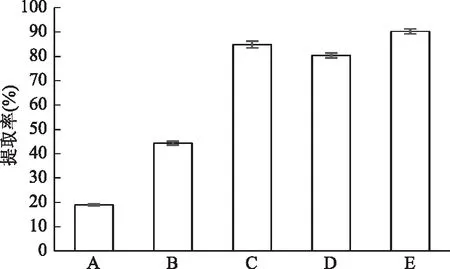
图3 不同提取溶液提取效率的影响
2.2.2 无机硒分离效果验证 实验发现,葡萄样品的各类提取液均不能直接用于HG-AFS检测无机硒,需要进一步消解还原处理,这会使提取液中可能存在的硒代氨基酸等转化为无机硒,对测定结果产生干扰,因此,需要进一步净化去除。本实验将提取液酸化后,流经聚合物型强阳离子交换小柱,使游离硒代氨基酸和一些弱极性化合物被吸附,而阴离子形态的无机硒则不被保留,直接收集到消解管中。
为进一步验证无机硒的分离效果,实验设计了7组处理(1.2.4.2),各组荧光值t检验(p<0.01)对比情况如图4所示。结果显示,D、F的荧光值,与E-C的荧光值(E与C的荧光值之差),无显著差别,而G组荧光值显著高于D、E和F处理的荧光值(p<0.01),表明提取液中的无机硒在小柱上无保留,而硒代氨基酸被有效截留;A处理荧光值显著高于B、C处理荧光值(p<0.01),而B、C荧光值接近试剂空白值,表明葡萄试样中的结合态硒不能被提取,D、E、F的荧光值显著高于B、C(p<0.01),说明无机硒能被有效提取。

图4 不同处理检测荧光值的比较
2.3 方法线性关系、检出限、定量限、准确度和精密度
经对硒浓度0.25~4 μg/L系列溶液进行验证,呈现良好线性关系,标准曲线为:y=187c-15.2(y为荧光值,c为溶液中硒浓度),R2=0.9989。由于空白酿酒葡萄试样不易获得,故选择低硒含量的酿酒葡萄(未施硒肥)和添加了5 μg/kg无机硒的低含量酿酒葡萄,分别按总硒和无机硒的处理方法,进行10次分析,计算荧光值标准差,按不小于3倍和10倍荧光值标准差,计算检出限和定量限(总硒、无机硒基本一致),酿酒葡萄试样(干样)分别可达2和5 μg/kg。同样方法,葡萄酒试样可达0.2和0.5 μg/kg。
准确度和精密度评价通过测定硒标准质控样和加标回收试验完成。硒标准质控样测定值与标准值符合良好,见表1,表明应用改进的消解还原条件对检测结果无影响。取烘干未施硒肥的葡萄样品进行低、中硒水平添加,施硒肥的葡萄样品高硒水平添加,每个水平重复6次,按本实验确定的方法进行消解还原后,进行测定,进一步评价总硒测定的准确性和精密度,结果亦见表1,回收率为 96.47%~97.39%,相对标准差为1.76%~5.65%。说明改进消解还原条件后,检测的准确度和精密度保持良好。由于酒渣、酒泥和葡萄酒都来源于葡萄,因此未对此三种基质中的总硒加标回收率进行考察。
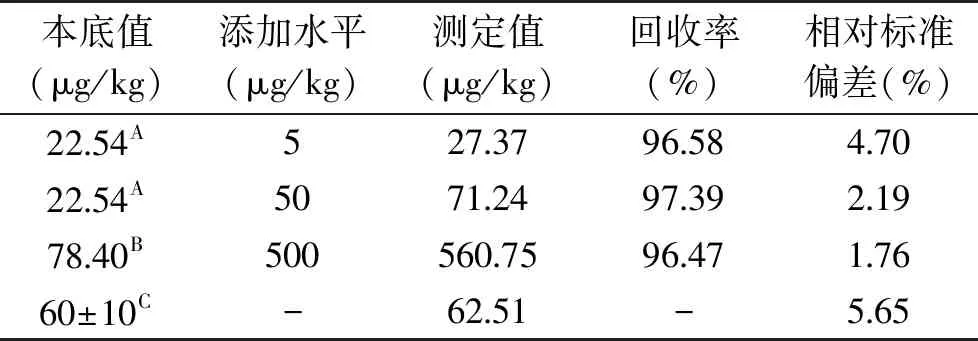
表1 酿酒葡萄中总硒测定的准确性和精密度(n=6)Table 1 Accuracy and precision for determination of total selenium(n=6)
注:ND小于方法检出限。取烘干施硒肥的葡萄样品,进行3水平6重复的加标回收实验,评价无机硒检测的准确性和精密度。结果见表2,回收率为85.20%~88.91%,相对标准差为5.97%~21.45%,其中相对标准差较总硒相对较高,仍然有较好的准确性和重复性。由于葡萄试样中未检出无机硒,本实验未对酒渣、酒泥和葡萄酒的无机硒检测方法进一步研究和方法学考察。
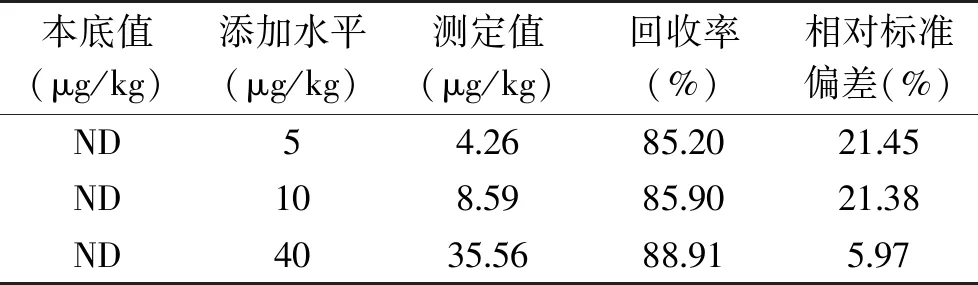
表2 酿酒葡萄中无机硒测定的准确性和精密度(n=6)Table 2 Accuracy and precision for determination of inorganic selenium(n=6)
2.4 施用富硒叶面肥后酿酒葡萄样品及其酿造物中硒含量的追踪检测
应用本法,对酿酒葡萄试样进行了检测,结果硒肥组和对照组的酿酒葡萄均未检出无机硒(未列出),但硒肥组和对照组的总硒含量存在极显著差异(p<0.01),硒肥组的总硒含量为9.65~38.6 μg/kg(鲜样),约高出对照组3倍,达到富硒食品的标准[24],说明施用富硒叶面肥可以有效提高葡萄果实中硒含量,且为有机硒。由于硒肥中的硒主要是硒的螯合物,所以果实中的有机硒形态还有待进一步分析。
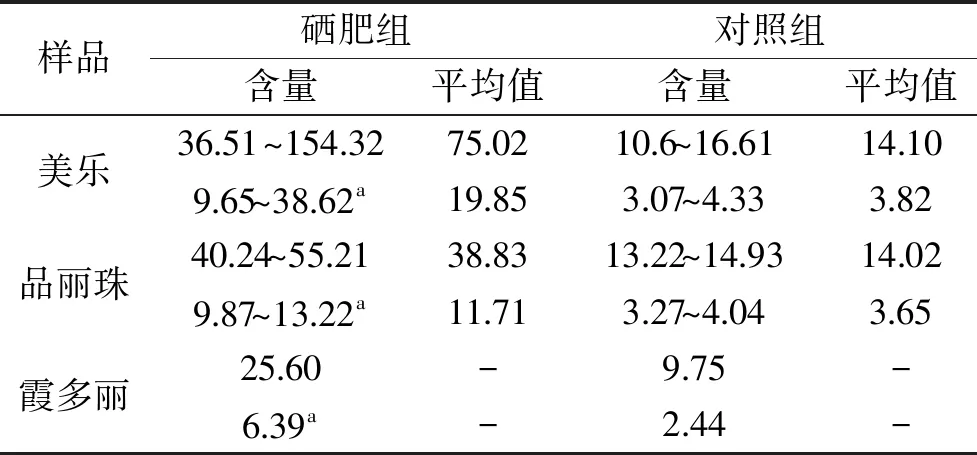
表3 酿酒葡萄中的总硒含量(μg/kg)Table 3 Total selenium content in wine grapes(μg/kg)
对硒肥组美乐酿酒葡萄酿造后的酒渣、酒泥和葡萄酒进行追踪检测,总硒含量亦存在极显著差异(p<0.01),酒渣、酒泥和葡萄酒中总硒含量和存留分数见表4,其中硒存留分数按75%的出酒率计算(酒渣20%,酒泥5%)。可见酒渣中硒含量最高,是鲜样硒肥组美乐酿酒葡萄平均硒含量的近6倍,其硒存留率为89.3%,说明葡萄酒酿造过程中硒主要沉积在酒渣中,再随酒泥沉降一部分,仅有2.0%存留在葡萄酒中。

表4 酿造产物中的硒含量Table 4 Selenium content in wine grapes and their brewed products
3 结论
本文以酿酒葡萄为材料,通过优化消解还原条件和无机硒提取方法,建立了原子荧光光谱法检测总硒和无机硒的检测方法。方法学性能表现良好,在考察的浓度范围内(0.25~4 μg/L),R2大于0.99,总硒回收率和标准偏差分别为 96.47%~97.39%和1.76%~5.65%,无机硒回收率和标准偏差分别为85.20%~88.91%和5.97%~21.45%,无机硒测定时能够有效克服硒代氨基酸干扰,为富硒酿酒葡萄产品的开发和质量评价提供了有效检测手段。对施用富硒叶面肥的酿酒葡萄与酿造产物的追踪检测显示,富硒叶面肥可以有效提高葡萄果实中有机硒含量,达到富硒食品的硒含量标准,但其形态还有待进一步研究;葡萄酒的酿造过程中,硒主要随酒渣、酒泥流失,葡萄酒中的留存率较低。

