低醇度萌发苦荞酒工艺优化及相关指标变化研究
王 珊,马挺军
(北京农学院食品科学与工程学院,北京 102206)
苦荞(又称鞑靼荞麦,Fagopyrumtataricum),是我国重要的“药食两用”的小宗粮食作物[1],含有较高的淀粉、丰富的蛋白质以及多种功能活性物质。但苦荞中含有蛋白酶抑制剂、植酸等抗营养因子,这些抗营养因子是导致蛋白质、淀粉消化率低,功能活性成分减少的主要原因之一[2-3]。有研究表明,苦荞经萌发处理,可降低蛋白酶抑制剂的含量,提高蛋白质和淀粉的消化性,使氨基酸更为均衡,黄酮、酚酸和γ-氨基丁酸(γ-aminobutyric acid,GABA)等生物活性物质富集[4-5]。苦荞萌发第3 d时,总淀粉含量下降不大,此时淀粉含量与大多数谷物相当,可提供碳源满足发酵条件[6-7]。张雨薇等[8]对萌发前后荞麦蛋白及氨基酸变化进行研究,发芽处理可显著提高荞麦蛋白质含量(平均增幅50.0%)、总氨基酸含量(平均增幅37.0%)。因此,萌发荞麦是一种较为合适的酿酒原料。
苦荞萌发后,其营养价值提高,更加有利于消化吸收。随着苦荞开发利用,以萌发荞麦作为发酵原料的研究逐渐增多,主要集中在萌发苦荞酒或饮料等方面。孙常明等[9]以28 ℃培养3 d的萌发荞麦为原料发酵制酒,将蚂蚁提取物与荞麦芽酒按比例勾兑获得的保健酒口感醇厚,兼具酒香和药香,是一种具有抗风湿功能的新型保健酒。张燕莉[10]以21 ℃发芽72 h苦荞芽为原料发酵制得的啤酒中,γ-氨基丁酸、总黄酮、总酚酸较原料中有所提高,且明显高于市售啤酒。尉杰[11]以23 ℃光照培养3 d的萌发甜荞为原料,经发酵获得酒精度为13.5% vol发芽甜荞酒,其品质较好。黄永光等[12]以25 ℃培养3 d的荞麦芽和马尾松花粉为原料,向酒液中加入马尾松花粉进行调配,获得荞麦-马尾松花粉格瓦斯饮料,其酒精度为6.2% vol,总黄酮含量为92.916 μg/mL。前人的研究主要集中在糖化、发酵、调配等方面,未将萌发培养后的苦荞与发酵酿酒结合研究。
植物受到逆境胁迫时,可刺激合成黄酮、酚酸、γ-氨基丁酸的关键酶活性,继而促进活性物质进一步积累,其中黄酮、酚酸在抗炎、抗衰老、降血糖、抑制肿瘤等方面发挥着重要作用[13-16]。GABA作为抑制性神经递质,可改善脑机能,同时具有降血压、利尿[17-19]等作用,同时,盐胁迫是一种安全、环保的胁迫方式[20]。因此,本文将盐胁迫与发酵结合,其中,萌发培养阶段,以苦荞为原料,考察培养温度、光照时间、盐种类及浓度对萌发3 d苦荞中总黄酮、总酚酸影响;糖化阶段,以萌发苦荞为原料,考察糖化温度、糖化时间以及酶添加量对DE值(还原糖含量与总干物质含量之比)的影响,同时研究了不同发酵天数的总黄酮、总酚酸、GABA的变化趋势,及成品酒的理化指标,以期为萌发苦荞功能性保健酒研究提供新的理论依据。
1 材料与方法
1.1 材料与仪器
黔苦1号 贵州省农业科学院;活性干酵母 安琪酵母股份有限公司;冰乙酸、氢氧化钠、硼酸、盐酸、氯化铝、乙酸钾、碳酸钠 北京化工厂;硫酸铜 天津市福晨化学试剂厂;亚甲蓝 北京博奥拓达科技有限公司;酒石酸钾钠 西陇化工股份有限公司;亚铁氰化钾、乙酸锌、邻苯二甲醛、乙酸钠 国药集团化学试剂有限公司;α-淀粉酶(3700 U/g) 北京索莱宝科技有限公司;糖化酶(1000000 U/g) 阿拉丁(上海)有限公司;甲醛溶液(36%~38%) 国药集团化学试剂有限公司;芦丁标准品、没食子酸标准品、GABA标准品、β-疏基丁醇、福林酚、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;乙腈 色谱纯,美国MREDA公司。
BSA224S型电子分析天平 赛多利斯科学仪器(北京)有限公司;WS-01恒温恒湿培养箱 湖北黄石恒丰医疗器械有限公司;TDZ5M型台式低速离心机 长沙易达仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 邦西仪器科技(上海)有限公司;可调式封闭电炉 北京市永光明医疗仪器厂;HZS-H水浴振荡器 哈尔滨市东联电子技术开发有限公司;德尔高速粉碎机、25 mL酸式滴定管、500 mL全玻璃蒸馏器、50 mL附温度计密度瓶 上海信谊仪器厂有限公司。
1.2 实验方法
1.2.1 苦荞种子萌发处理 选取籽粒饱满,无霉变苦荞种子,去离子水洗净滤干,用1% NaClO消毒15 min,去离子水冲洗干净,将去离子水没过苦荞种子并在30 ℃条件下水浴浸泡5 h。取出均匀放入平铺有两层纱布的托盘中。在一定温度、光照时间、盐种类及浓度条件下,80%±5% RH恒温恒湿培养箱中培养72 h。培养结束后,在45 ℃恒温鼓风干燥箱干燥12 h并过60目筛备用。
1.2.2 萌发苦荞酿酒工艺流程 参考陈佳昕等[21]发酵工艺改进:
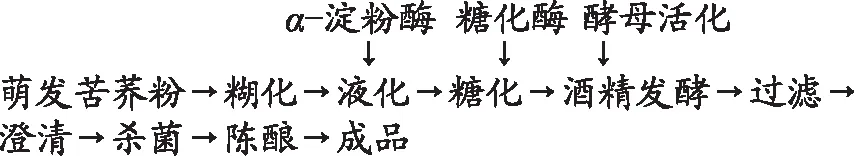
工艺操作要点:糊化:称取一定质量萌发苦荞粉,按1∶5比例加入去离子水,充分震荡混匀,置于90 ℃水浴锅中不间断晃动,糊化30 min;液化:糊化液中按1%加入α-淀粉酶,60 ℃、30 min条件下进行液化;糖化:在一定温度条件下,液化液中按一定添加量加入β-淀粉酶,糖化一定时间,糖化结束后于100 ℃中水浴10 min灭酶;酵母活化:取10倍于干酵母量的35 ℃ 2%的糖水复水活化30 min;酒精发酵:将活化好的酵母菌按接菌量为2.5%接入糖化液中,在28 ℃恒温恒湿静置发酵4 d。
1.2.3 单因素实验
1.2.3.1 萌发苦荞培养条件单因素实验设计 将浸泡5 h的苦荞种子分为若干份,每组平行做3份。以总黄酮、总酚酸为指标,考察KCl溶液浓度(5、10、15、20、25 mmol/L)、NaCl溶液浓度(10、20、30、40、50 mmol/L)、培养温度(15、20、25、30、35 ℃)以及光照时间(2、4、6、8、10 h)对萌发苦荞中功能活性物质的影响。采用控制变量法,其中初始条件为KCl溶液浓度10 mmol/L、NaCl溶液浓度20 mmol/L、培养温度15 ℃,每天用15 W白光光照2 h。培养3 d后烘干磨粉测总黄酮、总酚酸含量。
1.2.3.2 糖化条件单因素实验设计 准确称取若干份萌发苦荞粉,每份3 g放于100 mL锥形瓶中,每组平行做3份。按照1∶5 (g/mL)料液比加入15 mL去离子水,放入90 ℃磁力搅拌器中糊化30 min,30 min后取出并用冷水冷却至50 ℃,加入1%的α-淀粉酶60 ℃液化30 min,取出冷却至40 ℃。以DE值为指标,考察糖化酶添加量(0.5%、1%、1.5%、2%、2.5%、3%)、糖化温度(45、50、55、60、65、70 ℃)、糖化时间(0.5、1、2、3、4、5 h)对DE值的影响。采用控制变量法,其中初始条件为糖化酶添加量2.5%、糖化温度55 ℃、糖化时间3 h,糖化结束后测定还原糖含量。
1.2.4 Box-Behnken响应面优化设计
1.2.4.1 萌发苦荞培养条件的响应面优化试验 以KCl浓度(A)、培养温度(B)、光照时间(C)三个因素为自变量,总黄酮和总酚酸为响应值设计三因素三水平实验方案,各因素及水平见表1。

表1 萌发阶段响应面实验因素及水平表Table 1 Levels and factors of the response surface experiment in germination stage
1.2.4.2 糖化阶段的响应面优化试验 以糖化时间(A)、糖化温度(B)、酶添加量(C)三个因素为自变量,DE值为响应值设计三因素三水平实验方案,各因素及水平见表2。

表2 糖化阶段响应面实验因素及水平Table 2 Factors and level of the response surface experiment in saccharification stage
1.2.5 指标的测定
1.2.5.1 总黄酮含量测定 参照万燕等[22]的方法并加以改进测定总黄酮含量。准确称取20 mg芦丁标准品,70%乙醇溶液定容至100 mL,得0.2 mg/mL芦丁母液。从芦丁母液中分别取0.0、0.2、0.4、0.6、0.8、1.0 mL于20 mL具塞试管中,加入2 mL 0.1 mol/L三氯化铝、3 mL 1 mol/L醋酸钾溶液、70%乙醇定容至10 mL,摇匀,静置30 min后于420 nm处测定吸光度。标准曲线方程y=6.1325x+0.0066(R2=0.9996),其中x为质量(mg),y为吸光度值。
准确称取0.5 g萌发苦荞粉,以1∶70比例加入70%乙醇35 mL,在700 W、40 Hz、50 ℃超声条件下提取20 min,将试样在4000 r/min 离心10 min,得总黄酮提取液。从总黄酮提取液中取0.5 mL于20 mL具塞试管,参照上述步骤测定吸光度。
式中:Y1为总黄酮含量(mg/g);X1为提取液中总黄酮质量(mg);m为萌发苦荞粉重量(g);V取为提取液中移取体积;V定为提取液总体积。
1.2.5.2 总酚酸含量测定 参照汪雪娇等[23]的方法并加以改进测定总酚酸含量。准确称取25 mg没食子酸标准品,70%乙醇定容至100 mL,得到0.25 mg/mL没食子酸母液。分别取0.0、0.2、0.4、0.6、0.8、1.0 mL没食子酸母液于20 mL具塞试管中,用70%乙醇补足5 mL,加入1 mL福林酚和3 mL 15%碳酸钠溶液,用去离子水定容至20 mL,避光显色1 h,在765 nm处测吸光度。标准曲线方程为y=5.0931x+0.0095(R2=0.999),其中:x为质量(mg),y为吸光度值。
发芽苦荞粉总酚酸提取液参照1.2.5.1,测定步骤同上。
式中:Y2为总酚酸含量(mg/g);X2为提取液中总酚酸质量(mg);m为萌发苦荞粉重量(g);V取为提取液中移取体积;V定为提取液总体积。
1.2.5.3 DE值的计算 还原糖的测定参照GB 5009.7-2016《食品中还原糖的测定》中的直接滴定法,以碱性酒石酸溶液标定,葡萄糖计。
DE参照马坤[24]的方法测定。取20 mL酶解液在100 ℃下干燥至恒重,测其总干物质含量,还原糖与总干物质含量之比为DE值。

1.2.6 酒精度、功能活性物质及抗氧化性测定
1.2.6.1 酒精度 采用GB 5009.225-2016《酒中乙醇浓度的测定》密度瓶法进行酒精度测定。
1.2.6.2 GABA含量 采用外标法进行标准曲线的绘制:准确配制0.0、10.0、30.0、50.0、100.0、200.0 μg/mL GABA标准溶液,从中各取1 mL标准液于4 mL小离心管中,加入50 μL的邻苯二甲醛(o-phthaldialdehyde,OPA)衍生液充分振荡,静置5 min,用0.22 μm有机滤膜过滤,实验重复3次。标准曲线方程为:y=22411x+76112(R2=0.9962),所测浓度范围为0~200 μg/mL,其中:x为浓度(μg/mL),y为峰面积。
根据郭晓蒙等[25]方法改进,将发酵结束后样品在4000 r/min离心10 min,吸取上清液1 mL置于4 mL小离心管中,50 μL OPA柱前衍生,混匀并静止5 min,过0.22 μm有机滤膜,待测。参照QB/T 4587-2013洗脱程序,如表3。日本岛津,ZORBAX Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相A:0.02 mol/L乙酸钠;流动相B:乙腈;检测波长:338 nm;进样量:10 μL;流速:1.0 mL/min,柱温:40 ℃。

表3 梯度洗脱程序Table 3 Gradient elution program
1.2.6.3 DPPH自由基清除率 参照卢美欢等[26]的方法加以改进。准确称取20 mg DPPH,用无水乙醇溶解并定容至250 mL,避光保存,现配现用。将发酵结束后的样品在4000 r/min离心10 min,取2 mL样品上清液置于20 mL具塞试管中,加入2 mL DPPH溶液,摇匀,黑暗放置30 min,以无水乙醇为空白,用紫外分光光度计于517 nm测其吸光度Ai;取2 mL样品与2 mL无水乙醇混合均匀黑暗静置30 min测定吸光度Aj;2 mL DPPH与2 mL无水乙醇混合溶液相同条件下测定吸光度Ac。
清除率(%)=[1-(Ai-Aj)/Ac]×100
1.2.7 萌发苦荞酒理化指标的测定
1.2.7.1 总酸、氨基酸态氮、pH 参照GB/T 13662-2018。将1.2.2发酵结束的样品在4000 r/min离心10 min,取10 mL上清液于150 mL烧杯中,加入无二氧化碳的水50 mL,置于磁力搅拌器上,用0.1 mol/L氢氧化钠溶液滴定,直至pH=8.20为滴定终点,记下消耗氢氧化钠体积(V1)。向溶液中加入甲醛溶液10 mL,继续用氢氧化钠滴定,直至pH=9.20,记下加甲醛后消耗氢氧化钠体积(V2)。同时做空白实验,分别记录不加甲醛及加入甲醛溶液时,空白实验消耗氢氧化钠体积(V3、V4)。实验重复三次,取平均值。取上清液,采用pH计测定pH,实验重复三次,取平均值。

式中,V0为吸取样品体积(mL);V1为测定样品时,消耗0.1 mol/L氢氧化钠溶液体积(mL);V3为空白实验消耗0.1 mol/L氢氧化钠溶液体积(mL);C1为氢氧化钠溶液浓度(mol/L);M1为乳酸的摩尔质量(g/mol)(M1=90)。

式中,V0为吸取样品体积(mL);V2为加入甲醛后,测定样品时消耗0.1 mol/L氢氧化钠溶液体积(mL);V4为加入甲醛后,空白实验时消耗0.1 mol/L氢氧化钠溶液体积(mL);C2为氢氧化钠溶液浓度(mol/L);M2为氮的摩尔质量(g/mol)(M2=14)。
1.2.7.2 致病菌检测 金黄色葡萄球菌参照GB 4789.10-2016;沙门氏菌参照GB 4789.4-2016。
1.3 数据处理
实验数据处理采用Excel 2010,Design-Expert 8.0.6软件进行响应面实验设计及结果分析。
2 结果与分析
2.1 萌发苦荞培养条件的确定
2.1.1 培养温度对萌发苦荞中总黄酮、总酚酸含量的影响 由图1可知,培养温度在15~35 ℃范围内,总黄酮和总酚酸的含量随温度的变化趋势均为先上升后下降。其中,总黄酮含量在20 ℃时达到最大,为13.29 mg/g,总酚酸含量在25 ℃时达到最大,为15.98 mg/g,在适宜温度条件下,酶活力增加,黄酮、酚酸等次级代谢产物得到富集。温度超过25 ℃后,两者的含量下降趋势明显,这是因为温度升高,合成黄酮、酚酸的关键酶-苯丙氨酸解氨酶(PAL)和查尔酮异构酶(CHI)活性下降[27],导致黄酮、酚酸类物质含量减少。因此,适宜培养温度为20 ℃。

图1 不同培养温度下萌发苦荞中总黄酮、总酚酸含量
2.1.2 光照时间对萌发苦荞中总黄酮、总酚酸含量的影响 由图2可知,每天光照时间在2~4 h时,总黄酮、总酚酸含量呈上升趋势,光照4 h时,两者含量均达到最大值,其中总黄酮含量为12.56 mg/g,总酚酸含量为14.03 mg/g,有研究表明[28-29],光照能在苦荞萌发阶段提供能量,合成黄酮类物质代谢的关键酶-PAL和CHI活性提高,有利于合成次级代谢产物。光照时间在4~10 h时,两者含量呈下降趋势,原因可能是黄酮、酚酸类物质分解合成其他物质[30]。因此,最佳光照时间为4 h。

图2 不同光照时间下萌发苦荞中总黄酮、总酚酸含量
2.1.3 盐种类及浓度对萌发苦荞中总黄酮、总酚酸含量的影响 由图3a可知,KCl浓度在5~20 mmol/L时,总黄酮、总酚酸均呈上升趋势,KCl浓度为20 mmol/L时,两者含量达到最大值,其中总黄酮含量为13.29 mg/g,总酚酸为16.17 mg/g。KCl浓度在20~25 mmol/L时,两者均呈下降趋势,说明适当的盐胁迫处理,有利于刺激PAL和CHI活性,增加黄酮、酚酸含量[22],当KCl浓度再增加时,细胞内外渗透压加大导致细胞脱水,加剧盐胁迫伤害,这与刘建新等[31]的研究结果一致。由图3b可知,NaCl浓度10~40 mmol/L时,总黄酮和总酚酸含量呈上升趋势,在NaCl 浓度为40 mmol/L时达到最大,此时总黄酮含量为12.34 mg/g,总酚酸为15.16 mg/g。NaCl浓度40~50 mmol/L时,两者含量呈下降趋势。通过对萌发3 d的苦荞进行不同种类盐处理,发现在同一浓度条件下,经KCl胁迫后,萌发苦荞中黄酮、酚酸类等物质含量高于经NaCl胁迫处理,K+、Na+与合成黄酮、酚酸类的关键酶之间的关系有待进一步研究。因此,最佳盐种类及浓度为20 mmol/L KCl。

图3 不同盐胁迫对萌发苦荞中总黄酮、总酚酸的影响
2.2 苦荞萌发培养条件响应面试验结果
2.2.1 萌发苦荞的响应面设计及结果 采用Design-Expert 8.0.6软件进行实验设计,以KCl浓度(A)、温度(B)、时间(C)为自变量,总黄酮(Y1)、总酚酸(Y2)为指标进行三因素三水平实验,实验设计及结果见表4。

表4 萌发苦荞培养的响应面设计与结果Table 4 Design and results Germination culture conditions of buckwheat by response surface experiment
2.2.2 萌发苦荞培养条件回归方程及响应面实验方差分析 利用Design-Expert 8.0软件对表中数据进行二次多元回归拟合,分别得到各个因素对样品总黄酮和总酚酸两个指标的二次回归方程分别如下:
黄酮含量=14.52-0.28A-0.35B+0.094C-0.43AB+0.5AC-0.69BC-1.32A2-2.14B2-1.75C2
酚酸含量=16.54-0.036A-0.24B+0.47C-0.18AB-0.92AC-0.58BC-0.19A2-2.88B2-2.15C2
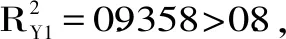

表5 总黄酮、总酚酸的响应面实验方差分析Table 5 Analysis of variance for the response surface experiment of total flavonoids and total phenolic
2.2.3 各因素交互作用分析 由Design-Expert 8.0.6软件进行响应面实验,剔除不显著项得到图4。KCl和光照时间交互作用产生的等高线图为椭圆状,表明两者交互作用对总酚酸含量影响显著,与方差分析结果一致。固定KCl与培养温度,随着光照时间延长,总酚酸含量呈先上升后下降趋势,同时得出酚酸含量对光照时间的变化比KCl的变化敏感。

图4 KCl和光照时间的响应面及等高线图
2.2.4 最佳萌发培养条件确定 由Design-Expert 8.0.6中的Box-Behnken响应面设计进行实验,得出总黄酮、总酚酸的最佳提取条件为:KCl浓度19.5 mmol/L、培养温度24.68 ℃、光照时间4.17 h,在此条件下预测的总黄酮含量为14.54 mg/g,总酚酸为16.57 mg/g。考虑到实际情况,将原有的理论模型修改为:20 mmol/L KCl、培养温度25 ℃、光照时间4 h,在此条件下,总黄酮含量为(14.70±0.08) mg/g,总酚酸含量为(16.78±0.05) mg/g。
2.3 萌发苦荞酒糖化工艺的优化
2.3.1 糖化温度对DE值的影响 由图5可知,糖化温度在45~60 ℃时,DE值呈上升趋势,在60 ℃时达到最大,此时DE值为22.36%,说明温度对于酶活性有重要作用,温度适宜酶活力升高,在固定时间内分解产生更多葡萄糖[21]。糖化温度在60~70 ℃时,DE值呈下降趋势,表明温度升高,破坏酶活性,从而水解淀粉能力下降,DE值降低。因此,最佳糖化温度为60 ℃。
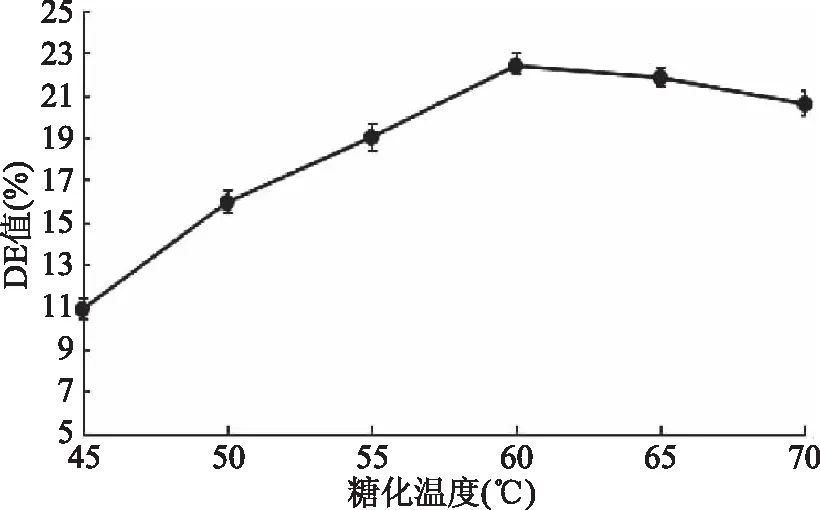
图5 糖化温度对DE值的影响
2.3.2 酶添加量对DE值的影响 由图6可知,在温度、酶解时间以及底物浓度固定时,酶添加量在0.5%~2.5%时,随着酶添加量的增加,DE值呈上升趋势,并在2.5%添加量时DE值达到最大,为22.51%。酶添加量在2.5%~3%时,酶解效果达到饱和,DE值基本保持不变[31]。因此,最佳酶添加量为2.5%。
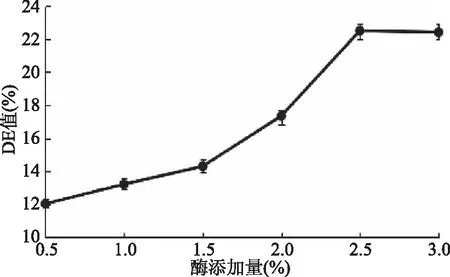
图6 酶添加量对DE值的影响
2.3.3 糖化时间对DE值的影响 由图7可知,糖化时间在0.5~3 h时,DE值呈上升趋势,且在2~3 h间上升速率较大,表明此阶段是生成还原糖关键时期,糖化时间为3 h时,DE值达到最大为23.56%,表明在温度、酶添加量以及底物浓度固定时,糖化3 h底物分解彻底,产生的还原糖达到最大程度[32]。糖化时间在3~5 h时,DE值趋于稳定,表明苦荞中淀粉已最大程度分解完成。因此,最佳糖化时间为3 h。
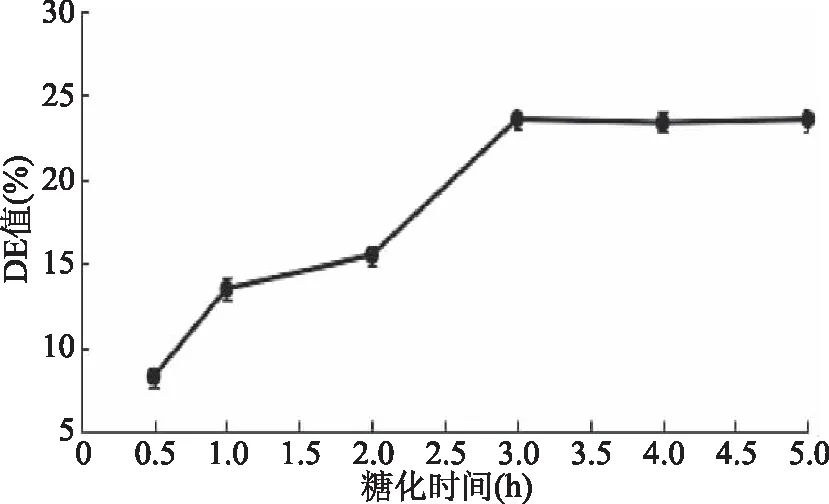
图7 糖化时间对DE值的影响
2.4 糖化工艺响应面实验结果
2.4.1 糖化工艺响应面设计及结果 采用Design-Expert 8.0.6软件进行实验设计,以糖化时间(A)、糖化温度(B)、酶添加量(C)为自变量,DE值为指标,进行三因素三水平实验,实验设计及结果见表6。

表6 糖化工艺响应面设计与结果Table 6 The response surface design and results of saccharification process
2.4.2 糖化工艺响应面实验方差分析 利用Design-Expert 8.0软件对表中数据进行二次多元回归拟合,得到各个因素对样品DE值指标的二次回归方程分别如下:
DE值=23.58+1.54A-0.25B+0.80C-0.23AB-0.25AC-0.78BC-1.08A2-1.69B2-0.081C2
由表7中可知,模型DE值的p值<0.0001,表明该模型差异显著。失拟项p=0.4127>0.05,没有显著性差异,说明该模型拟合性良好。该模型的决定系数R2=0.9807>0.8,表明该二次方程能够较好地拟合真实的响应面。由回归方程和方差分析可知,模型中A、C、BC、A2、B2对DE值影响极显著(p<0.01),B、AB、AC、C2对DE值影响不显著。据统计学分析,A、B、C三因素所对应的F值越大,说明该因素对DE响应值的影响越大[33]。因此可知影响DE值顺序为A>C>B,即糖化时间>酶添加量>糖化温度。

表7 DE值的响应面实验方差分析Table 7 Analysis of variance for the response surface experiment of DE
2.4.3 响应面中各因素对DE值的结果分析 由Design-Expert 8.0.6软件进行响应面试验,剔除不显著项得到如图8。糖化温度和酶添加量交互作用产生的等高线图为椭圆状,表明两者交互作用对DE值影响显著,与方差分析结果一致。固定酶添加量及糖化时间,随着温度升高,DE值呈先上升后下降趋势,这与酶的本质相关,同时得出DE值对酶添加量的变化比温度的变化敏感。

图8 糖化温度和酶添加量的响应面及等高线图
2.4.4 最佳糖化工艺条件确定 由Design-Expert 8.0.6中的Box-Behnken响应面设计进行实验,得出DE值的最佳糖化条件为:时间3.63 h、糖化温度58.26 ℃、酶添加量3%,在此条件下预测的DE值为24.89%,考虑到实际情况,将原有的理论模型修改为:糖化时间3.5 h、糖化温度58 ℃、糖化酶添加量3%,在此条件下,DE值为24.13%±0.02%。
2.5 不同发酵天数酒精度、功能活性物质及抗氧化性变化
由图9a可知,萌发苦荞酒在发酵1~4 d时,酒精度呈上升趋势,并在发酵第4 d时,酒精度达到最大值,为8.83%±0.11% vol;在4~7 d时,酒精度略有下降。因此,萌发苦荞酒发酵时间为4 d。

图9 不同发酵天数酒精度、功能活性物质及抗氧化性变化
由图9b可知,苦荞芽发酵时,总黄酮、总酚酸以及GABA含量处于动态变化,其中总黄酮含量随着发酵天数延长,呈下降趋势,在发酵第4 d时,酒液中总黄酮浓度减少至(1.458±0.015) mg/100 mL,这可能与黄酮极性相关;总酚酸、GABA含量随着发酵天数的变化趋势基本一致,呈先上升后下降趋势,并均在发酵3 d时达到最大值,分别为(33.33±0.02)、(15.74±0.03) mg/100 mL;DPPH自由基清除率在发酵第3 d时达到最大,为90.15%±0.01%。
萌发苦荞经过4 d发酵,在发酵结束第4 d时,总黄酮含量为(1.458±0.015) mg/100 mL,总酚酸含量为(24.93±0.01) mg/100 mL,GABA含量为(12.33±0.012) mg/100 mL,DPPH自由基清除率为85.22%±0.01%。
2.6 最优条件下萌发苦荞酒理化指标
萌发苦荞经过4 d发酵后,酒精度约为8.8% vol,pH、总酸(以乳酸计)、氨基酸态氮结果均达到清爽型半甜黄酒标准,同时,金黄色葡萄球菌、沙门氏菌未检出。因此,萌发苦荞酒总体符合黄酒(GB/T 13662-2018)的标准。

表8 萌发苦荞酒基本理化指标Table 8 Basic physical and chemical indicators of germinated buckwheat wine
3 结论
通过单因素和响应面试验,分别对苦荞萌发培养条件和萌发苦荞酒糖化工艺进行优化,确定苦荞萌发培养条件为20 mmol/L KCl、培养温度25 ℃、光照时间4 h,在此萌发条件下,萌发苦荞总黄酮含量为(14.70±0.08) mg/g,总酚酸含量为(16.78±0.05) mg/g;最佳糖化工艺为糖化酶添加量3%、糖化温度58 ℃、糖化时间3.5 h,在此糖化条件下,DE值为24.13%±0.02%。萌发苦荞发酵4 d后,酒精度为8.83%±0.11% vol,总黄酮含量为(1.458±0.015) mg/100 mL,总酚酸含量为(24.93±0.01) mg/100 mL,GABA含量为(12.33±0.012) mg/100 mL,DPPH自由基清除率为85.22%±0.01%,口感醇厚,是一种较好的低度型萌发苦荞酒,为低醇度酒酿造工艺提供一定理论基础。

