锦橙中β-葡萄糖苷酶的提取纯化及其结构表征
任婧楠,范 刚,张璐璐,潘思轶,王可兴
(环境食品学教育部重点实验室,华中农业大学食品科技学院,湖北武汉 430070)
β-葡萄糖苷酶(β-glucosidase)又称为β-D-葡萄糖苷水解酶,它包含一个异构组的酶,能水解双糖或低聚糖的β-葡萄糖苷键及其他的葡萄糖共轭键使其断开,从而释放出糖苷及其配基[1]。β-葡萄糖苷酶广泛分布于自然界生物中,如植物、昆虫、酵母、霉菌和细菌[2-3],并在许多生命过程中都扮演着关键角色。例如香气的释放[4-5],异黄酮苷的水解[6],花色苷配体的释放[7],纤维素生物质的降解[8],生氰作用[9]等过程,β-葡萄糖苷酶还被认为在细胞壁降解的过程中起到一定的作用[10]。一些植物来源的β-葡萄糖苷酶具有高度的底物专一性[11]。β-葡萄糖苷酶的相对分子质量一般在40~250 kDa之间,不同来源的β-葡萄糖苷酶的相对分子质量有很大差异,这是由于它们在不同的生物体中的结构和组成不同[12]。不同来源的β-葡萄糖苷酶的活性也存在差异,Dong等[13]从Paenibacillus菌株分离的β-葡萄糖苷酶的活性达15.40 U/mg。
目前国内外的研究学者已经对各种来源的β-葡萄糖苷酶的提取、纯化及酶学性质进行了大量的研究[14],然而,柑橘中的β-葡萄糖苷酶的研究还比较少。据报道,β-葡萄糖苷酶分布于柑橘果实的各个部位,在柑橘果实键合态香气水解释放、柠檬苦素类物质糖苷水解及花色苷降解过程中起到重要作用[14]。Ren等[15]研究了柑橘生长过程中β-葡萄糖苷酶的酶活变化,并发现柑橘在成熟过程中β-葡萄糖苷酶酶活呈上升趋势。柑橘不同组织部位中β-葡萄糖苷酶的活性也是不同的。Burns和Baldwin[16]研究发现葡萄柚白皮层中β-葡萄糖苷酶活性最高,其次为果皮,而果汁中的活性最低。Barbagallo等[17]研究发现血橙果肉中β-葡萄糖苷酶的酶活高于离心果汁中的酶活,由此得出结论,柑橘中的β-葡萄糖苷酶主要与固态部分结合紧密,有可能与果胶链结合在一起。
目前,国内外的研究学者已经对各种来源的β-葡萄糖苷酶的提取、纯化及酶学性质进行了大量的研究,如玉米秸秆[18]、橄榄[19]、橡胶树[20]、杏[21]。然而,对于柑橘中β-葡萄糖苷酶的研究还比较少。本文以锦橙为原料,对其果皮与果肉中的β-葡萄糖苷酶分别进行提取纯化,并进行结构表征,为β-葡萄糖苷酶在影响柑橘品质方面的作用提供理论基础。
1 材料与方法
1.1 材料与仪器
锦橙 采自重庆市,选取树势健壮、生长结果正常的果树摘取果实,果实可固含量为11 °Brix,总酸0.78%;柠檬酸、磷酸氢二钠、交联聚乙烯吡咯烷酮(PVPP)、硫酸铵、氢氧化钠、碳酸钠、对硝基苯酚-β-葡萄糖醛酸苷(p-NPG)、碳酸氢钠、盐酸、Tris、乙酸、聚乙二醇 分析纯,国药集团化学试剂有限公司;DEAE-琼脂糖凝胶 北京欣经科生物技术有限公司。
Eppendorf高速冷冻离心机 北京博仪恒业科技发展有限公司;BSZ-100自动部分收集器 上海沪西分析仪器厂有限公司;DU700紫外-可见光分光光度计 美国贝克曼库尔特有限公司;Mini-PROTEAN Tetra型电泳仪 美国伯乐公司;MK-3多功能酶标仪 美国Thermo Scientific公司;XGT-1000WRX荧光光谱仪 日本Horiba公司;Zetasizer Nano ZS型纳米粒度及Zeta电位分析仪 英国Malvern公司。
1.2 实验方法
1.2.1 锦橙果皮和果肉中β-葡萄糖苷酶粗酶液的制备 根据前期预实验结果,在橙皮或果肉中加入一定量(橙皮∶缓冲液=1∶2)的柠檬酸-磷酸缓冲液(pH6.0)和10%的PVPP,移入榨汁机中榨汁5 min,将所得匀浆于4 ℃下浸提过夜,然后在6000 g的条件下冷冻离心15 min,结束后取上清液。
1.2.2β-葡萄糖苷酶的硫酸铵沉淀 参照宋娜娜等[22]的方法,并作适当修改。向1.2.1中的粗酶液中缓慢加入25%饱和度的硫酸铵溶液,于4 ℃静置过夜,4 ℃、6000 g离心15 min,收集上清液。然后向上清液中加入90%饱和度的硫酸铵溶液,于4 ℃静置过夜,4 ℃、6000 g离心15 min,收集沉淀,将沉淀溶于适量pH6.0、柠檬酸-磷酸缓冲液中。
1.2.3 透析法除盐、浓缩 将透析袋剪为20 cm左右,置于2%(W/V)碳酸氢钠和1.0 mmol/L EDTA(pH8.0)中煮沸10 min,蒸馏水清洗之后,再于1.0 mmol/L EDTA(pH8.0)中煮沸,冷却之后存于4 ℃。将1.2.2中的缓冲液移至透析袋中,蒸馏水作为透析液,每4~6 h更换一次透析液,透析过夜,收集透析袋中的溶液。将透析所得溶液仍装入透析袋中,用聚乙二醇覆盖透析袋脱水至体积≤25 mL[23]。
1.2.4 DEAE-Sepharose柱层析 浓缩酶液上样于已用Tris-HCl(0.05 mol/L,pH8.2)缓冲液平衡的DEAE-sepharose层析柱中(φ 1.6 cm×30 cm)。先后用1000 mL 0.35 mol/L NaCl溶液(溶于平衡缓冲液)和1000 mL 0.4 mol/L NaCl溶液(溶于平衡缓冲液)进行洗脱,流速3.0 mL/min,分别收集0.35 mol/L NaCl洗脱液和0.4 mol/L NaCl洗脱液,每管3 mL。以管号为横坐标,酶活为纵坐标,绘制洗脱曲线。
1.2.5β-葡萄糖苷酶活性测定 采用1.0 mol/L的Na2CO3溶液作为溶剂,分别配制浓度为0.01、0.02、0.03、0.04、0.05、0.06 μmol/mL的对硝基苯酚标准溶液。以蒸馏水为对照,在紫外可见区域扫描各个浓度的最大吸收峰。以对硝基苯酚的浓度为横坐标,以在最大吸收波长405 nm处的吸光度为纵坐标绘制对硝基苯酚的标准曲线。
参照孙艳梅等和罗小娟等[24-25]的方法,并稍作修改。将3 mL 10 mmol/L的p-NPG加入到20 mL的酶液中,在适宜温度下进行反应,在1 min后通过加入1.0 mL浓度为1.0 mol/L的Na2CO3溶液来终止反应,然后在400 nm波长处测定吸光度。利用对硝基苯酚的标准曲线方程可以计算出所生成的对硝基苯酚的浓度。β-葡萄糖苷酶的酶活单位为U/g,定义1 U为在一定条件下,以p-NPG为底物,每分钟释放出1.0 μmol对硝基苯酚所需要的酶量。
1.2.6 酶液中蛋白质浓度的测定 采用考马斯亮蓝G-250比色法。标准曲线的绘制:以Tris-HCl(0.05 mol/L,pH8.2)缓冲液作为空白,牛血清白蛋白作为标准样品。以Tris-HCl(0.05 mol/L,pH8.2)缓冲液做溶液,分别配制0.02、0.04、0.06、0.08、0.10 mg/mL的牛血清白蛋白溶液。移取空白溶液以及标准样品溶液各50 μL,分别加入200 μL考马斯亮蓝溶液,立即放入酶标仪中于595 nm下测定吸光度。以标准样品浓度作为横坐标,相应吸光度作为纵坐标,绘制标准曲线。
将所得各份酶液各取50 μL,分别加入200 μL考马斯亮蓝溶液,立即放入酶标仪中于595 nm下测定吸光度。根据标准曲线可得出各浓缩酶液中蛋白质浓度。
1.2.7 SDS-聚丙烯酰胺凝胶电泳测定分子量 参照刘颖等[26]的方法,并做适当修改。先加入15%的分离胶,使其略高于凝胶板上所划分离线,再加入少量蒸馏水。静置1 h后,倒掉蒸馏水,加入5%浓缩胶,立即插入梳子。静置20 min后,平衡地移除梳子,加入电泳液直至加满。此时将配制好的样品用微量进样器加入槽中(20~25 μL),并用微量进样器取10 μL蛋白质Marker加入另一槽中。将电泳槽放入外壳中,并向其中加入约体积一半的电泳液。封盖,通电,调节A=15 mA,U=80 V,电泳开始。待样品移动到分离胶时,调节A=30 mA,U=100 V。待样品移动到距凝胶板约1.0 cm时,可停止电泳。根据样品条带以及蛋白质Marker 条带,即可得出所测酶的分子量。
1.2.8 荧光光谱分析 配制蛋白质浓度为0.4 mg/mL的酶液,采用荧光光谱仪进行荧光测定,测定时先在350 nm发射波长下扫描得到其最大激发波长,然后用最大激发波长对蛋白质进行扫描得到各发射光谱。激发光谱的操作条件为:扫描范围200~500 nm,扫描速度200 nm/min,激发狭缝和发射狭缝宽均为10 nm,响应时间0.1 s,记录数据波长间隔为1 nm。
1.2.9 粒径测定 采用纳米粒度及Zata电位分析仪进行粒径的测定,散射光为波长532 nm的激光,激光反射角为15°,测定蛋白质浓度为0.4 mg/mL的酶液的粒径,每组测量重复三次。
1.3 数据处理
三次平行实验测定得到的各实验平均值及标准偏差采用Microsoft Office Excel 2010进行计算,并使用SPSS Statistics 24进行显著性分析。
2 结果与分析
2.1 不同浓度NaCl溶液洗脱效果的比较
根据对硝基苯酚标准曲线,得到对硝基苯酚标准曲线的回归方程为:Y=16.966X+0.0165(Y为对硝基苯酚在最大吸收波长处的吸光度,X为对硝基苯酚的浓度(μmol/mL))。相关系数R2=0.9997。根据对硝基苯酚标准曲线的回归方程测定各管洗脱液中β-葡萄糖苷酶的活性。
不同浓度NaCl洗脱液洗脱得到的果皮中β-葡萄糖苷酶的酶活如图1所示,0.35 mol/L NaCl洗脱得到的第13管酶液的酶活最高,达15.3×10-3U/g,收集得到的所有15管酶液的平均酶活为(6.57±4.27)×10-3U/g。0.4 mol/L NaCl洗脱得到的第9管酶液的酶活最高,最高达5.33×10-3U/g,收集得到的所有12管酶液的平均酶活为(3.49±0.92)×10-3U/g。显著性分析结果显示,果皮中0.35 mol/L NaCl洗脱液中β-葡萄糖苷酶的平均酶活显著高于0.4 mol/L NaCl洗脱液中的β-葡萄糖苷酶活性(p<0.05)。
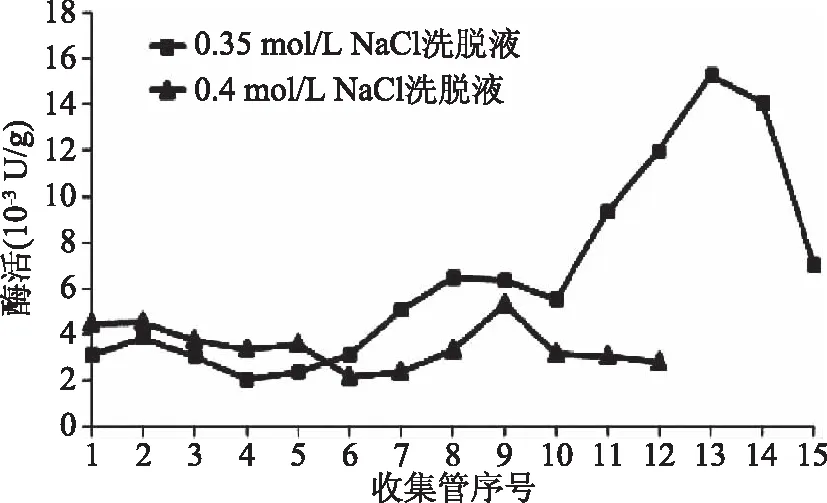
图1 果皮中不同浓度NaCl洗脱液中的β-葡萄糖苷酶活性
不同浓度NaCl洗脱液洗脱得到的果肉酶活如图2所示,0.35 mol/L NaCl洗脱得到的第7管酶液的酶活最高,达7.28×10-3U/g,收集得到的所有17管酶液的平均酶活为(4.66±1.35)×10-3U/g。而0.4 mol/L NaCl洗脱得到的第9管酶液的酶活最高,仅为4.69×10-3U/g,收集得到的所有17管酶液的平均酶活为(3.81±0.56)×10-3U/g。果肉中0.35 mol/L NaCl洗脱液中的β-葡萄糖苷酶的平均酶活高于0.4 mol/L NaCl洗脱液中的β-葡萄糖苷酶的平均酶活,但是没有显著性差异(p>0.05)。
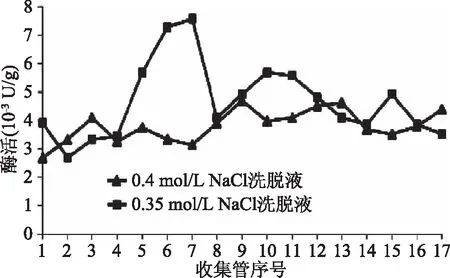
图2 果肉中不同浓度NaCl洗脱液中的β-葡萄糖苷酶活性
此外,果皮中0.35 mol/L NaCl洗脱液中β-葡萄糖苷酶的平均酶活显著高于同一浓度NaCl溶液洗脱得到的果肉中的酶活(p<0.05)。而果皮中0.4 mol/L NaCl洗脱液中的β-葡萄糖苷酶酶活与同一浓度NaCl溶液洗脱得到的果肉中的酶活没有显著性差异(p>0.05)。这说明过高浓度NaCl洗脱对所得的β-葡萄糖苷酶的酶活会造成抑制作用,且0.35 mol/L NaCl洗脱得到的果皮中的酶活显著高于果肉中的酶活。相同的结果也在Burns和Baldwin[16]的研究中得到,他们发现葡萄柚果皮中β-葡糖糖苷酶的活性高于果肉。Barbagallo等[17]发现血橙果肉中β-葡糖糖苷酶的酶活(1.5×10-3U/g)高于果汁中的酶活,其原因可能是由于柑橘中的β-葡糖糖苷酶主要与固态部分紧密结合,有可能是与果胶结合在一起。然而其酶活低于本文中检出的锦橙果肉和果皮中的酶活,其原因与所用柑橘原料的品种、提取纯化条件等都有关。
2.2 纯化酶液中蛋白质浓度
牛血清白蛋白标准曲线的回归方程为:Y=6.2957X+0.3644(Y为牛血清白蛋白在最大吸收波长处的吸光度,X为牛血清白蛋白的浓度),相关系数R2=0.9918。由表1可知,不同浓度NaCl溶液洗脱得到的果皮和果肉酶液的蛋白质浓度存在一定差异,0.35 mol/L NaCl洗脱得到的果皮酶液中蛋白质浓度是0.4 mol/L NaCl洗脱液中蛋白质浓度的2.4倍,且采用0.35 mol/L NaCl洗脱得到的果肉酶液蛋白质浓度也比0.4 mol/L NaCl洗脱液中蛋白质浓度高。因此后续实验采用0.35 mol/L NaCl洗脱酶液。

表1 不同浓度NaCl洗脱果皮和果肉酶液中的蛋白质浓度Table 1 The protein contents in different concentrations of NaCl eluent from pulp and peel
2.3 测定纯化的β-葡萄糖苷酶的分子量
β-葡萄糖苷酶粗酶液经硫酸铵沉淀、DEAE-Sepharose柱层析之后得到纯化的β-葡萄糖苷酶,经聚丙烯酰胺凝胶电泳只显示一条带(图3),其分子量略高于170 kDa,粗略估计为170~250 kDa之间。不同来源的β-葡萄糖苷酶的分子量也不一样,Zhang等[27]测出经重组的大肠杆菌中的β-葡萄糖苷酶的分子量为52 kDa,Sathe等[28]分离纯化了Methylococcus capsulatus中的β-葡萄糖苷酶,并测得其分子量为50.7 kDa,Kar等[3,21]从Putranjiva roxburghii中发现β-葡萄糖苷酶的分子量约为66 kDa。
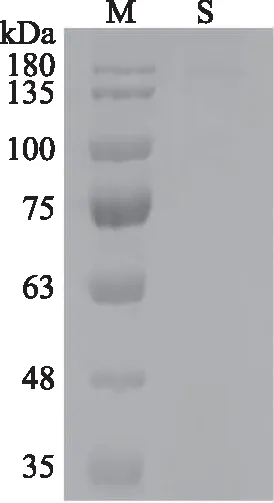
图3 纯化的果皮β-葡萄糖苷酶聚丙烯酰胺凝胶电泳图
2.4 荧光光谱分析
β-葡萄糖苷酶酶液先在350 nm发射波长下扫描得到其最大激发波长290 nm,再在290 nm激发波长下扫描得到荧光光谱。如图4所示,根据荧光光谱结果可知,β-葡萄糖苷酶的最大荧光吸收峰在582 nm左右。荧光光谱分析法是研究蛋白质分子构象的一种有效方法,具有灵敏度高、选择性强、重现性好、试样量少和方法简便等优点[29]。刘宇等[30]发现橡胶籽中β-葡萄糖苷酶的荧光峰为335 nm左右,低于本文中的结果。最大荧光吸收峰的不同与蛋白质结构中色氨酸、酪氨酸和苯丙氨酸存在密切的关系[29]。
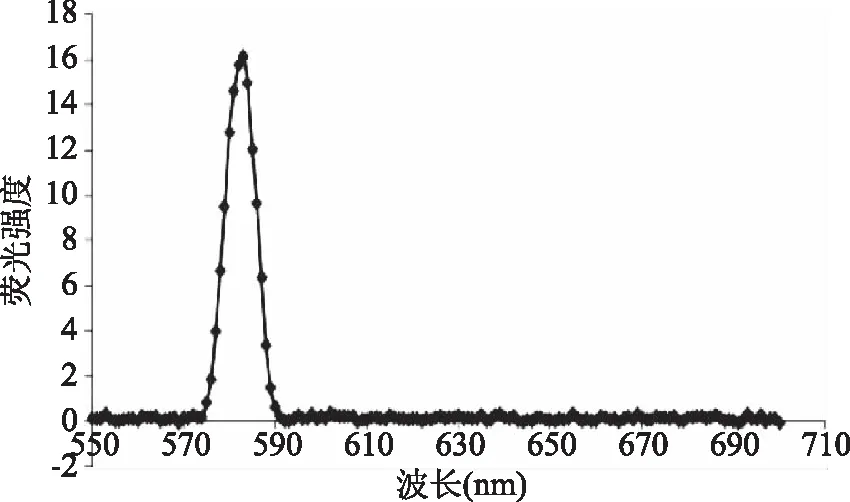
图4 β-葡萄糖苷酶的荧光光谱分析
2.5 粒径分布测定
β-葡萄糖苷酶酶液的粒度分布如图5所示,可以看出,该酶的粒径范围约为5~25 nm。该酶体系的粒径分布曲线呈正态分布形态,是一种比较稳定的体系状态。有关β-葡萄糖苷酶粒径分布的研究很少。体系中蛋白质的粒径分布受到很多因素的影响,进而影响其功能作用。齐宝坤等[31]研究发现大豆分离蛋白的表面疏水性与粒径大小之间存在极显著的线性负相关。蛋白质的粒径分布较大,说明蛋白分子之间相互聚集形成较多聚集体,这会使蛋白质的疏水基团内卷,减少蛋白质分子表面疏水基团的暴露[32],从而导致蛋白质表面疏水性的降低[31]。有关体系中β-葡萄糖苷酶的粒度分布对其性质,尤其是酶活的影响还需进一步研究。
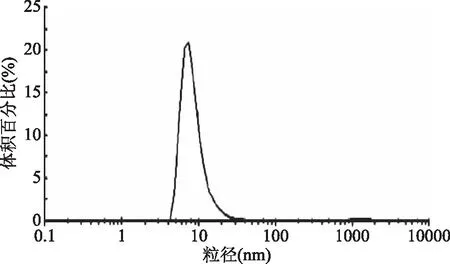
图5 β-葡萄糖苷酶酶液的的粒径分布
3 结论
不同浓度NaCl洗脱液洗脱得到的果皮中β-葡萄糖苷酶的酶活存在显著差异,果皮中0.35 mol/L NaCl洗脱液中的β-葡萄糖苷酶活性显著高于0.4 mol/L NaCl洗脱液中的β-葡萄糖苷酶活性和果肉中的0.35 mol/L和0.4 mol/L NaCl洗脱液中的酶活(p<0.05),且0.35 mol/L NaCl洗脱液中的蛋白质浓度最高,达0.154 mg/mL。在该条件下提取得到的β-葡萄糖苷酶的分子量略高于170 kDa。β-葡萄糖苷酶的最大荧光吸收峰为582 nm,该酶的粒径范围为5~25 nm。

