糖基化反应对白果蛋白免疫原性及结构的影响
孙 红,杨小明
(江苏大学食品与生物工程学院,江苏镇江 212013)
白果含有丰富的蛋白质、多糖、内酯类化合物、矿物质元素、胡萝卜素、维生素、银杏酸、银杏醇、银杏黄素、银杏黄酮等活性成分,研究发现其具有抗氧化、抗糖尿病、降压、抗菌等活性功能疗效[1],白果作为传统食品已经食用了数千年,并被加工成各种食品[2]。白果蛋白(ginkgo seed protein,GSP)作为白果内主要活性成分之一,由白蛋白(41.9%)、球蛋白(48.68%)、醇溶蛋白(1.21%)、碱性谷蛋白(3.98%)组成,具有抗氧化、抗菌等活性功能[3-4]。邓乾春等[5]报道,GSP中的白蛋白在一定程度上能延缓小鼠D-半乳糖诱导的亚急性衰老和自然衰老过程,其机制可能与提高免疫功能和抗氧化能力有关。同时,GSP可增强,GSP可引起I型过敏反应,致敏物主要是分子量为32 kDa的糖蛋白。所以,降低或去除白果蛋白的致敏性是其大规模运用的前提。
食品蛋白质的致敏性与其抗原表位密切相关,降低蛋白的免疫原性可以降低蛋白引发致敏反应的风险[8-9]。蛋白质的抗原表位与其构象表位密切相关,破坏其构象表位能极大降低其抗原表位识别率。蛋白质构象表位可被高温、高压、酶解破坏,而这些操作也是去除食品蛋白致敏性的常用工艺[10]。周昊等[11]研究发现,300~700 MPa的高静压可通过破坏白果蛋白二级结构,显著降低其致敏性。同时,碱性蛋白酶和胃蛋白酶处理白果蛋白并分别处于300、400 MPa时,白果蛋白也能得到很好的脱敏效果[12]。而有关糖基化法改变白果蛋白抗原表位、降低其致敏性的研究鲜有报道,故本文尝试糖基化法降低白果蛋白免疫原性的可行性。
糖基化反应是蛋白质的氨基和还原糖的羟基之间发生一系列非常复杂的非酶促反应,它能够影响食品的风味、颜色、质地以及营养等品质[13]。同时,有研究报道糖基化反应也能够对蛋白质的免疫原性产生影响。谭振等[14]在65 ℃、75%相对湿度,蛋白质与糖的摩尔比为1∶14的条件下处理60 h,大豆球蛋白的免疫原性约降低80%。杨峥等[15]发现,牛乳蛋白与低聚糖糖基化后,其免疫原性可降低15%。Bu等[16]发现,β-乳球蛋白与葡萄糖以1∶2.59的比例,在51.8 ℃处理75.7 h,可降低β-乳球蛋白99.68%的致敏性。Lagemaat等[17]采用低聚果糖对大豆分离蛋白进行糖基化,在95 ℃加热1 h可减少其90%的免疫原性。所以,采用糖基化法降低白果蛋白致敏性是可行的。同时,紫外吸收光谱、荧光发射光谱和圆二色谱等仪器分析已经被用于检测蛋白糖基化效果,并用于探究糖基化对蛋白结构的影响[16,18-21]。
因此,本文以免疫原性降低程度为优化指标,优化GSP糖基化参数,并借助紫外吸收光谱、荧光发射光谱和圆二色谱分析免疫原性降低和GSP结构变化之间的关联。
1 材料与方法
1.1 材料与仪器
白果 由江苏大学药学院鉴定及保存;小鼠 由江苏大学动物实验中心提供(SYXK(Jiangsu)2013-0036);辣根过氧化物酶标记羊抗鼠IgG 上海碧云天生物技术有限公司;Bovine serum albumin Sigma Company;其他化学试剂 均购自国药集团化学试剂有限公司。
Sartorius万分之一电子天平 北京赛多斯依稀系统有限公司;7200型分光光度计 上海天达仪器有限公司;瓦里安Cary100型紫外分光光度计 美国瓦里安技术有限公司;CARY ECLIPSE型荧光分光光度计 美国瓦里安技术有限公司;JASCO J-815型圆二色谱 日本分光公司;3110-P1000型移液枪 德国Eppendorf;HVE-50高压灭菌锅 HIPRYAMA制造公司;冷冻离心机BR-4 法国JOUAN公司。
1.2 试验方法
1.2.1 GSP的制备 GSP的制备参考杨剑婷等[7]的方法,并略作改动。白果去果壳,冷冻干燥36 h后,研磨成粉,并过40目筛,得到白果粉。使用石油醚对白果粉进行脱脂,重复3~4次,直到白果粉呈白色后,自然沉降,弃去上层石油醚。待石油醚完全挥发,将脱脂的白果粉与TBS(tris buffered saline,0.2 mol/L,pH=7.4)按1∶10 (m/v)的比例混合,4 ℃搅拌24 h,5000 r/min离心15 min,得到上清液。在上清液内加入硫酸铵,提取硫酸铵饱和度在40%~80%的蛋白,5000 r/min离心30 min,得到沉淀蛋白。在沉淀蛋白内加入适量TBS(0.01 mol/L pH=8.0),使用3.5 kDa透析袋,于0.01 mol/L pH=8.0的TBS中4 ℃透析24~36 h。将脱盐后的GSP溶液进行冷冻干燥,并于-20 ℃保存。
1.2.2 抗GSP血清的制备 取20只健康雄性KM小鼠,6~8周,体重在18~22 g。经过一周适应期后,随机挑选15只作为GSP组,其余5只作为阴性对照组。配制100、200 mg/mL GSP溶液分别作为GSP组的致敏剂和激发剂,以0.2 mol/L pH=7.4 TBS做为阴性对照组的致敏剂和激发剂。GSP组在第1、7、14 d,以30 μL/g体重的致敏剂进行灌胃致敏,并在第21 d以相同计量进行激发;阴性对照组在相同时间,以相同剂量进行致敏和激发。两组在激发后1 h进行眼眶取血,室温静置3 h后,在4 ℃以1000 r/min离心10 min获取血清。取5 mL血清与等量的生理盐水混合,缓慢加入硫酸铵至终浓度为20%,充分混合后,4 ℃放置30 min后,于3000 r/min离心20 min,弃沉淀。上清液中继续加硫酸铵至浓度为50%,4 ℃放置30 min,经5000 r/min离心30 min,将收集的沉淀复溶于10 mL的生理盐水中。然后,加入硫酸铵至终浓度为33%,4 ℃放置30 min,后于3000 r/min离心20 min,沉淀以33%饱和度的硫酸铵溶液洗涤2次后,溶解于10 mL生理盐水中,置于透析袋中在生理盐水中透析过夜,随后收集血清,用于IgG测定。
1.2.3 酶联免疫吸附(ELISA,enzyme-linked immunosorbent)检测法的建立 采用间接ELISA测定lgG。ELISA的制备方法如下:a.样品用PBS(1/15 mol/mL pH=8.0)配制为50 μg/mL,每孔加入100 μL,37 ℃孵育2 h,用PBST(含0.05% Tween-20的PBS)洗板5次,每次3 min;b.每孔加入200 μL封闭液BPBST(含1%BSA、0.05% Tween-20的PBS),湿盒中37 ℃孵育2 h,后同上洗板;c.每孔加入100 μL稀释400倍的血清,37 ℃孵育2 h,同上洗涤;d.每孔加入100 μL稀释200倍的羊抗鼠IgG-HRP二抗,同上洗涤;e.加入适量底物DAB于37 ℃显色30 min,每孔加入50 μL 2 mol/L的H2SO4终止反应,使用酶标仪上检测450 nm下吸光值。阴性对照用PBS代替样品。
1.2.4 GSP糖基化反应的工艺优化 使用PBS将GSP配制为2 mg/mL的样品液。固定糖基化条件为蛋白与葡萄糖比例1∶3、糖基化温度70 ℃、糖基化时间40 min,改变其一设计单因素实验,采用ELISA检测法检测GSP免疫原性,分别研究蛋白与葡萄糖比例(1∶1、1∶2、1∶3、1∶4、1∶5)、糖基化温度(30、50、70、90、120 ℃)及糖基化时间(10、30、60、90、120 min)对GSP免疫原性的影响。
1.2.5 接枝度的测定 采用邻苯二甲醛[22](OPA)方法检测接枝度(DG)。首先,称取40 mg OPA,溶解于1 mL甲醇中,加入2.5 mL 20% SDS溶液、25 mL 0.1 mol/L硼砂溶液及100 μLβ-琉基乙醇,用蒸馏水定容50 mL。将200 μL的样品溶液(蛋白含量为2 mg/mL)加入到4 mL OPA试剂中涡旋振荡,35 ℃下反应2 min,在340 nm下检测吸光值,来计算游离氨基含量。样品接枝度的计算如下:
式中:A0表示GSP与葡萄糖以一定比例混合后立即在340 nm的吸光值;A1表示GSP与葡萄糖进行接枝反应后在340 nm的吸光值。
1.2.6 褐变程度的测定 使用0.1% SDS溶液将样品溶液稀释至蛋白质量分数为0.2%,10000 r/min离心20 min除去不溶物,以不加样品的SDS溶液做空白,采用分光光度计在420 nm下测定吸光度A420,以A420表示褐变强度[23]。
1.2.7 紫外光谱的测定 采用单因素优化后的参数对GSP进行糖基化反应,其样品溶液以10000 r/min离心20 min除去不溶物。采用Bradford法测定水溶蛋白含量[24],使用PBS将糖基化和未糖基化样品稀释为1 mg/mL。用紫外分光光度计在200~350 nm波长范围下扫描各样品。
1.2.8 荧光光谱的测定 采用单因素实验优化后的参数对GSP进行糖基化反应,其样品溶液以10000 r/min离心20 min除去不溶物,使用PBS将糖基化和未糖基化样品稀释为1 mg/mL。在激发波长为280 nm,发射波长300~450 nm,激发狭缝宽为5 cm,发射狭缝宽为2.5 cm条件下扫描各样品。
1.2.9 圆二色谱的测定 采用单因素实验优化后的参数对GSP进行糖基化反应,其样品溶液以10000 r/min离心20 min除去不溶物,使用PBS将糖基化和未糖基化样品稀释为1 mg/mL。在常温(25±1) ℃下,扫描速度为50 nm/min,扫描波长范围为190~250 nm,样品池光程为0.1 nm,灵敏度为100 mdeg/cm。用平均摩尔椭圆率[θ]来表示CD数据,单位为deg·cm2·dmol-1,进行圆二色谱分析。通过CDPro软件分析CD色谱图数据,采用CON-TIN/LL算法计算蛋白质中各二级结构α-螺旋、β-折叠、转交及无规则卷曲的含量。
1.3 数据处理
每个实验重复三次,取平均值作为最终结果。采用SPSS软件,ANOVA 法评估数据的差异显著性,差异性水平设定为p<0.05。
2 结果与讨论
2.1 免疫期间血清内IgG含量变化
图1为免疫期间血清内IgG含量的变化。如图1所示,经白果蛋白免疫和激发,小鼠体内IgG水平显著升高(p<0.05),说明白果蛋白具有免疫原性。同时,血清内产生的IgG可作为体外白果蛋白免疫原性变化的检测一抗。

图1 免疫期间血清内IgG含量的变化
2.2 不同蛋白与葡萄糖比例的糖基化对GSP免疫原性的影响
由图2a可以看出,蛋白/糖比例为1∶1、1∶2、1∶3、1∶5、1∶10时,相对蛋白糖比为1∶0时,GSP免疫原性分别降低了15.31%、20.24%、35.10%、36.42%和34.45%。随着葡萄糖的比例逐渐增加且蛋白/糖比例未超过1∶3时,GSP免疫原性随着葡萄糖比例增加明显下降。由于葡萄糖比例增大,反应体系粘度上升,分子流动性和扩散性变差,蛋白与葡萄糖糖空间阻碍变大,则反应程度降低,影响接枝反应[25]。蛋白/糖达到1∶3、1∶5、1∶10时,GSP的免疫原性则无显著性差异,稳定在葡萄糖比例为1∶3的水平。
由图2b所示,增加葡萄糖且蛋白/糖比例不超过1∶3时,接枝度随着葡萄糖添加量增加显著升高,并在蛋白/糖比为1∶3时达到最高值25.20%。继续增加葡萄糖含量,则引起反应体系粘度增加,而不利于接枝反应,故蛋白/糖比例达到1∶5、1∶10时,接枝度显著降低(p<0.05)。但GSP褐变程度未随着葡萄糖添加量增加而加深,说明70 ℃反应40 min并不会引起GSP与葡萄糖出现明显美拉德褐变。
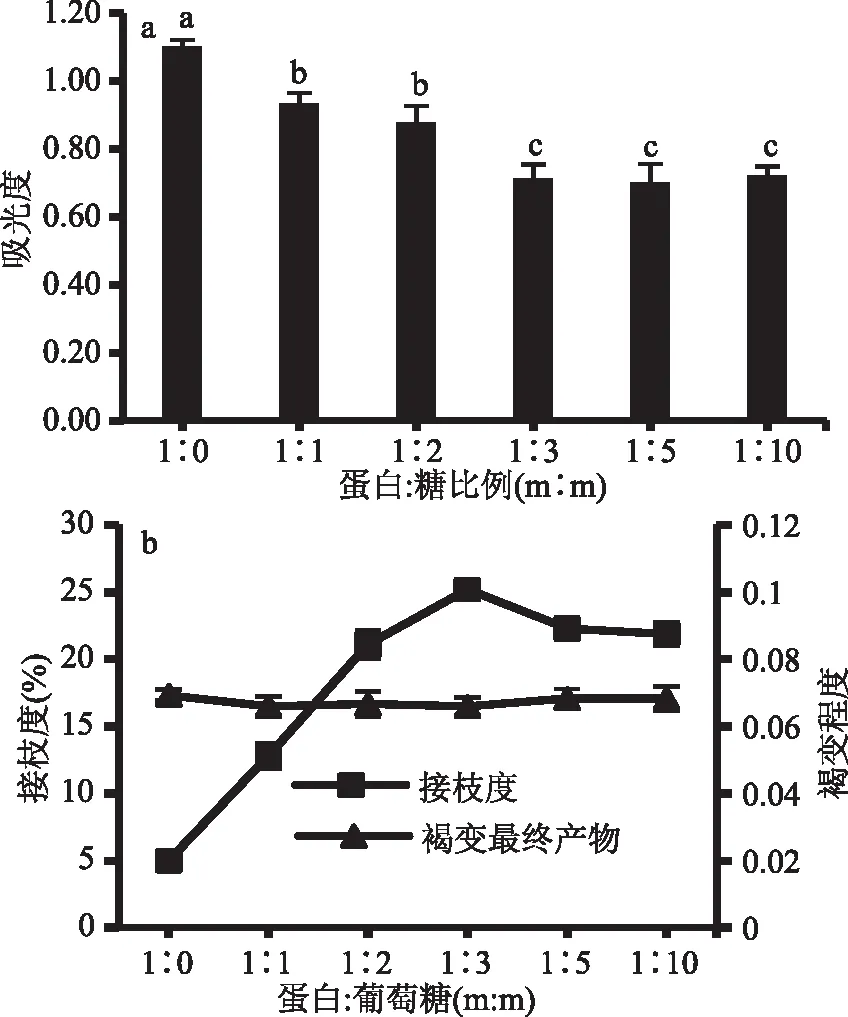
图2 不同的蛋白/糖比例对GSP免疫原性及接枝度和褐变程度的影响
因此,结合GSP免疫原性降低程度和接枝程度,确定GSP/葡萄糖比例为1∶3。
2.3 不同糖基化温度对GSP免疫原性的影响
如图3a所示,糖基化温度为30、50、70、90、120 ℃时,相比室温,GSP免疫原性分别降低了0.08%、3.60%、37.86%、43.14%和60.04%。如图3b所示,在0~90 ℃范围内,随着糖基化温度增加,GSP-葡萄糖复合物的接枝度逐渐增加,并在90 ℃达到峰值28.7%,且未发生明显褐变。当温度达到120 ℃时,GSP-葡萄糖复合物的接枝度出现显著下降(p<0.05),并发生显著褐变(p<0.05),这可能是由于反应过程中较高的温度可以提供更多的能,使反应的速度加快,导致褐变强度增加[26]。糖基化温度为120 ℃时,GSP的免疫原性最低,但严重褐变引起的絮凝沉淀会降低GSP消化吸收率[27]。因此,选择90 ℃作为较佳糖基化温度。

图3 不同糖基化温度对GSP免疫原性及接枝度和褐变程度的影响
2.4 不同糖基化时间对GSP免疫原性的影响
如图4a所示,相对未糖基化GSP,糖基化时间为10、30、60、90、120 min,GSP免疫原性分别降低了6.10%、30.52%、53.40%、54.08%和57.92%。在60 min内,随着糖基化时间增加,GSP免疫原性逐渐降低。当糖基化时间达到60 min以后,GSP免疫原性变化不显著。如图4b所示,GSP-葡萄糖复合物的接枝度在0~60 min内,随着糖基化时间增加,其接枝度逐渐增加,并在60 min达到峰值30.1%。当糖基化时间超过90 min时,接枝度随着时间增加而降低。同时,在60 min内糖基化反应未引起明显褐变,但糖基化时间达到90 min时,糖基化会引起严重褐变。长时间糖基化引起蛋白质发生变性聚集,导致反应基团包裹在分子内部,且蛋白空间结构中存在大分子立体效应,进而影响接枝物的生成[28]。所以,较佳的糖基化时间为60 min。

图4 不同糖基化时间对GSP免疫原性及接枝度和褐变程度的影响
2.5 紫外吸收光谱结果
蛋白质的紫外吸收光谱(250~350 nm)与蛋白内色氨酸、酪氨酸和苯丙氨酸含量密切相关,故波长250~350 nm处的紫外吸收光谱图可显示蛋白质分子的构象变化[29]。对糖基化GSP样品和未糖基化蛋白样品进行紫外吸收检测,结果如图5所示。经糖基化的GSP和未糖基化GSP在280 nm均有吸收峰,且糖基化可以明显增加GSP在280 nm处的吸光值,说明糖基化引起白果蛋白构象变化。由于蛋白质经糖基化修饰后,其蛋白质的三级结构发生了改变,一方面可能引起疏水基团暴露,另一方面修饰基团也可能使酪氨酸、苯丙氨酸等紫外吸收氨基酸残基暴露,故糖基化能够增加280 nm处的吸光值[21,30]。同时,糖基化GSP较未糖基化GSP在280 nm有较强吸收值,也可能部分缘于蛋白质糖基化可以产生轻甲基糠醛,而其在280 nm附近也有紫外吸收[31]。所以,白果蛋白的特征基团被糖基化反应改变,其抗原表位可能也被影响,进而降低白果蛋白免疫原性。

图5 糖基化反应对GSP紫外吸收的影响
2.6 内源荧光发射光谱结果
内源荧光光谱是检测过敏原蛋白质三级结构的常用方法。用280 nm波长光激发时,蛋白质的酪氨酸、苯丙氨酸和色氨酸残基受到激发,这些氨基酸残基的激发能以荧光形式发射出来[32]。处于蛋白质分子表面的发色氨基酸残基具有350~353 nm的荧光发射峰,而包埋于蛋白质分子内部的荧光发射峰在326~332 nm之间[33]。由图6可以看出,GSP的荧光发色基团主要在其表面,且其经糖基化后,GSP在340 nm的最大吸收峰减小,说明糖基化反应减少了表面荧光发射基团数量,改变白果蛋白三级结构,故其抗原表位改变而免疫原性降低。
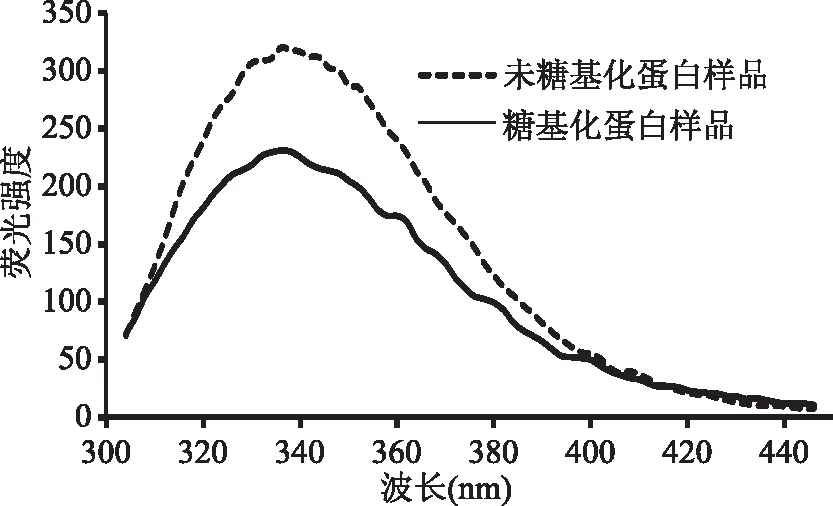
图6 糖基化反应对GSP的内源荧光发射强度影响
2.7 圆二色谱结果
圆二色谱是一种测定溶液中蛋白质和多肽二级结构的灵敏技术。蛋白质圆二色光谱的远紫外区属于肽键吸收范围,反映了蛋白质主链的构象,能直接测定蛋白质的二级结构。通常α-螺旋在靠近192 nm有一正的谱带,在208、222 nm处有2个负的肩峰谱带;β-折叠在216 nm处有一负谱带,在185~200 nm有一正谱带;β-转角在206 nm附近有一正谱带;无规则卷曲在200 nm附近有一负峰,在210~230 nm有一正谱带[34]。由图7可见,未糖基化GSP在192 nm有一个正吸收峰,在208 nm有一个负吸收峰。当GSP进行糖基化反应后,原有正吸收峰发生蓝移,负吸收峰则发生红移,且两者强度均有变化,说明糖基化改变了GSP的二级结构,并影响白果蛋白的抗原表位。由表2可见,糖基化反应增加了GSP的α-螺旋和无规则卷曲含量,减少了β-折叠和转角含量。这可能是由于共价引入单糖链,引起的空间位阻效应会抑制蛋白质分子间的聚集,使蛋白质分子空间结构发生变化,导致无规卷曲含量增加[35]。所以,白果蛋白免疫原性的降低可能缘于糖基化反应改变了白果蛋白二级结构和抗原表位。

表2 糖基化后GSP二级结构的变化Table 2 The change about the secondary structure of GSP after glycosylation

图7 糖基化反应对GSP二级结构的影响
3 结论
采用糖基化的方法降低GSP免疫原性,在保证高效接枝度并防止剧烈褐变的前提下,单因素实验优化得到的较佳参数为:蛋白/糖比例为1∶3,糖基化温度为90 ℃,糖基化时间为60 min,且此工艺能有效降低GSP约54%的免疫原性。同时,GSP经糖基化后,其紫外吸收的增加、内源荧光发射的降低以及二级结构的变化,说明糖基化通过暴露GSP的紫外吸收基团,屏蔽荧光发射基团,改变蛋白质三级结构,进而改变GSP的抗原表位,降低其免疫原性。

