全身放射治疗对宫颈癌荷瘤小鼠肿瘤微环境免疫细胞诱导协同刺激分子及其配体的影响
龚 星 田 添 梁素美*
放射治疗是临床治疗恶性肿瘤的主要手段,但会引起脱氧核糖核酸(deoxyribonucleic acid,DNA)的破坏、信号转导通路异常以及影响机体免疫功能,肿瘤通过异常抗原实现免疫逃逸,因此改变肿瘤免疫应答对治疗肿瘤起着重要作用[1]。
T淋巴细胞在机体的细胞免疫和体液免疫中都发挥着重要作用,T细胞可分化为不同功能的T细胞,其中调节性T细胞(Treg)参与肿瘤的免疫逃逸和迁移、侵袭[2]。Th2细胞分泌白介素10(interleukin-10,IL-10)等细胞因子,起到免疫抑制的作用[3]。
近年来的研究显示,T细胞的活化和分化受到可诱导协同刺激分子(inducible costimulator,ICOS)及其配体(inducible costimulator ligand,ICOSL)的调节,电离辐射会影响ICOS及ICOSL的表达水平,但关于放射治疗对免疫细胞以及ICOS和ICOSL的研究极少[4]。为此,本研究主要探究全身放射治疗对宫颈癌荷瘤小鼠肿瘤微环境免疫细胞ICOS/ICOSL的影响,为临床更好的利用放射治疗提供依据。
1 材料与方法
1.1 实验动物与材料
选用4~5周龄的所有BALB/c无胸腺裸鼠(中国医学科学院上海实验动物中心),平均体质量为(20±2)g。实验瘤株子宫颈未分化鳞癌细胞系U14(中国医学科学院北京药物研究所);所有引物均获自Genewiz中国江苏苏州公司。
1.2 仪器与试剂
采用XHA600C型医用电子直线加速器6 MV X射线(山东新华医疗),Varioskan Flash全波长扫描式多功能读数仪(美国Thermo Scientific公司);BD FACSCalibur流式细胞仪(美国Becton Dickerson公司)。Becton-Dickinson试剂盒(美国Becton-Dickinson公司);ECL化学发光法检测试剂(上海榕柏生物);逆转录试剂盒(日本TaKaRa公司,D6110A);流式细胞术试剂盒(南京凯基生物科技有限公司)。聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Bio-Rad实验室)。
1.3 建模及放射治疗方法
采用数表法将45只小鼠随机分为对照组、模型组和放疗组,每组15只。将U14细胞分离并在新鲜培养基中再生长1 d。模型组和放疗组小鼠皮下注射(1.0鼠皮下6个)U14细胞,在第4 d左右瘤体可生长至1 cm3左右,并通过病理学检查确定为宫颈未分化鳞癌。对照组皮下注射等量0.9%氯化钠注射液,不进行治疗。在第4 d放疗组小鼠接受全身放射治疗,每日照射剂量为700 cGy,剂量率为50 cGy/min,每日1次。建模后每2 d用卡尺测量小鼠皮下肿瘤体积,测量肿瘤垂直直径(长、宽,L>W),肿瘤体积(V)计算为公式1:

在建模后12 d脱颈处死,取小鼠的胸腺、脾脏及肿瘤组织进行后续检测。
1.4 免疫印迹检测
使用蛋白质印迹(Western Blotting)检测小鼠胸腺(1/3个胸腺)中ICOS、ICOSL蛋白以及肿瘤组织中基质金属蛋白酶2(MMP2)和MMP9的水平。Varioskan Flash全波长扫描式多功能读数仪绘制标准曲线并计算样品蛋白浓度,然后进行12%SDS-PAGE聚丙烯酰胺凝胶电泳,将电泳后凝胶上的蛋白质转移至PVDF膜上,对PVDF膜进行免疫印迹检测,并在室温下用5%脱脂奶粉溶液室温孵育封闭1 h。加入双抗后室温下孵育PVDF膜后脱色,加入电化学发光法检测试剂,转印膜上的电化学发光信号在X光胶片上感光,用IPWIN6.0软件分析结果。
1.5 qRT-PCR检测
使用[定量实时逆转录(quantitative real time,qRT)-聚合酶链反应(polymerase chain reaction,PCR),qRT-PCR]检测小鼠胸腺(1/3胸腺)中ICOS、ICOSL以及肿瘤组织中MMP2和MMP2及其mRNA的水平。组织研磨后使用RNA分离试剂盒分离RNA,使用逆转录试剂盒对RNA样品进行逆转录测定以合成cDNA。逆转录反应条件为37 ℃,反应15 min,逆转录酶失活条件为85 ℃,反应15 s;后进行实时荧光定量PCR实验,通过在95 ℃下激活DNA聚合酶5 min进行PCR,然后进行40个循环的两步PCR(95P、10 s和60 ℃、30 s),最终延伸75 ℃、10 min,保持在4 ℃。使用2-ΔΔCT法分析mRNA表达水平。
1.6 流式细胞术检测
使用流式细胞术检测胸腺和脾脏(1/3胸腺+1/3脾脏)中Th1、Th2和Treg细胞含量。将1×106细胞加入PE-CD25抗体、FITC-CD4抗体、PE-Cy5-FOXP3以及相应的对照Fc block、PE-Cy5-IgG2a,在4℃下避光孵育15~30 min,通过使用流式细胞仪立即分析染色的细胞。使用CellQuest软件分析,根据检测的CD4+CD25+FOXP3+细胞的数量计算Treg细胞的百分比。
使用流式细胞术检测Th1、Th2细胞,细胞计数将2×105个细胞加入流式管,分别使用CD3-PE Cy5、CD8-PE Cy7抗体各 4 μl细标记,避光孵育15 min,再使用IFN-γ-FITC、IL-4-PE标记,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗,后使用流式细胞仪检测,CD3+CD4+IFN-γ+为Th1细胞,CD3+CD4+IL-4+为Th2细胞,记录Th1、Th2细胞百分比。
1.7 统计学方法
使用SPSS19.0软件对所有实验数据进行统计分析,计量资料以均值±标准差(±s)表示。统计分析,进行单因素方差分析(ANOVA)和独立样本t检验(groupt-test),评估各组之间的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤体积比较
在建模后第4 d,模型组和放疗组小鼠的肿瘤体积达到1 cm3左右,随即放疗组开始放射治疗。模型组小鼠的肿瘤体积随着建模时间的延长显著升高,在建模后第6 d、8 d、10 d和12 d,放疗组小鼠的肿瘤体积显著低于模型组,差异有统计学意义(F=56.405,P=0.000),见表1和图1。

图1 小鼠肿瘤体积变化情况
2.2 三组MMP2和MMP9比较
模型组的MMP2蛋白和MMP9蛋白水平显著高于对照组,差异有统计学意义(F=2.461,F=0.393,P=0.000);放疗组的MMP2和MMP9mRNA的水平显著低于模型组,差异有统计学意义(F=1.590,F=0.601;P=0.000),见表2。
2.3 三组免疫细胞比较
模型组的Th1细胞比例显著降低,而Treg和Th2细胞比例显著升高,放疗组的Th1细胞比例显著高于模型组,而Treg和Th2细胞比例显著低于模型组,差异有统计学意义(F=2.427,F=3.349,F=9.951;P=0.000),见表3。
2.4 三组ICOS/ICOSL水平比较
模型组的ICOS蛋白和ICOSL蛋白的水平显著高于对照组,差异有统计学意义(F=2.837,F=3.576;P=0.000);放疗组的ICOS、ICOSLmRNA的水平显著低于模型组,差异有统计学意义(F=0.793,F=3.750;P=0.000),见表4。
表1 模型组与放疗组小鼠肿瘤体积比较(cm3,±s)
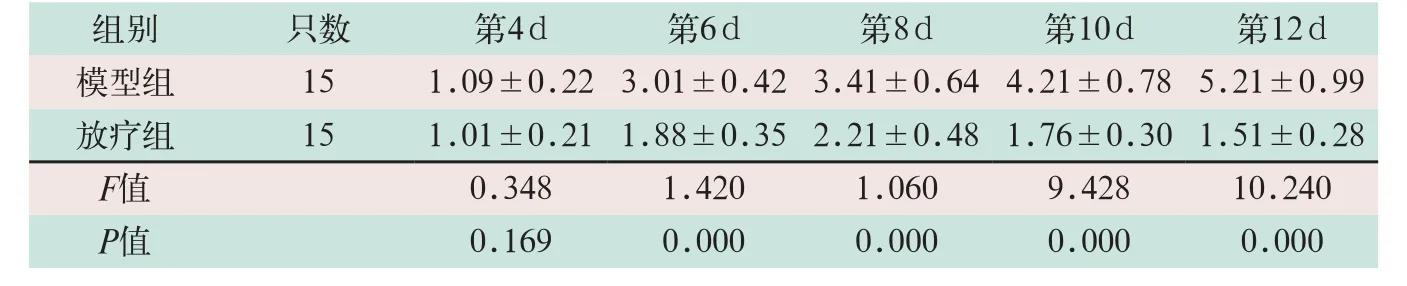
表1 模型组与放疗组小鼠肿瘤体积比较(cm3,±s)
注:由于对照组肿瘤体积都为0,模型组和其对比是为了表明建模成功,故此表只统计模型组和放疗组
组别 只数 第4 d 第6 d 第8 d 第10 d 第12 d模型组 15 1.09±0.223.01±0.423.41±0.644.21±0.785.21±0.99放疗组 15 1.01±0.211.88±0.352.21±0.481.76±0.301.51±0.28 F值 0.348 1.420 1.060 9.428 10.240 P值 0.169 0.000 0.000 0.000 0.000
表2 三组MMP2和MMP9比较(±s)
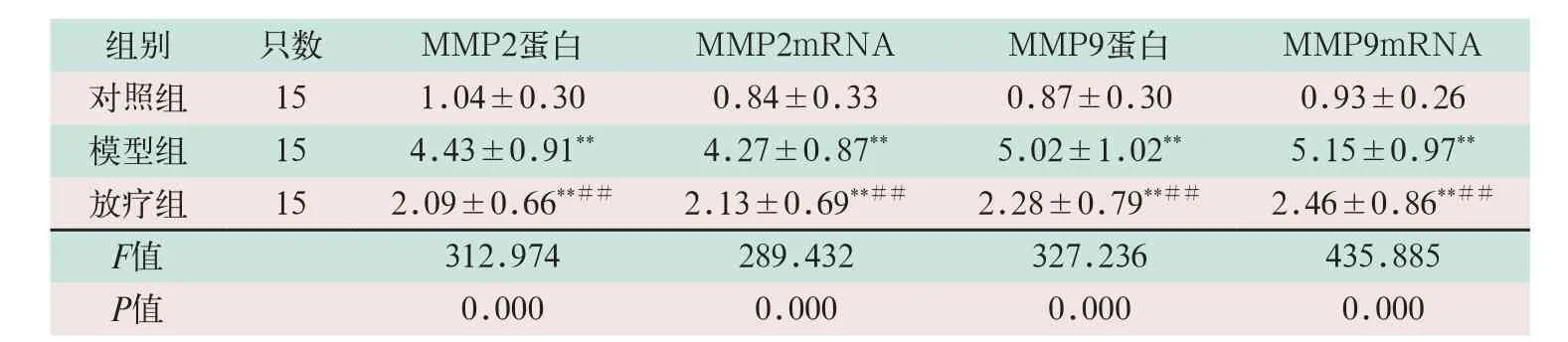
表2 三组MMP2和MMP9比较(±s)
注:表中*为与对照组比较,P<0.05;**为与对照组比较,P<0.001;#为与模型组比较,P<0.05;##为与模型组比较,P<0.001
组别 只数 MMP2蛋白 MMP2mRNA MMP9蛋白 MMP9mRNA对照组 15 1.04±0.30 0.84±0.33 0.87±0.30 0.93±0.26模型组 15 4.43±0.91** 4.27±0.87** 5.02±1.02** 5.15±0.97**放疗组 15 2.09±0.66**## 2.13±0.69**## 2.28±0.79**## 2.46±0.86**##F值 312.974 289.432 327.236 435.885 P值 0.000 0.000 0.000 0.000

表3 三组免疫细胞比较(%)
表4 三组ICOS/ICOSL水平比较(±s)
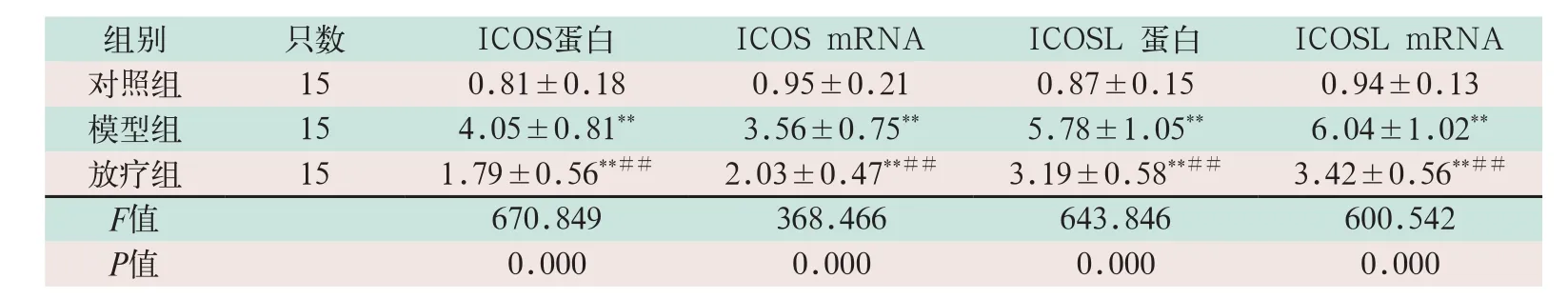
表4 三组ICOS/ICOSL水平比较(±s)
注:表中*为与对照组比较,P<0.05;**为与对照组比较,P<0.001;#为与模型组比较,P<0.05;##为与模型组比较,P<0.001
组别 只数 ICOS蛋白 ICOS mRNA ICOSL 蛋白 ICOSL mRNA对照组 15 0.81±0.18 0.95±0.21 0.87±0.15 0.94±0.13模型组 15 4.05±0.81** 3.56±0.75** 5.78±1.05** 6.04±1.02**放疗组 15 1.79±0.56**## 2.03±0.47**## 3.19±0.58**## 3.42±0.56**##F值 670.849 368.466 643.846 600.542 P值 0.000 0.000 0.000 0.000
3 讨论
宫颈癌是最常见的妇科肿瘤,据报道,世界每年有近500,000例新发宫颈癌病例,是女性第三大常见癌症,可分为鳞癌、腺癌和腺鳞癌三种类型,而宫颈癌的转移是临床治疗的难点[5]。早期发现宫颈癌通常可治愈,但是多数患者在诊断时出现局部晚期宫颈癌,其中III期和IVa期宫颈癌患者的5年生存率分别为40%和15%[6]。基于顺铂的放射治疗(combination radiotherapy,CRT)被认为是局部晚期宫颈癌患者的标准治疗方法,而近年来以放射治疗为主的综合治疗越来越受到关注,使放射治疗抑制肿瘤细胞转移的机制以及放射治疗解除肿瘤免疫逃逸的机制备受重视。本研究使用U14细胞荷瘤裸鼠作为模型进行全身放射治疗,其结果显示,在建模后第4 d模型组和放疗组的肿瘤体积达到1 cm3左右,并开始接受全身放射治疗,模型组小鼠的肿瘤体积随着建模时间的延长显著升高,在建模后第6 d、8 d、10 d和12 d,放疗组的肿瘤体积显著低于模型组,表明全身放射治疗可显著的抑制肿瘤的生长。
肿瘤的迁移和侵袭与许多酶的过度表达有关,MMP2、MMP9是基质金属蛋白酶家族的重要组成部分,可以水解细胞间基质蛋白,使细胞具有转移能力[7-8]。本研究结果显示,模型组的MMP2和MMP9水平显著高于对照组,放疗组的MMP2和MMP9蛋白和mRNA的水平显著低于放疗组。Ager等[9]研究显示,抑制MMP的表达可以提高放射治疗的治疗效果,提示全身放射治疗可在一定程度上抑制肿瘤细胞的转移。
肿瘤浸润和转移与肿瘤的微环境改变、血管生成、上皮间充质转化及免疫反应等有关。Th2细胞会通过分泌IL-4、IL-10等因子发挥免疫抑制作用并促进细胞生长[10]。Treg水平的升高会抑制免疫,并影响细胞功能参与肿瘤发生和发展[11]。本研究结果显示,模型组的Th1细胞比例显著降低,而Treg和Th2细胞比例显著升高,放疗组的Th1细胞比例显著高于模型组,而Treg和Th2细胞比例显著低于模型组。Th1/Th2细胞处于动态平衡中,Th1和Th2分别参与促炎和免疫抑制的作用[12]。Th1细胞占主要优势时机体处于抗肿瘤状态,而Th2细胞过高时则出现免疫逃逸。过往研究显示,卵巢癌患者Th1/Th2平衡向Th2漂移,而Treg具有促进Th1/Th2平衡向Th2漂移的作用[13-14]。
为进一步的探究放射治疗影响免疫细胞的机制,本研究分析了ICOS/ICOSL的表达水平,其结果显示,模型组的ICOS和ICOSL的水平显著高于对照组,放疗组的ICOS和ICOSL蛋白和mRNA的水平显著低于模型组。ICOS/ICOSL表达于肿瘤细胞的表面,影响Treg细胞表达和促进Th2活化,使肿瘤逃避机体的免疫系统,Zheng等[15]研究显示,ICOS/ICOSL可通过调节Treg细胞提高B淋巴瘤细胞对ABT-199的敏感性;Kieusuong等[16]研究表明,Treg的产生与ICOS/ICOSL的结合有关,靶向ICOS/ICOSL途径调节Treg细胞可能是一种有前景的治疗滤泡性淋巴瘤免疫疗法。
全身放射治疗可有效的抑制宫颈癌荷瘤小鼠肿瘤组织的生长,放射治疗一方面通过下调MMP2和MMP9表达水平抑制肿瘤细胞迁移,另一方面通过抑制ICOS和ICOSL的表达水平下调Treg细胞和Th2细胞的比例,从而解除免疫逃逸起到抑瘤作用。

