三维能量多普勒超声联合超声乳腺影像报告和数据系统在乳腺良恶性病灶鉴别诊断中的应用价值
刘志燕 伍玉晗
近年来,乳腺癌的发病率逐年升高,如何通过无创和可重复性的检测早期诊断乳腺癌,在医院中日益受到重视。美国放射学会采用的超声乳腺影像报告和数据系统(breast imaging-reporting and data system,BI-RADS),对乳腺病灶的分级诊断由于其术语的规范性而显著提高了乳腺超声检查的诊断特异性和敏感性[1]。但对于良恶性指标的分级仍然存在着诸多争议,在病理细节上无较好的指导性,尤其良性(3级)和恶性(4级)间的界限存在较多争议,且病灶周围的血管特性无任何特殊表现,因此对于乳腺良、恶性病灶的诊断仍存在着很大的难度。
能量多普勒超声是近年来出现的新技术,能显著地显示病灶组织附近的血管与血流量的变化,并能提供病灶部位与血管相关的量化指标[2]。在此基础上进行的三维能量多普勒超声(three-dimensional energy Doppler ultrasound,3D-PDS)进行血管网的三维重建,并计算三维能量多普勒血流参数,能形象直观地观察其空间立体结构,显著提高对病灶组织的鉴定,具有重要的参考价值[3]。目前,临床上已逐渐将两者结合使用,而联合3D-PDS技术和超声BI-RADS对乳腺病灶的良恶性诊断报道较少,为此,本研究对两种技术联合应用对临床诊断的准确性、敏感性和特异性等综合分析,旨在为临床应用提供可靠的依据。
1 资料与方法
1.1 一般资料
回顾性收集2013年9月至2017年9月在宜昌市妇幼保健院做超声检查的乳腺肿瘤疾病患者资料,并通过穿刺活检得到明确病例诊断的70例女性患者,年龄15~83岁,平均年龄(43.79±12.38)岁。根据穿刺活检已明确病理诊断,将其分成良性病灶组(14例)及恶性病灶组(56例),另选取10名健康志愿女性纳入正常组,分别对3组单独进行3D-PDS和BI-RADS检查及联合检查的结果分析。本研究经医院伦理委员会批准,并获得所有患者知情同意。
1.2 仪器设备
采用GE-E8型彩色多普勒超声诊断仪(美国GE公司);Vivid E95型三维能量多普勒超声诊断仪(美国GE公司),三维容量探头,探头频率为4.0~8.0 MHz。
1.3 检查方法
(1)常规超声检查:患者取仰卧位,双上肢平放于身体两侧,充分暴露双侧乳房。根据患者乳腺及肿块的形状、位置特点,调整超声仪器参数,按BIRADS分级标准,记录病灶的形状、方位、边界、边缘、回声类型、后方回声、钙化、周围组织以及血管分布等方面信息。
(2)3D-PDS模式:采用具有三维线性的探头进行检测,调节仪器设置,对病灶区域进行三维扫描,获得血管分布、血管形态、是否有穿入血管及血流丰富程度的信息,并通过探头机械旋转得到病灶区域血流分布的立体图。由虚拟器官计算机辅助分析(virtual organ computer aid analysis,VOCAL)软件对3D-PDS的半定量参数进行计算分析,包括血管化指数(viscosity indicator,VI)、血流指数(flow index,FI)及血管化血流指数(viscosity indicator,VFI)等,分别测定三次取平均值。其中VI为组织内的血管;FI为三维扫描时间内的血流强度;VFI是展示彩色比重值的血管和血流信息的结合,是血流和血管的总和。
所有检查及数据处理均由同一名医师在相同条件下由同一台3D-PDS诊断仪完成。
1.4 观察与评价指标
(1)BI-RADS超声诊断标准:①0级,不能全面评价病变,需要其他影像学检查评价;②1级,超声未见异常;③2级,考虑良性改变,基本可以排除恶性,6~12个月复查;④3级,良性病变可能,恶性的危险性<3%,3~6个月复查;⑤4级,考虑恶性病变可能,恶性的危险性为3%~94%;⑥5级,高度怀疑为恶性病变,恶性的危险性≥95%;⑦6级,已经病理学证实为恶性病变。
(2)3D-PDS半定量参数分析:①VI为组织内的血管;②FI为三维扫描时间内的血流强度;③VFI展示彩色比重值的血管和血流信息的结合,是血流和血管的总和。分别测定3次取平均值。
1.5 统计学方法
采用SPSS17.0软件进行统计学分析,比较单独应用超声BI-RADS、3D-PDS以及两种方法联合使用对于良、恶性鉴别的诊断效能,计数资料一致性检验采用x2检验,计量资料差异性检验采用F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 BI-RADS超声特征分析
乳腺良恶性病灶BI-RADS超声的特征分析显示,良恶性乳腺病灶在形状、方位、边缘、边界及钙化方面均出现了显著性差异,其差异有统计学意义(x2=53.030,x2=28.047,x2=10.938,x2=3.970,x2=10.190;P<0.05);而回声类型并未出现显著性差异,无统计学意义(x2=1.244,P>0.05),见表1。

表1 乳腺良恶性病灶超声乳腺影像报告与数据系统分类特征
本研究病例中可发现形状、方位及钙化的指标区分可看出与恶性征象有关,而边界的清晰度和回声的类型在良恶性征象间并未出现明显区别,差异性不大,其中恶性乳腺病灶相较于良性病灶,多表现为不规则的形状,皮肤方向生长杂乱,边缘不完整,与周围组织分界模糊;对于回声类型并未表现出明显的低回声,见图1和图2。
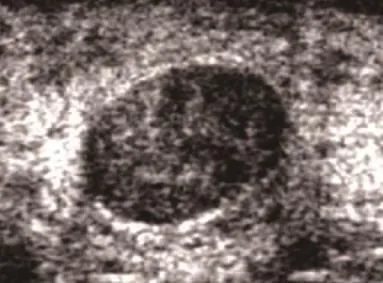
图1 纤维腺瘤影像

图2 疑似浸润性导管癌影像
2.2 3D-PDS检测半定量参数分析
从3D-PDS彩图可以看出良性乳腺血管丰富,且分布均匀,形态规则,周边及中心均可见血管,对低速血流及细小血管有高敏感性;而恶性乳腺病灶部位的血管分支扭曲, 分布杂乱无章,见图3。
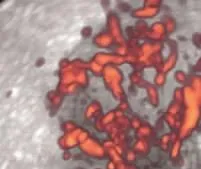
图3 3D-PDS获得的恶性乳腺病灶的血管三维图像
通过VOCAL软件对检测结果进行定量分析,对病灶周围的VI、FI及VFI的3个指标进行统计,能系统的反映恶性病灶内部血管生成状况,恶性病灶组的VI、FI及VFI均值比正常组和良性组高,存在显著性差异,具有统计学意义(F=2.749,F=10.573,F=2.374;P<0.05),良性病灶组与正常组之间差异不显著(见表2)。
2.3 联合诊断的病理结果分析
分别对单独诊断和联合诊断的灵敏度、特异度及准确率进行综合性评价,联合应用后的灵敏度、特异度和准确率均比单独使用有显著提升,其差异有统计学意义(x2=3.820,x2=4.174,x2=4.386;P<0.05),见表3。
表2 组间VI、FI及VFI值比较(±s)
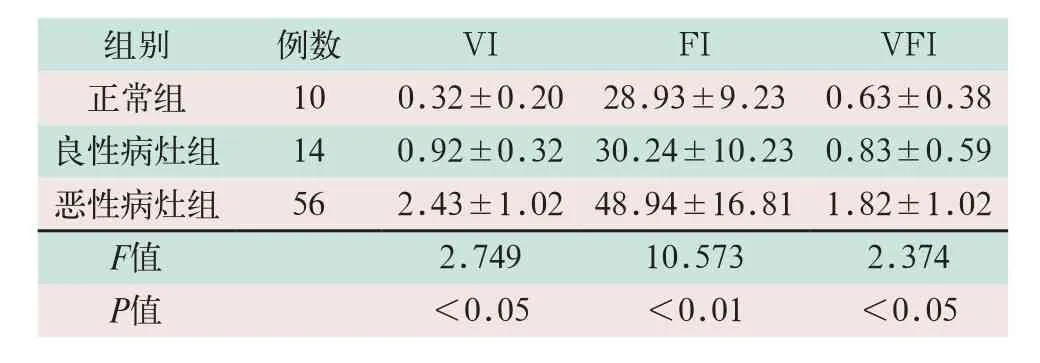
表2 组间VI、FI及VFI值比较(±s)
注:表中VI为血管化指数;FI为血流指数;VFI为血流-血管化指数。
组别 例数 VI FI VFI正常组 10 0.32±0.20 28.93±9.23 0.63±0.38良性病灶组 14 0.92±0.32 30.24±10.23 0.83±0.59恶性病灶组 56 2.43±1.02 48.94±16.81 1.82±1.02 F值 2.749 10.573 2.374 P值 <0.05 <0.01 <0.05
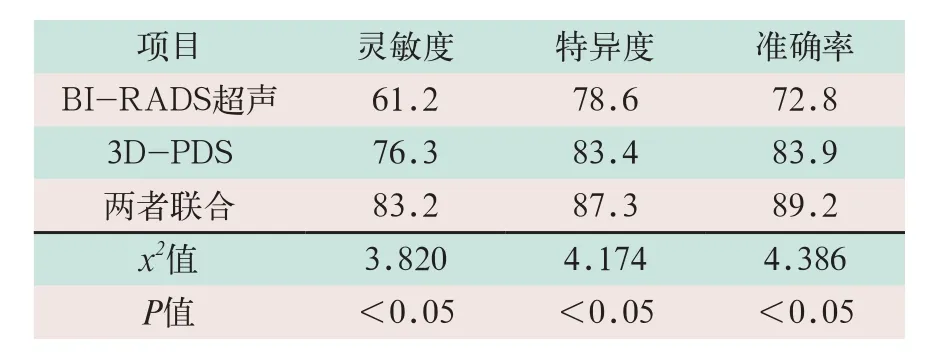
表3 两种方法对良恶性病灶组及联合后的灵敏度、特异度及准确率比较(%)
3 讨论
在临床诊断中,如何提高乳腺良恶性病灶诊断的准确率,从而达到早预防、早诊断以及早治疗的目的仍是一个难题。2003年美国放射协会提出的超声BIRADS分级诊断对乳腺病灶影像的解读,以其规范性和有效性得以在临床上广泛推广应用[4]。本研究在临床上长期采用超声BI-RADS诊断的基础上结合近年发展的3D-PDS技术进行多指标综合诊断分析,比较两者间的诊断特征并相互配合诊断,结果表明,两者结合显著提高了恶性病灶的检出率,具有长期的临床应用价值。
本研究中对70例患者的良恶性乳腺病灶部位首先采用BI-RADS超声诊断,通过对规范化术语的界定,判定其分级,指标以静态为主,其准确率、灵敏度和特异度分别为72.8%、61.2%和78.6%,表明此方法对乳腺恶性病灶的诊断与鉴别具有很好的指导作用,但灵敏度较低。具体诊断结果分析表明,此分级方法的诊断难点在于对3~4级的划分的主观性,对病灶部位的形状、方位及钙化的指标区分存在争议,诊断质量无法准确保证[5];此外,边界的清晰度和回声的类型在良恶性征象间并未出现明显区别,差异性不大,因此边界和回声对于能否划分为4级存在着很大争议[6-7]。
良性乳腺血管丰富,且分布均匀,形态规则,周边及中心均可见血管,对低速血流及细小血管有高敏感性,能较好的反映良性病灶内部血管生成状况;而恶性病灶部位的血管丰富,分支扭曲,分布杂乱无章,两者之间区分明显[8-9]。在此基础上3D-PDS,三维能量多普勒超声技术可定量分析病灶部位的血管信息,得到更为准确及灵敏的病灶部位信息。本研究中,对获得的血管信息进行半定量分析,恶性病灶的VI、FI和VFI血管参数检测值分别为2.43±1.02,48.94±16.81和1.82±1.02,显著高于良性病灶,具有统计学差异[4]。对于超声BIRADS诊断术语中无法诊断的采用3D-PDS可明显提高其诊断的灵敏度、特异度和准确率(83.4%、83.9%和76.3%)[10]。
本研究中联合3D-PDS和超声BI-RADS技术对乳腺病灶病变诊断的特异度、准确度及敏感度分析发现,显著高于单个诊断,分别为87.3%、89.2%和83.2%。在临床实践中,3D-PDS技术能在无创条件下观察病灶组织结构内的血流情况,并能提供相关的血流参数定量分析,更有利于病灶的诊断,因此,3D-PDS技术的应用对乳腺良恶性肿瘤的鉴别诊断的成功率提供了新的途径[11-12]。
3D-PDS技术的应用在实际中也存在一些限制,对于乳腺良恶性病灶的血管定量分析参数,三个参数间是否具有一致性,其相互间的诊断特异度、敏感度是否一致;在定量分析中发现三维能量多普勒超声技术对于恶性病灶的血管参数VI、FI及VFI均值范围与正常对照组范围有一定的重叠,病灶部位的血流特点与正常组略有相似[13-14]。3D-PDS技术由于探头的限制,对于较大的肿瘤无法完全覆盖,对于测定的结果可能产生较大的误差[15]。因此,3D-PDS联合超声BI-RADS应用于临床诊断的价值仍需进一步研究探讨。

