β-TrCP1和HAUSP影响胶质母细胞瘤细胞增殖和侵袭并调控UHRF1蛋白水平
李玉辉 赵喜庆 陆丽娟 刘艳坤 刘岩 胡万宁 李玉凤
神经胶质瘤是常见的颅内原发肿瘤,胶质母细胞瘤(glioblastoma,GBM)是恶性度最高的胶质瘤。由于GBM细胞增殖快且多呈侵袭性生长,手术很难将肿瘤组织全部切除,这是GBM容易复发的主要原因。进一步阐明GBM细胞增殖和侵袭性生长的分子机制可为临床治疗提供新思路。有研究发现β-转导重复相容蛋白(beta-transducin repeat-containing proteins,β-TrCP1)在正常脑组织中呈高表达,而在胶质瘤中呈低表达,在恶性度较高的GBM中的表达水平低于恶性度较低的胶质瘤[1]。提示β-TrCP1在胶质瘤中可能起抑癌作用,但其对GBM细胞增殖和迁移能力的影响及机制尚不明。疱疹病毒相关性泛素特异性蛋白酶 (herpes associated ubiquitin specific proteas,HAUSP)在正常脑组织中不表达,随着胶质瘤恶性度的升高,其表达增加[2]。但UAHSP对GBM增殖和迁移能力的影响及机制尚不明。本研究通过在胶质母细胞瘤U87细胞系中分别过表达β-TrCP1和敲低HAUSP,分析了对细胞增殖、侵袭能力的影响,并分析了二者表达改变对表观遗传调控因子UHRF1(ubiquitin-like containing PHD ring finger)表达的影响,以期为GBM的发病机制提供表观遗传学依据,为GBM的临床治疗探索新的方向。
材料与方法
一、材料与试剂
胶质母细胞瘤U87细胞购自北京协和医学院细胞资源中心。TRIzol总RNA提取试剂和逆转录试剂盒购自美国Invitrogen公司,SYBR Premix Ex Taq染料法荧光定量试剂盒购自日本TaKaRa公司,BCA蛋白浓度测定试剂盒购自美国Invitrogen公司,ECL显影液购自河北博海生物工程开发有限公司。β-TrCP1小鼠抗人单克隆抗体购自美国RD公司(MAB7675),UHRF1兔抗人多克隆抗体购自SAB公司 (32666),HAUSP兔抗人多克隆抗体(ab4080)和GAPDH小鼠抗人单克隆抗体(ab9484)购自美国Abcam公司。
二、细胞培养
U87细胞培养于含有15%胎牛血清的DMEM完全培养基中,呈贴壁生长,于37℃、5%CO2培养箱中常规培养。
三、β-TrCP1质粒与siRNA的设计、合成及转染
委托北京吉玛公司构建N1-β-TrCP1过表达质粒,将对数生长期的U87细胞接种于6孔板中,待细胞融合达到70%~80%时以Lipofectamine 2000为载体按照说明书分别将N1空质粒及N1-β-TrCP1质粒转染至U87细胞。委托北京吉玛公司体外化学合成靶向 HAUSP mRNA的小干扰 RNA(siRNA),siRNA的转染步骤同β-TrCP1质粒转染。
四、研究对象及分组
将转染质粒的胶质母细胞瘤U87细胞分为N1空质粒对照组(NC)及 N1-β-TrCP1质粒组(β-TrCP1);将转染siRNA的U87细胞分为转染无意义序列siRNA的对照组(si-NC)、转染靶向HAUSPmRNA 的 siRNA-1 组(si-HAUSP-1)、si-HAUSP-2 组及si-HAUSP-3组。
五、实时荧光定量PCR
NC组、β-TrCP1组、si-NC 组和 si-HAUSP-1组、si-HAUSP-2组及si-HAUSP-3组U87细胞分别转染24 h后,采用TRIzol裂解液分别提取各组细胞总RNA,Thermo超微量紫外分光光度计测定RNA浓度和质量。取2 μg RNA逆转录合成cDNA,具体步骤参照逆转录试剂盒。实时荧光定量PCR(RT-qPCR)反应在Thermo RT-qPCR仪上进行。引物由北京吉玛公司合成。 β-TrCP1、HAUSP、UHRF1、β-actin的引物序列见表1。β-actin为内参,每个反应设3个复孔,各个基因的反应程序均为:94℃ 3 min,94℃30 s,58℃ 30 s,72℃ 30 s,40 个循环。 实验重复 3次,以2-△△Ct计算各基因mRNA相对表达水平。因si-HAUSP-2组中HAUSP mRNA下降最为显著,后续实验均采用si-HAUSP-2(si-HAUSP组)。

表1 β-TrCP1、HAUSP、UHRF1、β-actin 的引物序列
六、Western blot检测
NC组、β-TrCP1组、si-NC组和 si-HAUSP组U87细胞分别转染48 h后,分别消化并收集各组细胞,用磷酸盐缓冲液清洗后,加入裂解液(150 mmol/L NaCl,2 mmol/L EDTA,50 mmol/L Tris-HCl,pH 7.5,0.5%NP-40,含混合蛋白酶抑制剂)置于冰上,水平摇床裂解20 min。之后于4℃、12 000 r/min离心10 min(离心半径5.5 cm),吸取蛋白上清置新的EP管中,用BCA试剂盒测定各组蛋白浓度。取40 μg蛋白样品于100℃变性10 min,分别和各自对照组(NC组和 β-TrCP1组)、(si-NC 组和 si-HAUSP组)经10%SDS-PAGE电泳将蛋白分离后转移至PVDF膜,用5%脱脂牛奶室温封闭1.5 h。NC组和β-TrCP1组蛋白印迹膜分别加入β-TrCP1抗体 (1∶500稀释)、UHRF1 抗体(1∶500 稀释)及 GAPDH 抗体(1∶1000稀释);si-NC组和si-HAUSP组蛋白印迹膜分别加入 HAUSP 抗体(1∶500 稀释)、UHRF1 抗体(1∶500 稀释)及 GAPDH 抗体 (1∶1000 稀释),4℃过夜孵育。 TBST缓冲液(50 mmol/L Tris-HCl、150 mmol/L NaCl、0.1%Tween 20,pH 7.4)洗膜 3 次,通用型二抗 37℃湿盒中孵育 45 min,TBST洗膜 3次,ECL显影,Bio-Rad凝胶成像系统采集图像进行灰度值分析,以GAPDH为内参。每组实验独立重复3次。
七、CCK8法测定细胞增殖活性
U87细胞转染24 h后消化计数,种入96孔板,每组设置3个复孔,于37℃、5%CO2培养箱继续培养,至第1、2、3、4和5天,每孔中加入CCK8溶液(10 μL/100 μL 培养基),继续入培养箱培养 2 h。酶标仪于450 nm波长处测定OD值。
八、基质胶-transwell法测定细胞侵袭能力
U87细胞转染48 h后消化计数,将细胞离心弃上清,用opti-MEM培养基重悬细胞,按每个transwell小室加入3×104个细胞将细胞悬液加入到铺有基质胶(matrigel)的transwell小室的上室,在下室中加入600 μL 20%DMEM培养基。置于37℃细胞培养箱培养48 h后分别用1∶3的冰乙酸,甲醇溶液固定,结晶紫染色,清水清洗并拍照。每孔随机选择上下左右及中间5个高倍视野。用Image J计数穿过膜的细胞数,以反应细胞的侵袭能力。
九、统计学分析
采用 SPSS17.0软件分析,RT-qPCR、Western blot及CCK-8和基质胶-transwell的实验数据以均数±标准差(±s)表示,比较采用独立样本t检验。显著性检验水准取双侧α=0.05。P<0.05为差异具有统计学意义。
结 果
一、过表达β-TrCP1抑制U87细胞的增殖和侵袭能力
RT-qPCR法检测结果显示,β-TrCP1组细胞中β-TrCP1的mRNA水平显著高于空质粒NC组 (P<0.01,图 1A)。Western blot检测结果显示 β-TrCP1组细胞中β-TrCP1的蛋白水平显著高于NC组 (P<0.01,图 1B)。
CCK8法检测结果显示,β-TrCP1组U87细胞在第4、5天的增殖能力显著低于同时期的NC组细胞(均P<0.05,图 1C)。 基质胶-transwell侵袭实验结果显示转染第4天,β-TrCP1组U87细胞穿过铺有基质胶的基底膜的细胞数低于NC组,差异有统计学意义(P<0.05,图 1D)。
二、敲低HAUSP抑制U87细胞的增殖和侵袭能力
RT-qPCR法检测结果显示,si-HAUSP-1组和si-HAUSP-2组U87细胞中HAUSPmRNA相对表达水平均显著低于无意义序列对照(si-NC)组,差异有统计学意义(P<0.05),si-HAUSP-3 组 U87 细胞中HAUSPmRNA相对表达水平与si-NC组相比,差异无统计学意义(P>0.05)(图 2A)。后续实验均采用作用效果最明显的 si-HAUSP-2(si-HAUSP组)。Western blot结果显示,si-HAUSP组细胞中HAUSP蛋白水平显著低于si-NC组,差异有统计学意义(P<0.05,图 2B)。

图1 过表达β-TrCP1对U87细胞增殖和侵袭能力影响
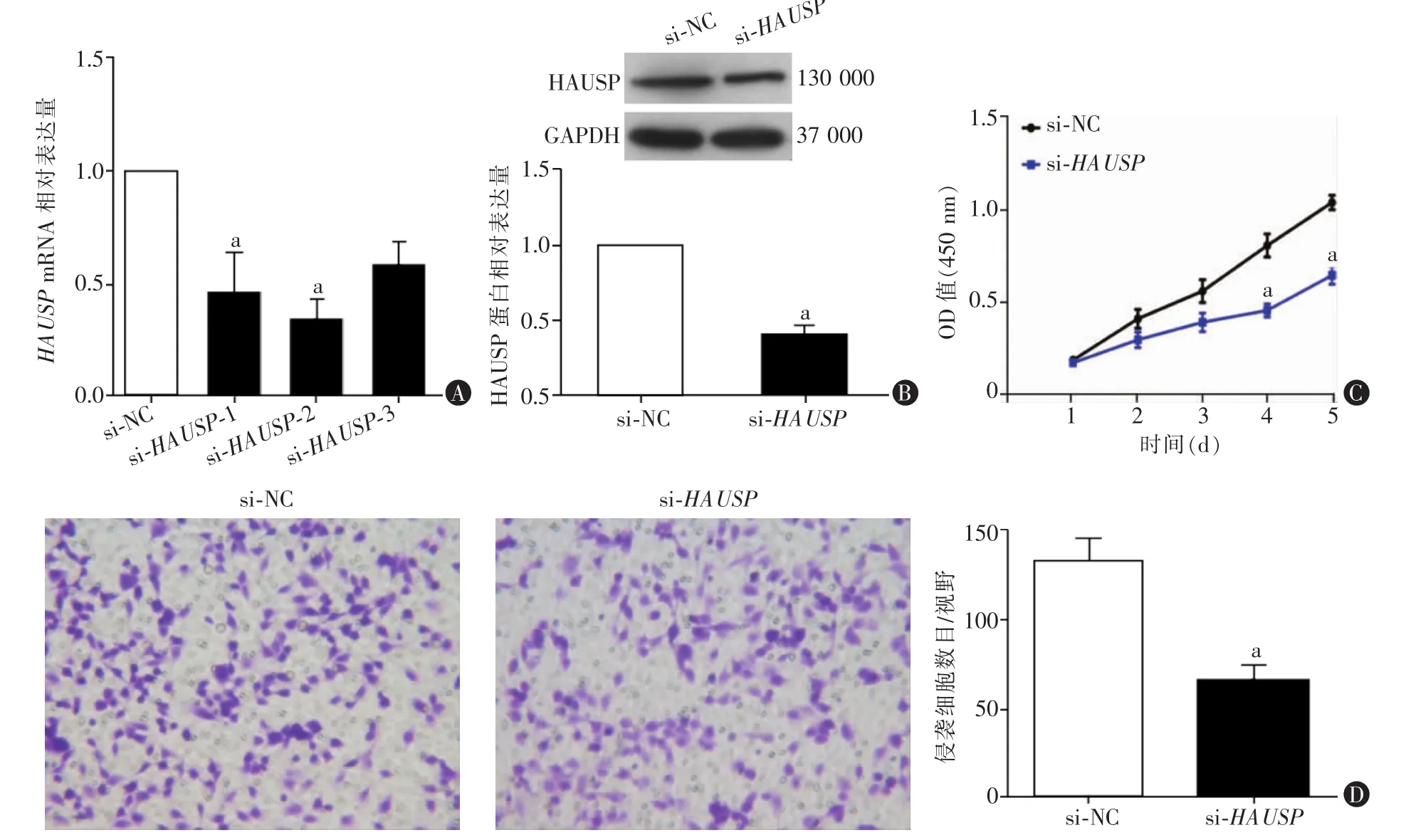
图2 敲低HAUSP对U87细胞增殖和侵袭能力影响
CCK8法检测结果显示,si-HAUSP组细胞在第4天和第5天的增殖能力显著低于同时期si-NC组细胞(均P<0.05,图 2C)。 基质胶-transwell侵袭实验结果显示,转染第4天,si-HAUSP组细胞穿过铺有基质胶的基底膜的细胞数显著低于si-NC组,差异有统计学意义(P<0.05,图 2D)。
三、过表达β-TrCP1和敲低HAUSP均降低U87细胞中UHRF1的蛋白水平
RT-qPCR法检测结果显示,β-TrCP1组和NC组UHRF1mRNA水平差异无统计学意义(P>0.05,图3A)。转染48 h后Western blot结果显示,β-TrCP1组细胞中UHRF1蛋白相对表达水平显著低于NC组(P<0.05,图 3B)。 此外,RT-qPCR 法检测结果显示,si-HAUSP组和siNC组细胞中UHRF1mRNA相对表达水平差异无统计学意义(P>0.05,图3C)。Western blot结果显示,si-HAUSP组细胞中UHRF1蛋白相对表达水平显著低于siNC组(P<0.05,图3D)。
讨 论
泛素介导的蛋白酶体途径是一个受到严格调控的特异性蛋白质降解途径。靶蛋白通过泛素激活酶E1、泛素偶联酶E2和泛素连接酶E3的一系列作用与多个泛素共价结合后,被蛋白酶复合体识别并降解。泛素化/去泛素化的异常可导致细胞中高表达的癌基因蛋白不能及时从细胞中被降解清除,从而促进肿瘤的发生发展。
β-TrCP1作为一种E3泛素连接酶,可以识别并泛素化降解磷 酸化的 IκB、NF-κB、β-catenin、E-mil和Snail等蛋白发挥多种生物学功能[3,4]。本研究发现在U87细胞系中过表达β-TrCP1可以抑制细胞的增殖和侵袭能力,说明β-TrCP1在GBM中发挥抑癌作用。与Liang等[1]的报道一致,即β-TrCP1在胶质瘤中表达水平越低,患者预后越差,在GBM中的表达最低。但在结直肠癌、胃癌、胰腺癌和乳腺癌中的研究发现β-TRCP1起促癌作用,与胶质瘤中的作用相反[5-10]。这些结果说明β-TrCP1的表达和作用呈组织异质性。
另一方面,HAUSP是泛素特异性修饰酶家族(ubiquitin specific processing enzymes,USP)成员之一,又称USP7。HAUSP能催化水解泛素C-末端与靶蛋白间的肽链连接,使靶蛋白去泛素化,参与调节细胞周期、凋亡、DNA修复与肿瘤的发生发展[11]。本研究发现敲低去泛素化酶HAUSP也抑制GBM细胞的增殖和侵袭能力,说明HAUSP在GBM中起促癌作用。这可以从细胞学水平支持以往临床组织中的报道,即HAUSP在胶质瘤中的表达高于正常脑组织,且在Ⅰ~Ⅳ级胶质瘤中的表达逐渐增高[12,13]。GBM细胞中高表达的HAUSP蛋白稳定E3泛素连接酶MDM2,后者泛素化肿瘤抑制因子视网膜母细胞瘤相关蛋白(retinoblastoma-associated protein,Rb)导致Rb蛋白降解,是导致GBM细胞高度恶性的原因之一[13]。结合本研究结果,可以推测GBM细胞中高表达的HAUSP可以直接或间接靶向多种肿瘤抑制因子发挥促癌作用。有研究表明HAUSP在前列腺癌、肝癌及乳腺癌组织中呈高表达,且其表达水平与恶性进展呈正相关[14-17]。这些结果说明HAUSP在这些组织肿瘤中均起促癌作用。
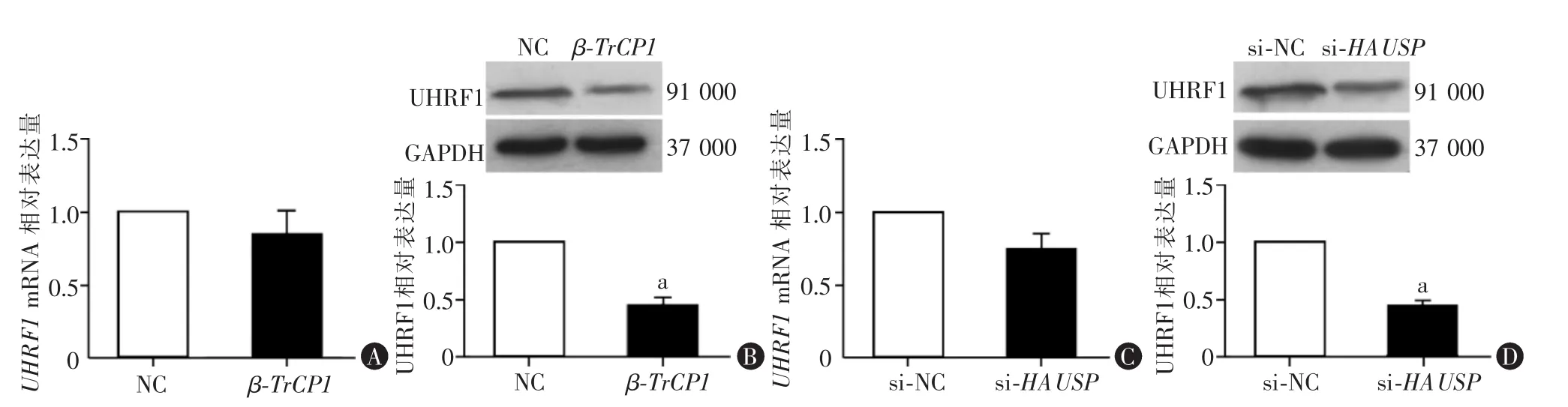
图3 过表达β-TrCP1或敲低HAUSP对U87细胞中UHRF1表达的影响
近年来的研究发现表观遗传调控因子UHRF1在包括胶质瘤在内的多种恶性肿瘤中呈高表达且与肿瘤的分级和预后相关,促进肿瘤细胞增殖、迁移和侵袭[18,19]。蛋白水平的研究发现,β-TrCP1可与UHRF1的第1-282氨基酸位点结合,并使UHRF1的663赖氨酸位点发生泛素化而降解[20,21]。本研究发现过表达β-TrCP1和敲低HAUSP不影响UHRF1的mRNA水平,但可降低其蛋白水平。因此推测GBM细胞中UHRF1蛋白水平受泛素介导的蛋白酶体途径调控,GBM中低表达的β-TrCP1及高表达的HAUSP导致UHRF1的蛋白水平升高,影响UHRF1下游参与调控细胞增殖和侵袭相关因子的表达,从而影响胶质母细胞瘤增殖和迁移能力。
综上所述,泛素化酶β-TrCP1负向调控胶质母细胞瘤细胞的增殖和迁移能力,泛素化酶HAUSP正向调控胶质母细胞瘤细胞的增殖和迁移能力,UHRF1蛋白稳定性改变可能是原因之一。GBM中低表达的β-TrCP1以及高表达的HAUSP可导致UHRF1蛋白水平增高,继而引起肿瘤抑制因子表观遗传修饰的改变而使之沉默,这是导致胶质母细胞瘤的增殖和侵袭能力增强的重要因素。过表达β-TrCP1和敲低HAUSP为抑制胶质母细胞瘤增殖和侵袭提供了新思路。

