血清与精浆维生素D水平与男性生殖功能的相关性
苏张瑶,卡迪丽娅·居尔艾特提拜克,丁家怡,姚 兵
作者单位:226000南通,南通大学医学院(苏张瑶);210002南京,东部战区总医院(原南京军区南京总医院)生殖医学中心(卡迪丽娅·居尔艾特提拜克、姚 兵);226000南京,南通大学附属妇幼保健院生殖医学中心(丁家怡)
0 引 言
维生素D是指一组在调节人体内钙和磷的稳态方面具有明显作用的脂溶性类固醇。在人体中,维生素D主要以维生素D3(胆钙化醇)和维生素D2(麦角钙化醇)2种形式存在[1]。维生素D2和维生素D3在肝经历了第1次羟基化作用,并产生25(OH)D。25(OH)D在肾经历另一步羟化过程,转变为具有生物学活性的1,25(OH)D。作为一种普遍存在的健康问题,维生素D缺乏已成为发展中国家和发达国家的主要负担,并与包括高血压、心血管疾病、中风、糖尿病、癌症等在内的一系列疾病发生相关[2-3]。对于维生素D与男性生殖系统的研究逐渐成为热点。目前临床对维生素D的检测主要集中在血清水平,多项研究报道了血清维生素D水平与精子活力等精液参数之间存在正相关关系[4-6];然而,其他的一些研究得出了相反的结果[7]。本研究旨在分析血清及精浆中维生素D与精液质量、抗苗勒管激素(anti-Mullerian hormone,AMH)、抑制素B(inhibin B,INH B)及精浆生化指标之间的相关性,进而探讨维生素D与男性生殖功能的关系。
1 资料与方法
1.1 研究人群 回顾性分析2017年6月至2018年1月南通大学附属妇幼保健院生殖医学中心与东部战区总医院生殖医学中心行男科检查的198例男性不育者临床资料,其中包括年龄、服用药物、合并症、有无烟酒滥用或是否使用合成代谢类固醇等信息。纳入标准:①符合男性不育症或者少弱精子症的诊断标准;②20~40岁;③禁欲2~7 d。排除标准:①既往有隐睾、睾丸扭转、睾丸肿瘤等手术史;②近3个月内使用激素治疗泌尿生殖道感染或其他疾病;③双侧有严重精索静脉曲张病史;④精液中白细胞含量超过106/mL精液,或解脲脲原体、沙眼衣原体、人型支原体阳性;⑤毒品、烟草成瘾和酗酒者;⑥严重少弱精子症(精子浓度<5×106/mL精液或者前向运动精子百分率<1%)或者极度畸形精子症(形态学检查显示正常形态精子百分率<1%);⑦垂体分泌的促黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicle-stimulating hormone,FSH)检测不正常;⑧遗传学检查显示Y染色体微缺失,包括AZFa段或者AZFb段或者AZFc段的微缺失;⑨长期暴露于有生殖毒性的工作环境中。
1.2 血清生化分析 分别测量患者空腹血血清及精液中维生素D、AMH及INH B水平。在Elecsys 2010免疫分析仪上使用电化学发光免疫分析(Electrochemiluminescence immunoassay,ECLIA)25-羟维生素D,检测试剂盒由上海罗氏诊断产品有限公司生产;INH B及AMH测定试剂盒均由深圳市亚辉龙生物科技股份有限公司生产。
1.3 精浆生化分析 收集精液于洁净的15 mL精液采集管中,在37℃液化,以3000×g离心力离心10 min以分离精浆。在Elecsys 2010免疫分析仪上使用电化学发光免疫分析(Electrochemiluminescence immunoassay,ECLIA)25-羟维生素D;应用速率法检测精浆α-糖苷酶;应用己糖激酶法检测精浆果糖;应用终点法检测精浆锌。
1.4 精液常规与精子形态检测 收集精液于洁净的15 mL精液采集管中,通过刻度读取精液体积,在37℃液化,通过计算机辅助精子分析系统(computer-assisted semen analysis,CASA)进行精液检测,获得精液常规参数。根据WHO(2010)使用改良Papanicolaou染色的标准仔细评估精子形态,包括正常形态率(%)和顶体完整率(%)。
1.5 统计学分析 采用SPSS 11.0进行分析。计量资料以均数±标准差或M(P25,P75)形式表示。符合正态分布项目的相关性分析采用Pearson法;不符合正态分布项目采用Spearman's rho相关性检验进行分析。以P≤0.05为有统计学意义。
2 结 果
2.1 血清及精浆维生素D水平与精液量相关性血清 25(OH)D 水平[26.17(19.61~31.99)ng/mL]与精液量[3.8(3.1~4.8)mL]呈正相关(r=0.229,P=0.003);精浆25(OH)D水平[6.55(4.33~9.62)ng/mL]与血清25(OH)D水平无明显相关性,但与精子浓度[42.85(21.75~62.23)×106/mL]呈负相关关系(r=-0.174,P=0.016),与精液量呈正相关系(r=0.271,P=0.0001)。见图1。
2.2 血清维生素D水平与精浆果糖及锌水平相关性血清25(OH)D水平[26.17(19.61~31.99)ng/mL]与精浆果糖浓度[(18.39±7.70)mmol/L,r=0.256、P=0.002]、精浆总果糖含量[70.62(45.00~96.85)μmol,r=0.310、P=0.0002]和精浆总锌含量[10.66(7.31~15.07)μmol,r=0.26、P=0.002]之间均呈正相关关系。见图2。
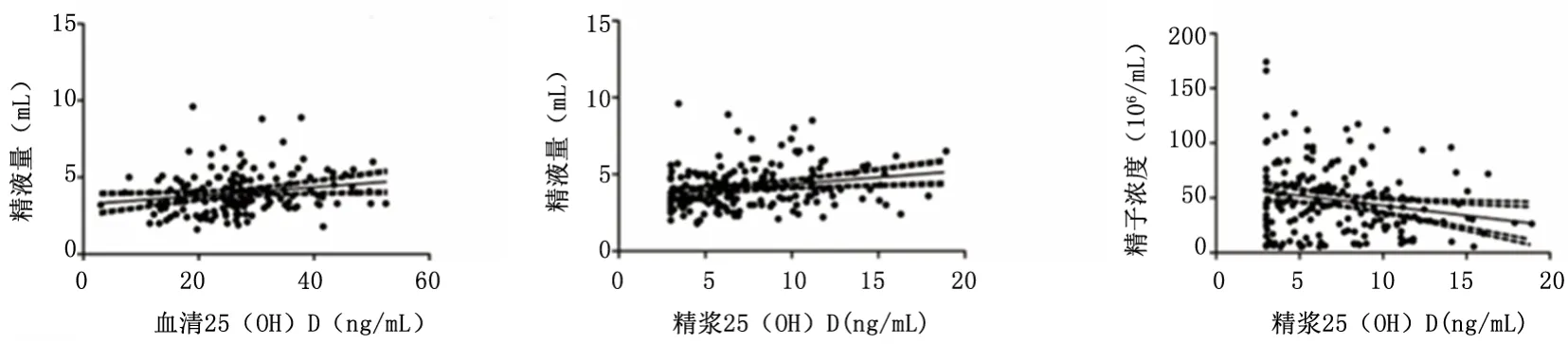
图1 血清及精浆维生素D水平均与精液量相关性散点图Figure1 Correlation scatterplot of serum vitamin D and semen volume
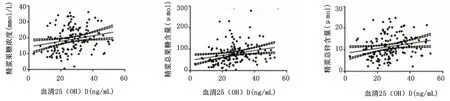
图2 血清维生素D水平与精浆果糖及锌水平相关性散点图Figure2 Correlation scatterplot of serum vitamin D and seminal plasma fructose concentration
2.3 血清及精浆维生素D水平与AMH、INHB水平相关性 血清及精浆25(OH)D水平[26.17(19.61~31.99)ng/mL]与 血 清 AMH[48.94(6.00~14.40)ng/mL]、精浆 AMH[0.365(0.16~1.08)ng/mL]以及血清 INH B[94.80(73.5~122.5)pg/mL]、精浆INH B[111.00(57.90~185.00)pg/mL]水平间均无相关性(P>0.05)。
3 讨 论
全球不孕不育夫妇占总人口数量的10%~15%,其中男性不育约占50%[4]。一般男性不育的诊断均基于精液分析,且对于以特发性病因为主的精子质量低下,迄今为止没有证据链充足的治疗方案。
研究报道将维生素D缺乏雄鼠与正常雌鼠进行交配,其妊娠率较与维生素D充足雄鼠交配的雌鼠相比下降71%[5]。后续的研究表明,通过纠正维生素D缺乏伴发的低钙血症也可间接改善雄鼠的生育能力[6]。接下来对维生素D敲除鼠的生殖能力进行的全面研究提示了其精子数量及精子活力的大幅下降是造成生育力缺失的主要原因。基于在动物研究中的发现,越来越多的研究开始把目标指向人类。一项对300名年轻健康丹麦男性进行的横断面研究发现血清维生素D与精子活力呈正相关[7]。另外2项关于可育和不育男性的研究表明,维生素D充足男性精液中的活动精子相较维生素D缺乏者更多[8-9]。
然而,其他的一些研究得出了相矛盾的结果。Abbasihormozi等[10]就发现在可育人群中,血清维生素D水平与精液参数和生殖激素无关,只有在少精子症或畸形精子症患者中才能发现维生素D和精子活力之间的正相关关系。Hammoud等[11]发现血清维生素D水平过量或不足均与精子浓度和活力低下等表示精液不良的参数相关。进一步的研究证实了维生素D受体及维生素D活化酶在人体前列腺、精囊腺及成熟精子中的表达[12]。这表明了维生素D能在男性生殖系统局部产生并且发挥作用。
精液指雄性动物或人类男性在射精时,由精子及来自睾丸、附睾和附属性腺的液体混合形成,并从尿道中射排出体外的液体。精囊腺负责65%~75%的精液的产生,并可分泌果糖和抗坏血酸等,为精子提供营养和能源。本研究发现血清维生素D水平与精液量、精浆的果糖浓度及精浆的总果糖含量间均存在显著的正相关性,这提示循环维生素D可能对精囊腺的分泌功能有一定的促进作用。前列腺主要负责了30%的精液的产生,是体内含锌量最多的器官之一。本研究发现血清维生素D水平与精浆总锌含量之间存在正性相关关系,这提示循环维生素D不仅能够到达精囊腺局部,促进精囊腺的分泌功能,同时可以到达前列腺局部,促进前列腺分泌锌到男性生殖道中。Blomberg等[12]在前列腺和精囊腺中检测到了不同表达水平的VDR mRNA和维生素D活化酶的表达,提示维生素D确实能在这些附属性腺中发挥作用。
Blomberg等[12]研究还发现,在唯支持细胞综合症患者的睾丸中无法检测到维生素D受体及代谢酶的表达。本研究发现维生素D水平与AMH和INHB水平不存在相关性,推测由于维生素D受体及代谢酶在睾丸支持细胞中不表达,故其功能不受循环维生素D水平的影响。
本研究发现精浆维生素D水平与血清维生素D水平不相关,但与精液量之间存在正相关性。因此推测主要负责精液产生的精囊腺及前列腺可能是男性生殖系统局部维生素D的主要来源。对于在我们的结果中观察到的精浆25(OH)D与精子浓度之间的负相关关系,我们认为这主要是由于精液量的增加而间接导致。
综上所述,本研究结果提示维生素D与附属性腺功能相关。本研究还存在一定局限性,样本数较少,且并未检测附属性腺维生素D受体及代谢酶的表达,故不能够排除由于维生素D受体及代谢酶表达的差异而造成的对维生素D反应性的不同。后续可通过动物研究及体外实验进一步阐明。

