不同年份生普洱茶多酚体外抗氧化效果及对小鼠酒精性胃损伤的保护作用比较
周先容,赵 欣,龙兴瑶,母健菲,潘妍霓,骞 宇,*
(1.重庆第二师范学院生物与化学工程系,重庆市功能性食品协同创新中心, 重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,重庆 400067; 2.西南大学食品科学学院,重庆 400715)
普洱茶原产地为云南,是以云南大叶种茶制成的晒青毛茶为原料,经加工而成的各种云南茶叶的统称,按生产方式可分为生普洱茶和普洱熟茶,其中生普洱茶未经人工“发酵”、“渥堆”等处理,而是以自然陈放的方式制成[1-2]。茶多酚是茶叶中的重要活性成分,它对机体具有较多的生理作用,目前对茶多酚体外抗氧化的研究较为多见,侯冬岩等[3]研究了红茶茶多酚的体外抗氧化性能,结果表明红茶具有较高的茶多酚含量和较强的抗氧化能力;刘佳等[4]研究结果表明,苦丁茶多酚对DPPH自由基、羟自由基、超氧阴离子自由基的清除能力较强,说明苦丁茶多酚具有较强的抗氧化作用。除了研究茶多酚的体外抗氧化效果,茶多酚的体内生理作用研究也备受关注。赵欣等[5]通过动物实验研究表明,苦丁茶多酚提取物对四氯化碳诱导的小鼠肝损伤具有较好的改善作用;张晓梦[6]通过药理实验证明鹧鸪茶多酚对大鼠体重、子宫指数、SOD、MDA、ALP及雌二醇等指标均有影响,说明鹧鸪茶多酚具有防治去势大鼠骨质疏松的作用;熊昌云[7]研究证明普洱茶对营养性肥胖大鼠具有显著的降脂减肥效果,且存在剂量效应。Lagha等[8]研究表明茶多酚可以抑制具核梭杆菌引起的人类单核细胞U937中NF-KB的激活,抑制巨噬细胞分泌细胞因子,进而表明茶多酚可以用来预防牙周炎以及炎症性肠道疾病。绿茶多酚能抑制皮肤分泌黑色素、抗皱、抗氧化以及阻止紫外线引起的皮肤免疫抑制,从而有效减缓皮肤的光老化[9]。普洱茶作为闻名中外的中国名茶,同样含有丰富的茶多酚物质,目前对普洱茶多酚的研究多集中于体外抗氧化、减肥、预防肝损伤和成分变化等方面[10-12],关于普洱茶多酚抑制酒精性胃损伤的研究并不多见。
据资料显示,每年中国人均酒精摄入量为10.61 L,其中男性的摄入量更是高达13.68 L[13]。然而现代医学研究表明[14],饮酒人群的胃肠道疾病发生率明显高于非饮酒人群。经常摄入高浓度的酒精会导致胃黏膜变薄,并致使其上皮细胞坏死脱落,微血管内皮损伤、栓塞,组织缺血缺氧坏死,从而引起胃黏膜糜烂甚至溃疡形成,诱发胃十二指肠黏膜损伤及相关性胃病[15]。普洱茶中丰富的茶多酚、水溶性纤维和果胶有利于肠道中益生菌的繁殖与生长,对肠道中微环境的构建起到很好的促进作用,而且对肠道粘膜萎缩有抑制作用,保护肠粘膜的屏障功能及保护肝脏等[16]。目前关于茶多酚对小鼠胃黏膜损伤的报道较为少见,目前还未见关于不同年份生普洱茶多酚抑制小鼠胃损伤的研究。故本实验旨在研究不同年份生普洱茶多酚的体外抗氧化效果及其对小鼠酒精性胃损伤的抑制作用,结合体外试验和体内试验来共同评价生普洱茶多酚的保健功效,为生普洱茶的深入开发利用提供理论基础,为其营养价值的评价提供实验依据。
1 材料与方法
1.1 材料与仪器
普洱茶 选用2008年、2012年、2016年老班章生茶,购于昆明市西山区祥润茶厂生产;没食子酸、福林—酚试剂、ABTS 都莱生物-中国生化试剂网;DPPH 南京化成工业株式会社;过硫酸钾、铁氰化钾 天津市光复科技发展有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)试剂盒 南京建成生物研究所;DNase/Rnase-Free Water 北京索莱宝科技有限公司;Trizol试剂、SYBR Select Master Mix和RevertAid First Stand cDNA Synthesis Kit 美国Life techmologies公司;RT-qPCR引物环氧合酶-2(cyclooxygenase-2,COX-2)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS) 重庆茂百科技有限公司;其余试剂 均为国产分析纯;清洁级雄性昆明小鼠 50只,6周龄,购于重庆医科大学实验动物中心,在温度(22±4) ℃、湿度50%±20%下适应性饲养1周后进行实验。
PHS-3E pH计 上海雷磁仪器厂;Q5200E超声波清洗器 昆山市超声仪器有限公司;MJ-WBL2501B多功能电动搅拌机 临沂市盛隆电器厂;HHW21.600AII水浴锅 太原市晋冀通实验仪器设备有限公司;DLSB-5/10旋转蒸发仪 上海亚荣生化仪器厂;Vavioskan lux多功能微孔板读数仪 赛默飞世尔科技有限公司;多功能酶标仪、StepOnePlus Real-Time PCR System 美国Thermo Fisher Scientific公司;UPH-II-20T优普纯水/超纯水制造系统 四川优普超纯科技有限公司;Bioprep-24生物样品均质仪、Icen-24R台式高速冷冻离心机、Nano-300微量分光光度计 杭州奥盛仪器有限公司;BX43正置显微镜 日本奥林巴斯仪器有限公司。
1.2 实验方法
1.2.1 生普洱茶多酚物质的提取 采用多功能电动搅拌机将生普洱茶进行粉碎,然后分别称取2008年、2012年及2016年的生普洱茶粉末100 g至250 mL烧杯中,加入300 mL 45%乙醇溶液,90 ℃下水浴浸提30 min,以同样条件再次浸提一次,合并2次浸提液,调节pH至6.0,然后加入AlCl3和ZnCl2混合沉淀剂进行沉淀,接着在3000 r/min条件下对混合液离心10 min,弃去上清液并在沉淀中加入200 mL 12%的盐酸再次于3000 r/min离心10 min,收集上清液。分别2次加入200 mL乙酸乙酯对分离出的上清液进行萃取。最后对萃取液进行旋转蒸发得到多酚提取物[17]。
1.2.2 生普洱茶多酚含量测定 将没食子酸配制成浓度为0.1 mg/mL的没食子酸原液,然后分别取0、2、4、6、8 mL的没食子酸原液置于25 mL容量瓶中定容至刻度,按Folin-Ciocalteu比色法[18]取1 mL不同浓度的没食子酸溶液、3 mL Folin-Ciocalteu显色剂和4.5 mL的饱和Na2CO3溶液于25 mL容量瓶中加蒸馏水定容至刻度,取显色后的溶液于747 nm波长下测定吸光值[19],每个样品重复3次,取平均值。以吸光度值为X轴坐标,没食子酸溶液浓度为Y轴坐标绘制没食子酸标准曲线[20],得到回归方程为y=11.625x-0.428,决定系数R2=0.9985。将样品溶解于蒸馏水中,采用以上的方法测定吸光度值后对照标准曲线求得生普洱茶粗多酚的含量。
1.2.3 生普洱茶多酚体外抗氧化效果评价
1.2.3.1 清除DPPH自由基能力测定 参照韦献雅等[21]的方法,在3个离心管中分别加入不同浓度的样品和试剂,其中A1号离心管加入25 μg/mL DPPH溶液3.9 mL、样液100 μL;A2号离心管加入无水乙醇3.9 mL、样液100 μL;A3号离心管加入25 μg/mL DPPH溶液3.9 mL、80%甲醇溶液100 μL。然后3个离心管摇匀后在暗处静止反应30 min,测定最终反应液在517 nm波长下的吸光度值,以VC作为阳性对照实验。DPPH自由基清除率按以下公式计算:
式(1)
1.2.3.2 清除ABTS+自由基能力测定 参照蔡文国等[22]的方法,在3个离心管中分别加入不同浓度的样品和试剂,其中A1号离心管加入7 mmol/L ABTS自由基反应溶液5.0 mL、样液200 μL;A0号离心管加入无水乙醇5.0 mL、样液200 μL;A2号离心管加入7 mmol/L ABTS自由基反应溶液5.0 mL和80%甲醇溶液200 μL。3个离心管混匀后室温下避光反应6 min,测定最终反应液在734 nm波长下的吸光度值,以VC作为阳性对照实验。按以下公式计算ABTS自由基清除率:
式(2)
1.2.3.3 清除羟自由基能力测定 参照贾荣[23]的方法,在3个离心管中分别加入不同浓度的样品和试剂,其中A0号离心管加入300 μL 80%甲醇、9 mmol/L FeSO42.0 mL、9 mmol/L水杨酸乙醇溶液1.0 mL和8.8 mmol/L H2O21.0 mL;Ai号离心管加入300 μL样品、9 mmol/L FeSO42.0 mL、9 mmol/L水杨酸乙醇溶液1.0 mL和8.8 mmol/L H2O21.0 mL;Aj号离心管加入300 μL样品、9 mmol/L FeSO42.0 mL、9 mmol/L水杨酸乙醇溶液1.0 mL和80%甲醇1.0 mL。混匀后置于37 ℃水浴锅中加热30 min,测定最终反应液在510 nm波长下的吸光度值,以VC作为阳性对照实验。按以下公式计算羟自由基清除率:
式(3)
1.2.3.4 还原力测定 采用铁离子还原力测定法[24],分别取不同浓度的VC标准液和样品液,加入0.2 mol/L的PBS缓冲液2.5 mL和1% K3Fe(CN)6溶液2.5 mL,充分混匀后在50 ℃恒温水浴锅中反应20 min,快速冷却,加入体积分数10%三氯乙酸2.0 mL终止反应。取混合液2.5 mL,加入蒸馏水2.5 mL和0.1% FeCl30.5 mL,充分混匀,在室温下静置10 min,模型组用2.5 mL甲醇溶液反应的混合液代替VC标准液和样品液,于700 nm处测吸光值。以VC作为阳性对照,吸光度值越高,还原能力越强。
1.2.4 动物分组与处理 参照Yu等[25]的研究方法,将50只清洁级昆明小鼠随机分为5组,每组10只,分别为正常组、模型组、2008年生普洱茶多酚组(2008年组)、2012年生普洱茶多酚组(2012年组)与2016年生普洱茶多酚组(2016年组)。正常组和模型组每天灌胃0.2 mL生理盐水;2008年组、2012年组与2016年组每天分别灌胃0.2 mL 2008年生普洱茶多酚提取物(200 mg/kg·BW)、2012年生普洱茶多酚提取物(200 mg/kg·BW)和2016年生普洱茶多酚提取物(200 mg/kg·BW)。在第14 d灌胃完成之后,所有组小鼠禁食不禁水24 h,第15 d除正常组小鼠外,其余组小鼠均灌胃胃损伤诱导剂(60%的无水乙醇,40%的150 mmol/L盐酸混合液),每10 g小鼠体重灌胃0.1 mL。灌胃30 min后处死所有小鼠,收集小鼠血液并在4 ℃,4000 r/min离心10 min后取上层血清备用;距贲门和幽门1.5 cm处取出全胃,收集胃液并测定胃液pH,然后沿胃大弯侧剖开,用冰生理盐水冲洗后,滤纸吸干铺开,取一段1 cm×0.5 cm的胃组织固定于10%的福尔马林溶液中,用于做病理组织切片,剩余胃组织放于-80 ℃冻藏备用。整个实验期间每天称量记录小鼠体重。
1.2.5 H&E染色 将小鼠胃组织放在10%福尔马林溶液中固定24 h,然后通过包埋、切片、制片、脱蜡、苏木精染色和伊红染色等步骤获得切片,最后把切片固定在中性树胶里面,并在显微镜下观察胃组织的形态学改变。
1.2.6 血清中SOD、MDA与GSH水平测定 根据试剂盒操作说明测定血清中的SOD、MDA与GSH水平。
1.2.7 小鼠胃组织中eNOS、nNOS、COX-2的mRNA表达情况 取50 mg左右胃组织进行组织匀浆,用Trizol提取胃组织中的总RNA,通过微量分光光度计测量总RNA浓度,并把RNA原液稀释成1 μg/mL。取1 μg/μL的RNA溶液1 μL,加入1μL(oligo)Primer dT和10 μL无菌超纯水,于65 ℃反应5 min,取出后加入4 μL Reaction Buffer、1 μL Riblock Rnase Inhibitor和2 μL dNTP mix混合均匀,再加入1 μL Revert Aid M-mu/v RT,在42 ℃ 60 min、70 ℃ 5 min合成cDNA。然后于八联管中加入10 μL Master、1 μL上游引物、1 μL下游引物、1 μL cDNA模板和7 μL灭菌超纯水,简短离心混匀。最后放入qPCR仪器中扩增,扩增条件为:95 ℃ 变性15 min,60 ℃ 退火1 h,95 ℃延伸15 min,然后循环40次。以持家基因GAPDH为内参基因,通过2-ΔΔCT计算每个基因的相对表达量[26],对应基因引物序列见表1。

表1 实验中用到的引物序列Table 1 Primer sequences used in this study
1.3 数据处理
所有数据均表示为平均值±标准偏差,采用SPSS 17.0软件中的One-Way ANOVA进行差异显著性分析,p<0.05表示数据具有显著差异。小肠H&E染色组织切片采用显微镜拍照观察。
2 结果与分析
2.1 生普洱茶的多酚含量
通过标准曲线计算出生普洱茶多酚含量,结果分别为2008年生普洱多酚含量为92.53 mg/g、2012年生普洱多酚含量为180.00 mg/g、2016年生普洱多酚含量为308.72 mg/g。研究表明,普洱茶在存放过程中,茶多酚和儿茶素含量会有明显的降低,可能是因为脂型儿茶素的水解,微生物的酶促氧化及自动氧化[27]。龚淑英等[28]对不同年代普洱茶的研究表明,普洱茶随储存时间的延长,茶叶中的多酚类自动氧化加深,其含量降低,与本实验结果基本一致。
2.2 生普洱茶多酚的体外抗氧化结果
2.2.1 生普洱茶多酚清除DPPH自由基能力 DPPH自由基是一种合成的有机自由基,是国内外常用的一种分析抗氧化活性的方法[29-30]。由图1可知,3个年份生普洱茶多酚对DPPH自由基的清除能力呈现一定的剂量效应关系,当样品浓度为8~24 μg/mL时,3者之间清除DPPH自由基的能力存在显著差异(p<0.05);当样品浓度大于24 μg/mL时,3个年份之间的差异明显变小,其中2016年的生普洱茶多酚对DPPH自由基的清除能力显著高于2008年和2012年的生普洱茶多酚(p<0.05),2008年生普洱茶多酚和2012年生普洱茶多酚对DPPH自由基的清除率之间则不存在统计学差异(p>0.05)。当样品浓度为40 μg/mL时,2016年生普洱茶多酚对DPPH自由基的清除率最高达37.75%,显著高于2008年和2012年生普洱茶多酚对DPPH自由基的清除率(p<0.05)。相对于3个年份生普洱茶多酚的DPPH自由基清除率,VC阳性模型组对DPPH自由基的清除率较低,而且当样品浓度大于24 μg/mL时,VC对DPPH自由基的清除率明显减缓。
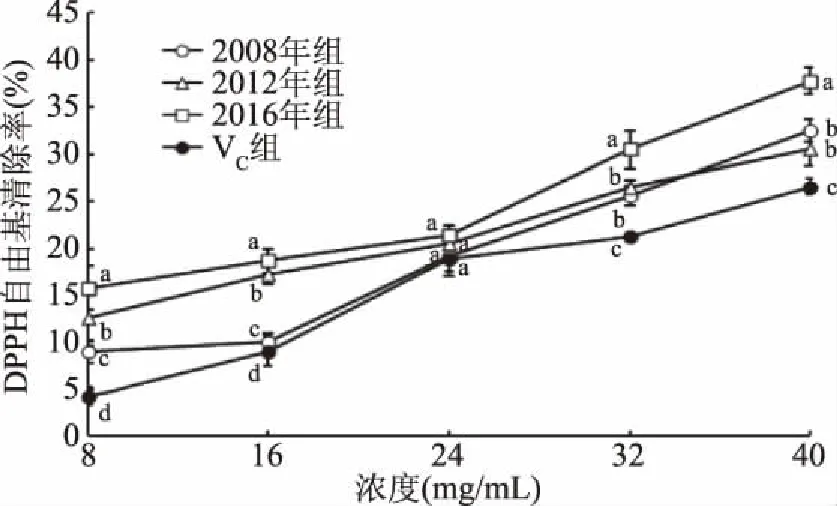
图1 不同年份生普洱茶多酚的DPPH自由基清除率Fig.1 DPPH free radical scavenging rate of Puer tea polyphenols in different years注:不同字母表示不同年份同一浓度时数据具有显著性(p<0.05);图2~图4同。
2.2.2 生普洱茶多酚清除ABTS+自由基的能力 ABTS+自由基清除率是衡量受试物抗氧化能力的重要指标[31],ABTS+自由基经氧化后形成较稳定的蓝绿色化合物,当有抗氧化剂存在时,ABTS+自由基与其反应使溶液颜色变浅,反应液吸光度值降低表明抗氧化剂具有抗氧化效果[32]。通过测定不同年份生普洱茶多酚对ABTS+自由基清除率的影响,结果发现随着样品浓度的增加,ABTS+自由基的清除率呈逐渐上升的趋势。如图2所示,当样品浓度范围为8~24 μg/mL时,3个不同年份生普洱茶多酚对ABTS+自由基的清除率差异较大,其中2016年生普洱茶多酚的ABTS+自由基清除率显著高于2012年组和2008年组(p<0.05)。当样品浓度>24 μg/mL时,3个年份生普洱茶多酚的ABTS+自由基清除率差异减小,但均显著高于VC阳性模型组对ABTS+自由基的清除率(p<0.05)。
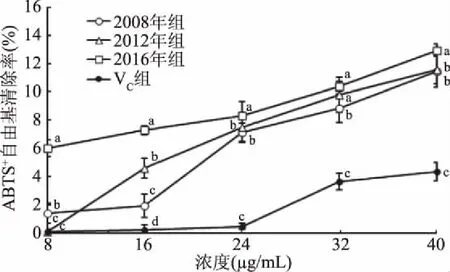
图2 不同年份生普洱茶多酚的ABTS+自由基清除率Fig.2 ABTS+ free radical scavenging rate of Puer tea polyphenols in different years
2.2.3 生普洱茶多酚清除羟基自由基的能力 羟基自由基被公认为生物系统中最具活性的活性氧,能导致生物体内DNA、蛋白质和脂质发生氧化损伤[6]。不同年份生普洱茶多酚对羟基自由基的清除能力如图3所示,综合比较表明,3个年份生普洱茶多酚的羟基自由基清除率均随着样品浓度的升高而增大,且三者之间不存在显著差异(p>0.05),说明储藏年限的变化对生普洱茶多酚清除羟自由基的能力影响不明显。有关羟基自由基作用机理的研究认为羟基自由基清除率与多酚分子结构中酚羟基的数目有关,而且不同种类的茶多酚对羟基自由基的清除率存在差异[33]。

图3 不同年份普洱生茶多酚对羟基自由基的清除率Fig.3 OH free radical scavenging rate of Puer tea polyphenols in different years
2.2.4 不同年份生普洱茶多酚的还原力 由图4可知,不同年份生普洱茶的茶多酚提取物的还原力不同,但整体趋势都是随着样品浓度的增加其还原力增强,而且还原力越强,表明其抗氧化能力越强[34]。在样品浓度为8~16 μg/mL时,不同年份生普洱茶多酚的还原力差别不大。但是当浓度大于16 μg/mL时,在相同的浓度下,每个年份的样品提取物的还原力差异显著(p<0.05),其中2016年茶叶中茶多酚含量最高,还原力也最高,综合比较3个年份茶叶茶多酚的还原力大小为2016年>2012年>2008年。

图4 不同年份生普洱茶多酚的还原力Fig.4 Reducing power of Puer tea polyphenols in different years
2.3 实验过程中小鼠体重变化
整个实验过程中,每天称量小鼠体重,观察不同年份茶多酚对小鼠体重的影响。如图5A所示,所有组小鼠的体重都呈上升趋势,其中模型组小鼠体重上升最明显。相比正常组小鼠和模型组小鼠,灌胃3个不同年份普洱茶多酚的小鼠体重增长均较平缓,其中2008年组小鼠和2016年组小鼠体重显著低于正常组和模型组(p<0.05),虽然2012年组小鼠体重与正常组和模型组之间不存在显著差异(p>0.05),但是其初始体重就高于其他组,而且增长趋势明显更为平缓;图5B为各实验组小鼠每日进食量,其进食量与小鼠体重变化趋势一致。宁鸿珍等[35]通过测定肥胖大鼠体内血脂和瘦素的含量,从而研究茶多酚对肥胖大鼠体重的影响,结果表明茶多酚不仅可以明显降低大鼠体重和体脂含量,还对血脂具有较好的调节作用。揭国良[36]通过研究茶多酚对3T3-L1前脂肪细胞和成熟脂肪细胞的生理作用,表明茶多酚可以降低3T3-L1前脂肪细胞的活力并降解成熟脂肪细胞,从而说明茶多酚具有减肥功效。Kuo等[37]的试验结果表明,给正常大鼠灌胃普洱茶30周可显著降低胆固醇、甘油三酯和体脂含量,且降低幅度比其它茶类(如绿茶)更大,同时体内抗氧化酶SOD活性高于正常模型组。

图5 实验小鼠体重变化和每日进食量Fig.5 Body changes and daily intake of experimental mice
因此本实验中茶多酚组小鼠体重增长低于正常组和模型组的原因可能与茶多酚的减肥效果有关,而且通过相关性分析可知,茶多酚含量与小鼠体重之间的相关系数为-0.078,表示茶多酚含量与小鼠体重之间存在着负相关,即小鼠灌喂茶多酚的量越大,小鼠体重增长越缓慢。
2.4 小鼠胃液量及胃酸值
由表2可知,模型组小鼠的胃液量最多,灌胃3个不同年份生普洱茶多酚的小鼠的胃液量都显著低于模型组(p<0.05)。模型组小鼠的胃液pH为1.79,显著低于其余组小鼠的胃液pH(p<0.05),然而灌胃3个不同年份生普洱茶多酚的小鼠的胃液pH均显著高于模型组(p<0.05),且和正常组之间不存在显著差异(p>0.05)。胃液量分泌过多或者胃液pH过低都会加重胃损伤的程度[38],如此说明生普洱茶多酚可以减少小鼠胃液量的过度分泌,还可维持小鼠胃内正常pH,从而在一定程度上减少高浓度乙醇对胃的急性损伤作用。

表2 小鼠胃液量及胃酸值Table 2 Amount of gastric juice and acid in mice
2.5 胃组织病理学情况
通过HE染色后,于光学显微镜下观察胃组织病理学形态的改变。如图6所示,正常组小鼠的胃黏膜几乎不存在断裂或破损情况,腺体排列整齐,且粘膜固有层无炎症细胞浸润,说明灌胃生理盐水不会导致小鼠胃黏膜损伤。与正常组小鼠的胃黏膜相比,模型组小鼠的胃黏膜出现了严重断裂和脱落,腺体排列紊乱,固有层炎症细胞浸润严重,说明胃黏膜损伤模型造模成功。灌胃不同年份生普洱茶多酚的小鼠胃黏膜均存在不用程度的病理损伤,但明显好于模型组。其中3个年份生普洱茶多酚中,2016年生普洱茶多酚对小鼠胃黏膜损伤的抑制作用最大,胃黏膜上皮细胞几乎完整,腺体排列较整齐,且炎症细胞分泌较少。如此说明灌胃生普洱茶多酚会对乙醇引起的小鼠胃黏膜损伤起到一定的抑制作用,而且普洱茶储存年限越短,抑制效果越好。
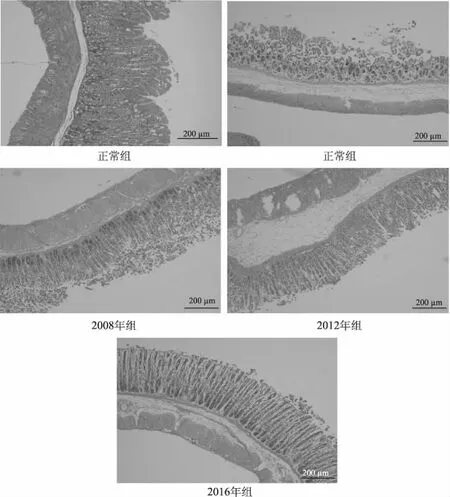
图6 不同年份生普洱茶多酚对小鼠胃黏膜病理学形态的影响(200×)Fig.6 Effects of different years of raw puer tea polyphenols on the pathological morphology of gastric mucosa in mice(200×)
2.6 血清中SOD、MDA与GSH水平
采用血清试剂盒测定小鼠血清中SOD(超氧化物歧化酶)、MDA(丙二醛)与GSH(谷胱甘肽)的水平,结果如图7所示。与正常组相比,模型组小鼠的SOD活性和GSH含量显著降低(p<0.05),MDA含量显著升高(p<0.05)。与模型组相比,灌胃3个不同年份普洱茶多酚的小鼠血清中的SOD活性明显升高,其中2016年组小鼠血清中的SOD含量与正常组接近;灌胃3个不同年份普洱茶多酚的小鼠血清中的GSH含量均显著高于模型组(p<0.05),且与正常组的GSH含量之间存在显著差异(p<0.05);而灌胃3个不同年份普洱茶多酚的小鼠血清中的MDA含量都显著低于模型组(p<0.05)。

图7 小鼠血清中SOD、MDA与GSH水平Fig.7 SOD,MDA and GSH levels in serum of mice注:不同小写字母表示差异显著;图8同。
目前越来越多的研究表明酒精造成的胃损伤与体内活性氧的水平升高有关[37],机体内存在着酶和非酶抗氧化防御系统,包括SOD、GSH和CAT等。研究表明GSH和SOD能够清除超氧化物、过氧化氢、羟基和脂质过氧化氢自由基,从而降低组织的氧化损伤[39]。MDA是评判脂质过氧化的指标,其含量与细胞损伤程度成正相关[40]。当机体内活性氧含量超过抗氧化防御系统的清除能力时,胃肠道的免疫功能将受到自由基的严重破坏,从而导致组织和器官损伤。本研究中3个不同年份的普洱茶多酚均可以提高小鼠体内SOD活性和GSH含量,同时减少MDA的含量,进而保护胃组织不受乙醇引起的氧化损伤。
乙醇在乙醇脱氢酶的催化下生成乙醛,乙醛在黄嘌呤氧化酶作用下生成氧自由基导致胃粘膜损伤。自由基反应与溃疡的发生、发展有着密切关系。体外抗氧化指标表明3个不同年份生普洱茶多酚具有较好的体外抗氧化效果,给胃损伤小鼠灌胃不同年份生普洱茶多酚后,小鼠血清中的抗氧化指标均有不同程度的提高,综合体外和体内抗氧化指标说明茶多酚对胃黏膜的保护作用可能与其抗氧化效果相关。
2.7 胃组织中eNOS、nNOS与COX-2的mRNA表达
采用RT-qPCR测定小鼠胃组织中eNOS、nNOS与COX-2的表达,结果如图7所示。eNOS、nNOS在正常组小鼠胃组织中表达最高,而其COX-2的表达最低。与正常组小鼠比较,模型组小鼠的eNOS、nNOS表达显著降低(p<0.05),COX-2表达显著升高(p<0.05)。与模型组小鼠相比,eNOS、nNOS的表达在灌胃3个不同年份普洱生茶多酚组的小鼠胃组织中均有升高,其中3个年份eNOS的表达均显著升高(p<0.05),且与正常组小鼠的eNOS表达无显著差异(p>0.05),2008年组、2012年组和2016年组小鼠的nNOS表达也都显著高于模型组(p<0.05);乙醇造模会引起小鼠胃组织中COX-2的表达升高,但给小鼠灌胃2012、2016年份的普洱生茶多酚会显著降低COX-2的表达(p<0.05),且其表达情况和正常组的表达情况无显著性差异。
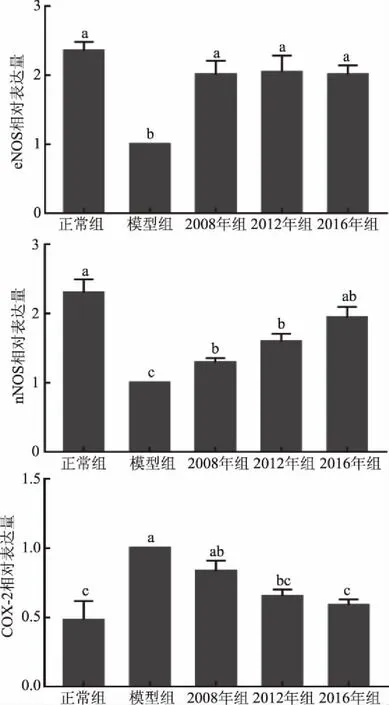
图8 eNOS、nNOS与COX-2的mRNA相对表达量Fig.8 mRNA expression of eNOS,nNOS and COX-2
胃黏膜中的一氧化氮合酶(NOS)分两类,一种为固有性NOS(cNOS,包括eNOS、nNOS),一种为诱发性NOS(iNOS)。cNOS催化产生的NO少,对胃黏膜起到一定程度的保护作用,而且研究发现胃溃疡的发生与eNOS、nNOS的过度抑制有关。邱红梅等[41]研究石榴皮鞣质对大鼠胃损伤的保护作用,结果表明150、500 mg/kg的石榴皮提取物可显著抑制胃组织中eNOS和nNOS的表达下降,从而对酒精性引起的胃损伤起到较好的保护作用。环氧合酶(COX)是机体合成前列腺素(PCs)的关键酶,在正常情况下,COX-2几乎不表达,但细胞因子、内毒素会诱导COX-2的产生,而经COX-2合成的PCs会加速机体炎症的产生[42]。刘男等[43]研究发现乙醇致大鼠胃黏膜损伤会引起胃组织中COX-2的蛋白表达显著升高,其他研究具有相同的结果[44]。本实验结果表明3个不同年份的生普洱茶多酚均能上调胃组织中eNOS的表达,下调nNOS、COX-2的表达,其中2012年组和2016年组生普洱茶多酚的调节作用与模型组比较存在显著差异(p<0.05),说明生普洱茶多酚能够对乙醇引起的胃损伤起到一定的保护作用,这可能与多酚在体内的抗氧化能力有关。
3 结论
本实验通过提取2008、2012和2016年生普洱茶多酚,对其进行体外抗氧化效果评价及其对乙醇诱导胃损伤模型小鼠的保护作用评价,结果发现:3个不同年份的生普洱茶多酚均具有较好的体外抗氧化效果,其中以2016年生普洱茶多酚的体外抗氧化效果最好;通过测量胃损伤小鼠的胃液量和胃酸值发现,3个不同年份生普洱茶多酚均可抑制胃损伤小鼠胃液量的过度分泌,并能维持小鼠正常胃酸值,从而缓解乙醇对胃黏膜的损伤作用;通过胃组织切片观察(H&E染色)发现,2008年组、2012年组和2016年组小鼠的胃黏膜损伤程度与模型组小鼠相比均有不同程度的减轻;3个不同年份生普洱茶多酚均能增加小鼠血清中SOD酶活和GSH含量,同时减少MDA的含量,进而保护胃黏膜不受氧自由引起的氧化损伤,表明生普洱同时具有较好的体外和体内抗氧化作用;3个不同年份生普洱茶多酚可从mRNA水平上调胃组织中eNOS和nNOS的表达,下调COX-2的表达,从而从基因层面更好的保护胃组织不受乙醇引起的胃黏膜损伤。综合本实验各结果可知,不同年份生普洱茶多酚不仅具有较好的体外抗氧化效果,而且随着茶多酚灌胃含量的升高,小鼠的酒精性胃损伤越低,体外和体内实验均表明普洱生茶具有较好的保健功效,为其深入开发利用提供理论基础。同时实验过程中发现灌胃普洱生茶多酚的小鼠体重增长较缓,这可能与普洱茶的减肥作用有关,后续可建立减肥模型对此假设进行深入验证。

