石榴籽多糖硒酸酯合成工艺优化及其抗油脂氧化能力
王占一,李卓瓦,毕海丹,王 飞,王京龙,向 兰
(1.枣庄学院食品科学与制药工程学院,山东枣庄 277160; 2.山东大学药学院,山东济南 250012)
人体所含的微量元素中,硒是必不可少的,能够提高人体非特异性免疫能力、能够预防恶性肿瘤、溶血性贫血、克山病等多种疾病[1]。生物利用度较高的有机硒通常以硒多糖、硒蛋白和硒核酸等形式存在,其中硒多糖,即元素硒与多糖的合成产物,是理想的补硒产品,在人体内能发挥元素硒与多糖双重生理活性[2-3]。然而,自然界中的富硒多糖含量极少,富硒栽培所得的硒多糖,存在硒含量不高等不足,难以得到理想的硒多糖。因此,国内外学者致力于富硒多糖的制备及生物活性方面的研究[4]。张继等[5]采用正交试验设计法将兰州百合多糖制备成多糖硒酸酯,通过拉曼光谱和热重分析等鉴定发现,硒在合成产物中以Se=O键形式存在;颜炳祥等[6]研究发现,硒化后的乳酸菌胞外多糖对羟基自由基的清除能力显著增强;李华为等[7]研究发现,蛹虫草硒化多糖对羟基自由基的清除效果好于过氧化氢酶。
石榴(PunicagranatumL.)是亚热带地区常见树种,全球各地区均有广泛分布[8]。果实成熟后的种子,即石榴籽是石榴果品的主要副产品之一,近年来,关于石榴籽中生物活性成分的研究报道较多,郭传琦等[9]采用正交试验设计法对石榴籽中多糖提取工艺条件进行优化,发现石榴籽中多糖成分含量较高;杨丽娜等[10]和张立华等[11]研究证实,石榴籽提取物中多糖及多酚类成分,具有较强的清除自由基能力,对四氯化碳诱导小鼠肝损伤保护作用效果明显。但是,关于石榴籽多糖硒酸酯合成工艺优化、产物结构分析和抗氧化等方面的研究,国内尚未见报道。
鉴于此,本课题组在前期实验中[12],以果胶酶、纤维素酶和甘露聚糖酶作为复合酶组成,采用复合酶解法提取,并经过后期纯化得到纯度较高的石榴籽多糖成分。本实验以石榴籽多糖和亚硒酸钠为合成原料,稀硝酸和氯化钡为催化剂,采用Box-Behnken试验设计法优化了石榴籽多糖硒酸酯的合成工艺条件,并对合成产物结构和抗油脂氧化能力进行研究,以期为石榴籽多糖硒酸酯的工业化生产及开发利用奠定理论基础。
1 材料与方法
1.1 材料与仪器
石榴籽多糖 多次纯化得均一多糖,枣庄学院生物学省级实验教学示范中心提供;硒粉标准品 纯度>99.99%,上海博顿生物化工有限公司;天然大豆油 市售;猪油 自制;硝酸、亚硒酸钠、抗坏血酸、无水乙醇、丙酮、盐酸、氨水、氯化铵、氯化钡、邻苯二胺盐酸盐、甲苯、高氯酸、硫酸钠、三氯甲烷、冰乙酸、碘化钾、溴化钾、硫代硫酸钠、淀粉指示剂、吐温-60、硫酸 天津市东丽区天大化学试剂厂;蒸馏水 枣庄学院生物学省级教学示范中心提供。
VERTEX-80V型真空傅里叶变换红外光谱仪 德国BRUKER公司;STA409PC型同步热分析仪 德国耐驰仪器制造有限公司;UV-4802S型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;LGJ-18A型冷冻干燥机 上海比朗仪器制造有限公司;FA1104B型电子分析天平 上海越平科学仪器有限公司;HH-4型电热恒温水浴锅 上海谷宁仪器有限公司;HTP201C型恒温恒湿试验箱 北京环创科学仪器有限公司;8000 dol透析袋 上海创赛科学仪器有限公司。
1.2 实验方法

1.2.2 石榴籽多糖硒酸酯中硒含量的测定
1.2.2.1 标准曲线的制作 将硒粉标准品于105 ℃恒温干燥至恒重,精密称取25.00 mg置于50 mL烧杯中,用适量HNO3消化至溶液澄清后,转移至25 mL容量瓶中,以重蒸馏水定容,作为备用液。精密量取备用液2.0 mL,用重蒸馏水定容至500 mL,即为硒对照品溶液(浓度为4 μg/mL)。取硒对照品溶液0.0、1.0、2.0、4.0、6.0、8.0、10.0、12.0 mL,分别置于50 mL小烧杯中,加重蒸馏水25 mL,用0.5% HCl调pH=2,再加入2%邻苯二胺盐酸盐溶液1.0 mL,充分搅拌,静置2 h,转移至100 mL分液漏斗中,用甲苯萃取2次,每次10 mL,分取甲苯层,转移至25 mL容量瓶中,并用甲苯定容至刻度。以不加硒对照品的溶液作对照,在334 nm波长下测定吸光值(A值),并以A值为纵坐标,系列浓度(C值)为横坐标制作标准曲线,求得回归方程为:A=0.2025C+0.0839,相关系数r=0.9993,硒含量在0~1.96 μg/mL范围内与A值呈良好线性关系[16-17]。
1.2.2.2 样品硒含量的测定 精密称取石榴籽多糖硒酸酯及未修饰的石榴籽多糖各20 mg,分别置于50 mL小烧杯中,加入混酸(HClO4∶H2SO4∶HNO3=1∶1∶4)3 mL消化至液体无色后,将小烧杯置于95 ℃水浴锅中恒温加热2 h,冷却至室温后,加重蒸馏水25 mL,按照1.2.2.1项下方法处理后测定A值,计算石榴籽多糖硒酸酯产物硒含量及收率[16-17]。
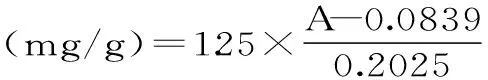

式中:m1为石榴籽多糖硒酸酯的质量,mg;m2为石榴籽多糖的质量,mg。
1.2.3 单因素实验设计
1.2.3.1 原料配比对产物硒含量及收率的影响 改变石榴籽多糖和Na2SeO3的质量比,使其分别为1∶0.4、1∶0.6、1∶0.8、1∶1.0、1∶1.2、1∶1.4,反应时间8 h,硝酸浓度为0.6%,反应温度75 ℃,按1.2.1项下方法合成多糖硒酸酯,以产物硒含量及收率为指标,考察原料配比对产物硒含量及收率的影响。
1.2.3.2 反应温度对产物硒含量及收率的影响 改变反应温度,使其分别为45、55、65、75、85、95 ℃,原料配比1∶1.0,硝酸浓度为0.6%,加热时间8 h,按1.2.1项下方法合成多糖硒酸酯,以产物硒含量及收率为指标,考察反应温度对产物硒含量及收率的影响。
1.2.3.3 硝酸浓度对产物硒含量及收率的影响 改变硝酸浓度,使其分别为0.30%、0.45%、0.60%、0.75%、0.90%、1.05%,原料配比1∶1.0,反应温度75 ℃,加热时间8 h,按1.2.1项下方法合成多糖硒酸酯,以产物硒含量及收率为指标,考察硝酸浓度对产物硒含量及收率的影响。
1.2.3.4 反应时间对产物硒含量及收率的影响 改变反应时间,使其分别为2、4、6、8、10、12 h,原料配比1∶1.0,反应温度 75 ℃,硝酸浓度为0.6%,按1.2.1项下方法合成多糖硒酸酯,以产物硒含量及收率为指标,考察反应时间对产物硒含量及收率的影响。
1.2.4 Box-Behnken试验优化设计 在单因素实验的基础上,应用Box-Behnken试验设计,以原料配比、反应温度、硝酸浓度和反应时间为自变量,以石榴籽多糖硒酸酯产物硒含量和产物收率为响应值优化合成工艺条件[18-19],因素水平表见表1。

表1 响应面试验因素水平表Table 1 Level and factors table of response surface experiment
1.2.5 石榴籽多糖硒酸酯的结构分析
1.2.5.1 紫外光谱分析 称取石榴籽多糖硒酸酯及未修饰的石榴籽多糖各20 mg,分别置于50 mL小烧杯中,加入混酸(HClO4∶H2SO4∶HNO3=1∶1∶4)3 mL消化至液体无色后,将小烧杯置于95 ℃水浴锅中恒温加热2 h,冷却至室温,加重蒸馏水25 mL,按照1.2.2.1项下方法处理后,应用紫外-可见分光光度计,在300~400 nm波长范围内进行紫外扫描,分析合成产物的特征基团[5,15]。
1.2.5.2 红外光谱分析 称取石榴籽多糖硒酸酯及未修饰的石榴籽多糖各10 mg,加入干燥的KBr,搅拌均匀,在玛瑙研钵中研磨压片,应用真空型傅里叶变换红外光谱仪在400~4000 cm-1范围内进行红外扫描,分析合成产物的特征基团[14-16]。
1.2.5.3 差热分析 称取石榴籽多糖硒酸酯及未修饰的石榴籽多糖各10 mg,适当处理后,应用同步热分析仪进行热重扫描,比较二者结构稳定性的变化。升温速率10 ℃/min,升温范围25~700 ℃,气氛为静态氮气,参比物为Al2O3[5,14-15]。
1.2.6 石榴籽多糖硒酸酯的抗油脂氧化能力试验
1.2.6.1 石榴籽多糖硒酸酯对植物油脂的抗氧化试验 精密称取石榴籽多糖硒酸酯0.5、1.0、1.5、2.0、2.5 mg,蒸馏水1.5 mg(空白对照)和抗坏血酸1.5 mg(阳性对照)分别置于100 mL小烧杯中,依次加入5.0 mL重蒸馏水和0.5 g吐温-60,50 mL大豆油,搅拌均匀后,放入(60±1) ℃恒温恒湿试验箱中保存,分别在0、2、4、6、8、10、12、14、16 d取样1.5~2 g测定其过氧化值(POV,mmol/kg),比较不同加入量的石榴籽多糖硒酸酯对植物油脂的抗氧化作用[11,20-21]。
1.2.6.2 石榴籽多糖硒酸酯对动物油脂的抗氧化试验 精密称取石榴籽多糖硒酸酯0.5、1.0、1.5、2.0、2.5 mg,蒸馏水1.5 mg(空白对照)和VC1.5 mg(阳性对照)分别置于100 mL小烧杯中,依次加入5.0 mL重蒸馏水、0.5 g吐温-60、40 g猪油,搅拌均匀后,放入(60±1) ℃恒温恒湿试验箱中保存,分别在0、2、4、6、8、10、12、14、16 d取样1.5~2 g测定POV值,比较不同加入量的石榴籽多糖硒酸酯对动物油脂的抗氧化作用[11,20-21]。
1.2.6.3 抗油脂氧化能力评价 准确称取1.2.5.1和1.2.5.2项下所取试样1.5~2 g于250 mL锥形瓶中,加入三氯甲烷-冰乙酸(体积比为1∶1)混合溶液30 mL,饱和KI溶液1 mL,封口,摇匀后置于暗处5 min,加入蒸馏水100 mL,摇匀后立即用0.002 mol/L Na2S2O3标准溶液滴定,待溶液呈现淡黄色时,加入淀粉指示剂1 mL,继续滴定至蓝色消失为止,计算POV数值[11,20,22-23]。
式中:V1为试样消耗Na2S2O3标准液体积,mL;V0为空白对照试样消耗Na2S2O3标准液体积,mL;C为Na2S2O3标准液的浓度,mol/L;m为试样的质量,g。
1.3 数据处理
Box-Behnken设计采用Design-Expert 8.0.5统计分析软件,图形制作采用Excel和Origin Pro 8.0数据处理软件。
2 结果与分析
2.1 单因素实验结果


图1 原料配比对合成产物硒含量及收率的影响Fig.1 Effects of raw material ratio on contents and yields of Se
2.1.2 反应温度对产物硒含量及收率的影响 图2为反应温度对合成产物硒含量及收率的影响。由图2可知,随着反应温度的提高,产物硒含量及收率呈现先上升后下降趋势,当温度超过75 ℃时,随着反应温度的提高,产物硒含量及收率呈现下降趋势,原因可能是该合成反应是一个吸热过程,温度较低时,不利于反应的进行,温度较高时,多糖的羟基被加速氧化,糖苷键裂解也将加快,因而严重影响了有机硒的稳定性。因此,反应温度应该控制在75 ℃。

图2 反应温度对合成产物硒含量及收率的影响Fig.2 Effects of reaction temperature on contents and yields of Se
2.1.3 硝酸浓度对产物硒含量及收率的影响 图3为硝酸浓度对合成产物硒含量及收率的影响。由图3可知,硝酸作为合成反应的催化剂,其浓度对产物硒含量及收率的影响很大,随着硝酸浓度的增大,二者均呈现先升高后降低的趋势。当硝酸浓度为0.60%时,二者均达到最大值,当硝酸浓度超过0.75%时,产物硒含量及收率下降明显,原因可能是硝酸具有强氧化性,其浓度较低时,催化效果不明显,浓度较高时,多糖的羟基被氧化或糖苷键裂解,破坏了合成产物的稳定性。因此,硝酸浓度应控制在0.60%左右。
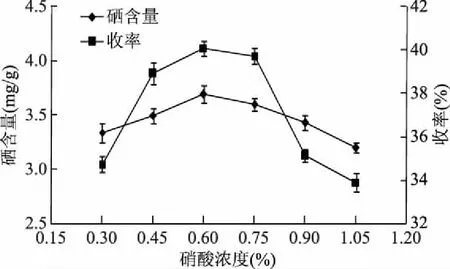
图3 硝酸浓度对合成产物硒含量及收率的影响Fig.3 Effects of concentration of HNO3on contents and yields of Se
2.1.4 反应时间对产物硒含量及收率的影响 图4为反应时间对合成产物硒含量及收率的影响。由图4可知,随着硝酸浓度的增大,硒含量及收率均呈现先升高后降低的趋势。反应时间2~8 h时,合成反应时间越长,产物硒含量及收率越高,但是当反应时间超过8 h时,产物硒含量及收率不再升高,反而呈现减少趋势,原因可能是,反应时间延长,促进了多糖的降解,严重影响了有机硒的稳定性。因此,反应时间应该控制在8 h左右。

图4 反应时间对合成产物硒含量及收率的影响Fig.4 Effects of reaction time on contents and yields of Se
2.2 响应面试验结果
综合单因素实验结果,采用Box-Behnken试验设计方法,将原料配比、反应温度、硝酸浓度和反应时间依次编码为X1、X2、X3、X4作为自变量,其编码值1、0、-1分别代表自变量的高、中低水平,以合成产物硒含量(Y1)和收率(Y2)作为响应值,应用Design-Expert 8.0.5统计分析软件建立回归数学模型,Box-Behnken试验设计及结果见表2。

表2 响应面试验设计与结果Table 2 Design and results of response surface test
通过对表2中的数据进行回归拟合,得到合成产物硒含量(Y1)和收率(Y2)的四元二次回归方程如下:
式(1)
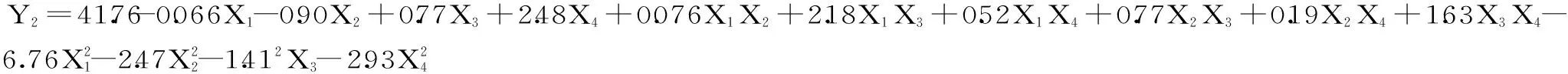
式(2)
方程式(1)显著性检验与方差分析结果见表3。从方差分析结果可知,回归模型的决定系数R2=0.9078,p<0.0001,模型极显著,说明模型能够反映响应值的变化,回归方程适用于合成产物硒含量的理论预测。失拟项p=0.0661,影响不显著,说明残差是由随机误差引起。回归方程的一次项X1、X2、X4,交互项X3X4对产物硒含量的影响均达到显著水平(p<0.05),X3以及二次项X12、X42均达到极显著水平(p<0.01),说明响应值的变化相当复杂,试验因素对产物硒含量的影响并不是简单的线性关系[18-19]。

表3 产物硒含量回归方程的方差分析结果Table 3 Variance analysis of regression equation for contents of Se
方程式(2)显著性检验与方差分析结果见表4。从方差分析结果可知,回归模型的决定系数R2=0.9105,p<0.0001,说明模型能够反映响应值的变化,回归方程适用于合成产物收率的理论预测。失拟项p=0.0583,影响不显著,说明残差具有随机误差引起。回归方程的交互项X1X3对产物收率的影响达到显著水平(p<0.05),一次项X4以及二次项X12、X22、X42均达到极显著水平(p<0.01),同样说明试验因素对产物收率的影响并不是简单的线性关系[19]。

表4 产物收率回归方程的方差分析结果Table 4 Variance analysis of regression equation for product yield
经过Design-Expert 8.0.5统计软件分析,得出制备石榴籽多糖硒酸酯的最佳工艺条件为:原料配比1∶1.02,反应温度76.20 ℃,硝酸浓度0.74%,反应时间9.30 h,在此工艺条件下,合成产物硒含量的模型预测值为4.134 mg/g,产物收率的模型预测值为42.720%。实际操作中稍作调整,确定的最佳工艺条件为:原料配比1∶1.02,反应温度76 ℃,硝酸浓度0.74%,反应时间9.3 h。在最佳工艺条件下进行5次平行试验,测得合成产物硒含量为(4.117±0.02) mg/g,产物收率为42.596%±0.13%,偏差均小于0.5%,说明本工艺参数具有很好的稳定性[18]。
2.3 合成产物的结构分析
2.3.1 紫外光谱分析 图5为石榴籽多糖(A)和合成产物(B)的紫外光谱。由图5可以看出,合成产物(B)在波长334 nm处具有一个很强吸收峰,与文献[24]报道硒元素在波长334 nm处所引起的吸收峰一致,而石榴籽多糖(A)在300~400 nm波长范围内无吸收峰,证明了硒元素存在于合成产物的结构中[5,15]。

图5 石榴籽多糖(A)和合成产物(B)的紫外光谱Fig.5 UV of polysaccharide of pomegranate seeds and synthetic product
2.3.2 红外光谱分析 图6中A为石榴籽多糖的红外光谱图,在3422.64 cm-1处出现O-H的伸缩振动峰;在1618.31 cm-1处出现强峰,为多糖结构中C=O的伸缩振动峰;在1141.52~1027.18 cm-1处出现吸收峰,为多糖结构中C-O的两种伸缩振动峰。B为合成产物的红外光谱图,其吸收峰的波形、吸收强度和峰宽等指标与石榴籽多糖一致,说明合成产物的骨架结构并没有发生改变,仍然具备石榴籽多糖的固有特征。不同的是,合成产物的红外光谱图在950.06、896.27、764.85 cm-1处出现了3个特征吸收峰,依次归属为合成产物结构中Se=O、C-Se和Se-O的伸缩振动峰,充分证明了硒元素存在于合成产物的结构中[14-16]。

图6 石榴籽多糖(A)和合成产物(B)的红外光谱Fig.6 IR of polysaccharide of pomegranate seeds and synthetic product
2.3.3 差热分析 图7a为石榴籽多糖及其合成产物的TG峰,将二者失重过程均分为4个阶段,第1阶段为失去吸附水阶段,基本在100 ℃前结束,二者峰形大体相同;第2阶段为缓慢失重阶段,石榴籽多糖在100~245.5 ℃范围内失重量为7.7%,而合成产物在此范围内失重量为8.4%,二者的失重情况大体相同;第3阶段为快速失重阶段,石榴籽多糖在245.5~425.5 ℃范围内出现快速失重现象,失重达到54.2%,而合成产物在此范围内的失重率峰型更加陡峭,失重达到76.1%,说明合成产物的稳定性降低;第4阶段为后失重阶段,石榴籽多糖在425.5~600 ℃内失重为16.9%;而合成产物在此范围内失重仅为4.5%,且在600 ℃前已经基本分解完全,说明合成产物的热稳定性较差,原因可能是:石榴籽多糖硒酸酯分子中引入亚硝酸基,改变了石榴籽多糖固有的分子结构,亚硝酸基的存在使得产物在较高温度下更容易脱水裂解,稳定性降低[5,14-15]。
图7b为石榴籽多糖及其合成产物在氮气环境中的热势图,二者的失重过程均为放热反应,均未体现出明显的氧化过程,因此,二者的失重过程均为单一的热裂解反应。
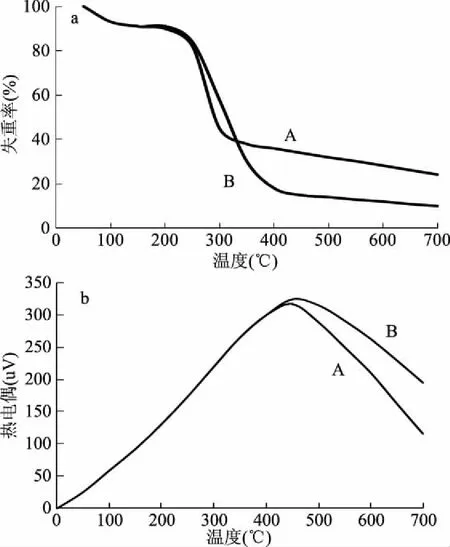
图7 石榴籽多糖(A)和合成产物(B)的热分析Fig.7 Thermogravimetric analysis of polysaccharide of pomegranate seeds and synthetic product
2.4 合成产物抗油脂氧化能力分析
2.4.1 合成产物抗植物油脂氧化能力分析 由图8可知,植物油脂在(60±1) ℃高温诱导后,发生了氧化反应,在烘箱中放置的时间越长,POV值越大,表明烘箱能够使植物油脂自氧化反应加剧[20,25]。当添加合成产物后,5组不同添加量的油样其POV值与空白对照组相比明显下降,且随着添加量的增加,抗植物油脂氧化能力增强,具有明显的量效对应关系,且时间越长,效果越显著,合成产物添加量达到2.0 mg的油样,其抗氧化能力接近添加1.5 mg VC所达到的效果。

图8 合成产物抗植物油脂氧化能力Fig.8 Antioxidant capacity of synthetic product against vegetable oil
2.4.2 合成产物抗动物油脂氧化能力分析 由图9可知,动物油脂在(60±1) ℃高温诱导后,同样发生了氧化反应,时间越长,空白对照组的POV值越大,表明烘箱同样能够加快动物油脂的自氧化反应。动物油脂中添加合成产物后,其抗氧化活性比空白对照组明显增强,5组不同添加量的油样,均具有抗氧化效果,且随着添加量的增加,抗动物油脂氧化能力增强,量效对应关系比较显著。

图9 合成产物抗动物油脂氧化能力Fig.9 Antioxidant capacity of synthetic product against animal oil
3 讨论与结论
本试验以石榴籽多糖和亚硒酸钠为原料,稀硝酸和氯化钡为催化剂,合成了石榴籽多糖硒酸酯,采用Box-Behnken试验设计优化合成工艺参数为:原料配比1∶1.02,反应温度76 ℃,硝酸浓度0.74%,反应时间9.3 h,该工艺条件下,测得合成产物硒含量为(4.117±0.02) mg/g,产物收率为42.596%±0.13%;合成产物经过紫外光谱、红外光谱和热重分析,充分证明了硒元素存在于石榴籽多糖硒酸酯的结构中。油脂抗氧化试验结果表明,合成产物能够明显减缓植物油脂和动物油脂POV值升高趋势,且具有一定的浓度依赖性,显示了合成产物具有一定的抗油脂氧化能力。但是,热失重结果分析表明,合成产物在420 ℃前后已经基本分解完全,其稳定性远低于合成前的石榴籽多糖,这与文献[15]报道一致,这也充分证明了有机金属螯合物存在着自身稳定性差的缺点和不足。本试验中,合成产物自身稳定性下降的原因可能是:合成产物由于存在着Se=O健,在热分解过程中,C-O键的电子云向Se=O健转移,增强了Se=O键结合强度,同时消弱了C-O键合力,使亚硒酸基团成为容易离去的基团,而亚硒酸基团的离去引起了多糖较快的分解,从而使合成产物稳定性下降。

