术前中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值对非肌层浸润性膀胱癌的预后评估价值
高翔,刘志宇,王梁,戴志红,汪鑫,蔡凯
(大连医科大学附属第二医院泌尿外科,辽宁 大连 116023)
膀胱癌是泌尿外科最常见的恶性肿瘤之一,其中约75%为非肌层浸润性膀胱癌(non muscle invasive bladder cancer,NMIBC)[1]。经尿道膀胱肿瘤切除术(transurethral resection of bladder tumor,TURBT)是NMIBC的标准治疗方案,但术后5年复发率为30%~80%[2]。因此,寻找有效精准的评估患者预后并指导患者治疗的临床指标十分必要。近年来的研究[3]表明,肿瘤细胞增殖、侵袭、转移和血管生成等均受到炎症的影响,临床常用的炎症指标包括中性粒细胞与淋巴细胞比值(neutrophil lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet lymphocyte ratio,PLR)、C反应蛋白等。本研究拟通过回顾分析我院NMIBC患者临床资料,探讨术前NLR与PLR联合评估NMIBC预后的临床价值。
1 材料与方法
1.1 研究对象
1.1.1 纳入标准:(1)2012年1月至2015年1月于我院泌尿外科首次行TURBT及术后吡柔比星膀胱灌注治疗的初发非浸润性膀胱癌患者;(2)术后病理确诊为NMIBC;(3)术前1周内行血常规检查,且无感染等影响血常规的因素存在;(4)临床随访资料完整。
1.1.2 排除标准:(1)具有其他肿瘤、自身免疫疾病、血液病病史的患者;(2)合并慢性阻塞性肺疾病、心力衰竭、肝功能不全、肾衰等影响手术预后者;(3)手术前行放、化疗治疗者;(4)围术期应用抗生素、免疫抑制剂、糖皮质激素治疗者。
1.2 方法
1.2.1 收集全血细胞计数的生物学标志物(NLR、PLR):术前1周内进行血常规检查,获取检验结果中的白细胞计数(包括中性粒细胞、淋巴细胞)和血小板计数,并计算NLR及PLR。
1.2.2 术后随访:采用电话及门诊定期随诊复查等方式对患者进行随访。一般在患者出院后4~6周进行随访,每3~6个月进行一次体格检查和影像学检查,以评估肿瘤术后预后情况。随访截止至2017年12月,将随访结束时仍存活及失访患者的末次数据纳入统计分析,计算无复发生存时间(recurrence-free survival,RFS)。
1.3 统计学分析
采用SPSS 23.0软件进行统计学分析。受试者工作特征(receiver operating characteristic,ROC)曲线法确定NLR和PLR的临界值。计数资料比较采用χ2检验。生存率的计算采用Kaplan-Meier法,组间生存率比较采用log-rank检验。影响预后的因素分析采用Cox比例风险回归模型。P< 0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
共有247例符合标准的患者纳入本研究,其中,男203例、女44例;年龄26~90岁,平均(64±12)岁,≥60岁165例、<60岁82例;有吸烟史108例、无吸烟史139例;病理学分期:Ta71例、T1176例;肿瘤分化程度:低分化104例、高~中分化143例;肿瘤直径≥3 cm 77例,<3 cm 170例;肿瘤为单发138例,多发109例。见表1、2。

表1 患者临床资料与NLR的相关性Tab.1 Association between the NLR and clinical features in patients
2.2 NMIBC患者术前NLR、PLR比值与临床特征的关系
高NLR组患者的肿瘤分期、肿瘤分化程度与低NLR组比较,差异有统计学意义(P< 0.05)。高PLR组患者的肿瘤分期、肿瘤大小与低PLR组比较,差异有统计学意义(P< 0.05)。见表1、2。
2.3 NLR及PLR最佳截点的确定
利用ROC曲线确定NLR及PLR鉴定患者术后是否出现复发的最佳临界值(图1),曲线下面积分别为0.713和0.710;当各自达到约登指数最大值时(0.454和0.518),选取最佳截点:NLR为2.6(敏感度为0.607,特异度为0.748),PLR为126(敏感度为0.693,特异度为0.748)。将NLR<2.6纳入低NLR组共135例,NLR≥ 2.6纳入高NLR组(共112例)。将PLR<126纳入低PLR组(共120例),PLR≥126纳入高PLR组(共127例)。
表2 患者临床资料与PLR的相关性Tab.2 Association between the PLR and clinical features in patients
2.4 术前外周血NLR、PLR水平与RFS的关系
高NLR、PLR组患者的中位RFS分别为26.0、25.5个月,与低NLR、PLR组相比,差异均有统计学意义(P< 0.001)。见图2。
2.5 影响RFS的Cox风险回归分析
将患者的年龄、性别、吸烟史、肿瘤分期、肿瘤分化程度、肿瘤大小、肿瘤数量、NLR≥2.6、PLR≥126作为检测指标,应用Cox比例风险回归模型分析,结果显示,肿瘤分期、肿瘤分化程度、肿瘤大小、NLR≥2.6、PLR≥126是影响NMIBC患者术后RFS的危险因素,见表3。Cox多因素分析结果显示,肿瘤分化程度及PLR≥126是NMIBC患者RFS的独立危险因素,见表4。
3 讨论
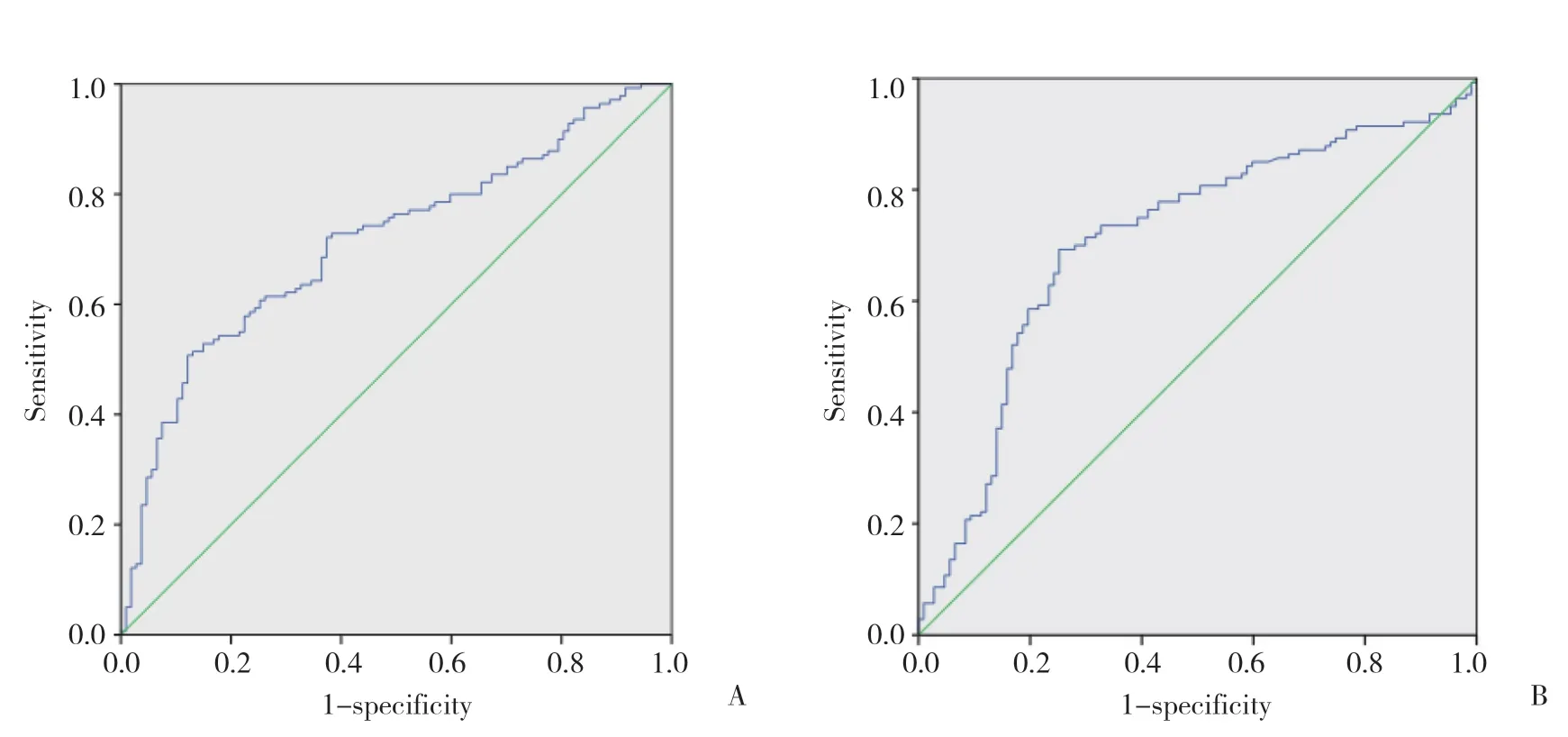
图1 NLR和PLR的ROC曲线下面积Fig.1 The areas under the ROC curves of NLR and PLR
膀胱癌是泌尿系统最常见的恶性肿瘤之一,复发率高,严重威胁人们身体健康,其发病受吸烟、种族及炎症等多因素影响[4-5]。1863年有研究[6]首次表明炎症与肿瘤的发生发展具有相关性。随着近年来研究[5,7]的深入,炎症促进肿瘤进展的作用越来越被人们所熟知,炎症反应可以刺激细胞氧化损伤、基因突变,并为肿瘤细胞生长提供有利的微环境,从而加速肿瘤细胞的增殖、侵袭和转移。

图2 RFS的Kaplan-Meier分析曲线Fig.2 Kaplan-Meier curve of recurrence-free survival

表3 影响患者RFS的单因素分析Tab.3 Univariate analysis of RFS in patients

表4 影响患者RFS的多因素分析Tab.4 Multivariate analysis of RFS in patients
血常规作为临床常用且易获得的指标,可反映患者体内是否存在炎症反应。近年来研究[8-11]发现NLR及PLR可提示胃癌、胰腺癌、前列腺癌及膀胱癌的恶性程度及预后。理论上,NLR表示先天性免疫应答(中性粒细胞)与适应性免疫应答(淋巴细胞)的比率。中性粒细胞在病变恶化前的边缘聚集,并通过各种机制促进肿瘤的发生,包括产生能够诱导DNA损伤和基因组不稳定的活性氧;促进各种细胞因子的分泌,如肿瘤坏死因子、白细胞介素-1、白细胞介素-6等,从而增强各种突变细胞的增殖;促进血管生成等[7]。淋巴细胞可通过诱导细胞凋亡起抵抗肿瘤的作用,而中性粒细胞可降低淋巴细胞的活性,从而进一步增强肿瘤侵袭及转移的能力[12-13]。恶性肿瘤可引起继发性血小板增多症,且促炎细胞因子可引起炎症相关性血小板增多[14];有研究[15-16]表明,行根治性膀胱切除术的患者血小板数量增多与更严重的病情和更差的预后相关。因此,NLR及PLR可在某种程度上体现炎症反应与肿瘤之间的关联。
膀胱癌的肿瘤分期和分化程度及肿瘤个数与大小往往与患者的预后密切相关。本研究结果显示,NMIBC患者中NLR高水平组(NLR≥2.6)与肿瘤分期、肿瘤分化程度具有相关性,而PLR高水平组(PLR≥126)与肿瘤分期、肿瘤大小具有相关性。Kaplan-Meier 分析结果显示,NMIBC患者术前的NLR及PLR水平与手术预后相关,低水平NLR及PLR组无复发中位生存时间明显高于高水平组。Cox单因素分析结果显示,NLR≥2.6、PLR≥126以及肿瘤分期、肿瘤分化程度、肿瘤大小是影响NMIBC患者术后NFS的危险因素。而Cox多因素分析结果显示,PLR≥126及肿瘤分化程度是NMIBC患者RFS的独立危险因素。
综上所述,术前NLR和PLR可以作为预测NMIBC患者RFS的有效标志物,且炎症反应与肿瘤的发生发展密切相关;这两种预测因子可以结合其他已知的预测因子(肿瘤分期和分化程度等)共同判断患者的预后,协助医生对膀胱癌患者采取有效的临床决策。

