MR体素内不相干运动扩散成像在乳腺癌中的应用进展
冯 雯,郭转转,许永生,高 雅,卢星如,雷军强*
(1.兰州大学第一临床医学院,甘肃 兰州 730000;2.兰州大学第一医院放射科,甘肃 兰州 730000)
2018年欧洲癌症调查结果显示,乳腺癌占全部癌症患者的13.4%,其检出率、死亡率均占女性恶性肿瘤第一位[1]。Suresh等[2]认为仅用免疫组织病理分型不能充分揭示乳腺癌的表型异质性。肿瘤异质性与肿瘤的发展进程、分型分期、转移侵袭机制、分子标志物、耐药性以及个体化治疗均有一定关系。MR体素内不相干运动(intravoxel incoherent motion, IVIM)模型的出现提高了对于乳腺癌的综合诊断效能。本文对IVIM在乳腺癌中的应用进展进行综述。
1 乳腺癌IVIM成像理论基础
组织水分子扩散受限,则微循环灌注增加,二者变化呈双指数模式衰减,构成非高斯扩散运动模型。IVIM双指数模型公式[3]为:Sb/S0=(1-f)×exp(-bD)+f×exp[-b×(D*+D)],其中b为扩散系数,Sb和S0分别表示b为某一数值和0时的信号强度,f表示灌注分数,D表示慢池扩散,D*表示快池扩散。通常b>170 s/mm2时利用单指数公式先获得D值,b=0时获得S0,进一步计算f值,最后得出D*值。
一般以b=200 s/mm2为界,设置3个以上b,b<200 s/mm2反映灌注效应,b>200 s/mm2反映扩散效应。Pereira等[4]认为,b较小时ADC值受血流灌注的影响较大,ADC值较高,但高b值时图像扭曲,信噪比降低,干扰ADC测值。Ei Khouli等[5]发现乳腺恶性肿瘤的标准化ADC值较ADC绝对值更低,前者的AUC为0.92,后者AUC为0.84,表明标准化ADC值可提高诊断乳腺恶性肿瘤的效能。
D值代表水分子扩散效应。Liu等[6]发现乳腺癌、乳腺良性病变、乳腺正常组织的D值依次增高,差异有统计学意义,且乳腺癌组织的微循环灌注增加;D值与容量转移常数(Ktrans)、速率常数(Kep)呈弱负相关,与南聪慧等[7]的结果相似。乳腺癌血管壁较脆弱,通透性高,物质交换速率快,导致Ktrans和Kep值较大。Barton等[8]同样证实乳腺癌的D值低于乳腺良性病变,且D值的诊断效能高于f值。ADC值易受微循环灌注和水分子扩散的影响,故D值小于ADC值。而Panek等[9]发现乳腺良性和恶性病变ADC值、D值、分布扩散系数(distributed diffusion coefficient, DDC)值差异均无统计学意义。以上研究结果存在差异,有待大样本多中心研究进一步证实。
D*值表示微灌注效应。研究[8,10]发现乳腺恶性病变D*值高于良性病变。而Liu等[6]认为乳腺良性病变的D*值高于恶性病变;约50%乳腺癌和正常乳腺组织体素内无假扩散效应和肿瘤异质性,推测IVIM模型仅适用于分析特定区域,而非对整个肿瘤进行分析。D*值会随b值不同而异,取低b值(0~50 s/mm2)时,假扩散易被低估,故在0~50 s/mm2中至少要包含2个b值[11]。b<200 s/mm2时,D*值大于10倍D值,表明D*对信号衰减的敏感度较高。此外,Cho等[12]认为D*值具有评估乳腺癌预后的能力。
f值也可表示微灌注效应。有学者[7,9]认为乳腺恶性病变f值高于良性病变,血流丰富的恶性肿瘤f值较高;而Tamura等[13]认为乳腺良恶性病变的f值无差异。影响f值的因素较多。Pang等[14]发现f值与b值的选择相关,且存在一个节点值:当b=750 s/mm2时,f值在正常组织及肿瘤中几乎无差别;b<750 s/mm2时,f值随b值增大而增大;而b>750 s/mm2时,f值随b值增大而减小。f值对所采用的最大b值及其来自非高斯效应的采样敏感;Lemke等[15]认为设定较短TE时,f值减小。
2 乳腺癌IVIM成像的临床应用
2.1 鉴别乳腺良恶性病变 乳腺IVIM成像在不同条件下的可重复性和敏感度较好,可提高MRI诊断乳腺良恶性病变的准确率[16]。X线筛查致密型乳腺癌准确率较差;超声受操作者影响较大;动态对比增强(dynamic contrast enhanced, DCE)-MRI的动态增强曲线特异度较低;IVIM可弥补以上方法的不足[10]。DCE-MRI所测Ktrans的特异度低于D值[6]。DWI可克服DCE-MRI的局限性;而IVIM更优于DWI,利用多b值分离组织的单纯水扩散和微循环灌注,无须使用对比剂[17],可用于肾功能受损患者。IVIM还可利用直方图描述肿瘤微环境的异质性[12]。Mao等[10]认为,单指数模型中,ADC值受水分子扩散和毛细血管微循环灌注的影响;Baron等[8]认为ADC值受微循环灌注的影响随b值降低而增大。相同b值下,IVIM可通过检测f值而弥补DWI的不足[18]。研究[16]发现DCE-MRI鉴别乳腺良恶性病变的敏感度为90.1%,特异度为70.2%,准确率为82.8%;与IVIM联合,检测乳腺恶性病变的敏感度、特异度、准确率分别为88.8%、85.1%及87.5%,表明二者联合可提高诊断乳腺良恶性病变的特异度和准确率。IVIM还可用于识别侵袭性乳腺癌的生物学特征及预测预后[19]。
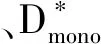
2.3 乳腺癌分型及预后 2017年国际专家共识明确指出,乳腺肿瘤特征由组织学分级、增殖指数以及影响雌激素受体(estrogen receptor, ER)阳性的肿瘤化疗等因素共同组成[22]。ER、孕激素受体(progestrone receptor, PR)、人表皮生长因子受体(human epidermal growth factor receptor 2, Her-2)均通过影响血管的生成而影响D值[23-25]。Lee等[26]发现,不同乳腺癌组织学分级、肿瘤亚型的D值第75百分位数差异均有统计学意义;乳腺癌ER(+)组的D值明显低于ER(-)组;ER(-)组D值第50、75、90百分位数和偏度系数高于ER(+)组;ER(+)组和ER(-)组的D值第10、25百分位数差异无统计学意义;Her-2(-)组的D偏度系数高于Her-2(+)组,即乳腺恶性病变、乳腺良性病变、正常组织的D值逐渐增加;而D*的均值、第75和90百分位数、偏度和峰度与导管原位癌的病灶大小相关(P=0.03、0.03、0.03、0.01、0.01)。Sun等[27]认为D值与肿瘤组织学分级和Ki-67表达呈负相关。Kim等[28]指出,与正常组织相比,乳腺癌D值较低,高Ki-67组的D值低于低Ki-67组;癌组织与正常组织的D*差异无统计学意义(P=0.20),Her-2(-)组的D值低于其他类型。Barton等[8]也得出类似的结果,且发现乳腺癌D值与Ki-67呈显著负相关。Wang等[25]则认为高Ki-67水平肿瘤和Her-2(-)肿瘤中,IVIM模型显示较低的D值;Ki-67≤14%组的D*第10百分位数值高于Ki-67>14%组(P=0.03)[26]。不同研究结果存在差异,有待进一步观察。
2.4 乳腺非肿块样强化病变(non-mass-like enhancement, NME) 乳腺NME缺乏典型影像学表现,临床易漏诊、误诊。IVIM模型对诊断乳腺NME具有重要价值。张天月等[29]纳入经病理证实的20例乳腺良性NME患者(20个病灶)和27例恶性NME患者(30个病灶),发现恶性NME的D值小于良性NME;恶性NME的f值大于良性NME;良恶性NME的D*值差异无统计学意义(P=0.59);ROC曲线分析发现,D值的AUC最大(0.91);提示IVIM参数中D、f值有助于乳腺NME良恶性病变的鉴别,其中D值诊断价值最高。
2.5 乳腺癌新辅助化疗(neoadjuvant chemotherapy, NAC) Kim等[30]研究表明D值可预测NAC的疗效。Che等[17]采用Miller & Payne分级系统将乳腺癌患者分为病理完全反应(pCR)和非病理完全反应(non-pCR)组,发现NAC前pCR组f值明显高于non-pCR组(P=0.05),D值、D*值无差异;经2个周期NAC后,pCR组D值高于non-pCR组(P<0.01),pCR组f值低于non-pCR组(P=0.02);D值AUC为0.85[95%CI(0.67,0.96)],f值AUC为0.77[95%CI(0.58,0.91)],D*值AUC为0.58[95%CI(0.38,0.76)];提示D值具有最佳预测价值,其阈值为0.163×103mm2/s时,诊断乳腺恶性病变的敏感度和特异度分别为100%和73.7%。但也有研究[12]发现pCR组D值低于non-pCR组(P<0.05)。另有研究[30]显示NAC前后D*值和f值的测量可重复性较差,观察者间一致性也较差,提示利用IVIM模型评估NAC疗效尚需进一步深入研究。
3 小结
目前D值在转移灶中是否与乳腺癌原发灶有同源性表现、IVIM能否鉴别转移性乳腺癌和原发性乳腺癌均有待研究。D*值受b值的个数、图像信噪比以及计算方法的影响;IVIM场强及计算方法对NAC的影响、IVIM参数对乳腺癌分子亚型的早期监测价值等尚不明确。受成像技术限制,IVIM无法确切描述微观组织血流灌注情况,如何优化b值、采用标准化扫描方案和后处理,还需扩大样本量进一步研究。

