智能乳腺全容积超声鉴别诊断肉芽肿性乳腺炎与浸润性导管癌
张 慧,钱林学,刘红艳
(首都医科大学附属北京友谊医院超声科,北京 100050)
非哺乳期肉芽肿性乳腺炎(granulomatous mastitis, GM)临床特征不典型,可仅表现为乳腺肿块而无明显感染症状。国外流行病学研究[1]发现,GM占乳腺良性疾病的1.8%,具有一定种族倾向,易发生于地中海国家、拉丁裔和亚裔女性。近年来我国GM发病率呈逐年上升趋势。目前常规超声是乳腺疾病最主要的检查方法,但肿块型GM与浸润性导管癌(invasive ductal carcinoma, IDC)的超声表现相似,易致误诊。智能乳腺全容积成像系统(intelligent breast full volume ultrasound system, IBUS)是乳腺三维成像技术,可展现乳腺冠状面图像,较传统二维超声提供更丰富的诊断信息,对鉴别诊断GM与IDC具有重要价值。本研究对比分析经病理证实的GM与IDC患者的IBUS特征,旨在为鉴别诊断提供参考依据。
1 资料与方法
1.1 一般资料 选取2017年10月—2018年3月于我院经超声诊断为乳腺结节的患者207例,均为女性,年龄28~71岁,平均(49.4±12.7)岁。随机分为实验组和验证组,实验组112例,包括36例GM、76例IDC;验证组95例,包括36例GM、59例IDC。纳入标准:①乳腺单发结节;②接受穿刺活检且病理资料完整;③临床资料完整可靠。排除标准:①乳腺有明显破溃、化脓等;②乳腺红肿明显,不能耐受压力;③乳腺内有假体置入;④肿块过大、突出皮肤表面;⑤乳腺皮肤表面皱褶过多,探头不能紧密贴合。所有患者均签署知情同意书。
1.2 仪器与方法 采用汕头超声仪器研究所有限公司IBUS BE3智能乳腺全容积系统,容积探头,频率5~12 MHz。嘱患者仰卧,充分暴露双侧乳腺并平稳呼吸。确定成像预设值后,采用15 cm高分辨率容积扫描器,适当加压探头使其与乳腺表面紧密贴合,分别对患侧乳腺内侧位、外侧位以及正中位进行检查,之后对乳房较大者及异常感兴趣区域进行附加检查;检查结束后将所有图像传输至IBUS专用影像工作站进行数据处理。
1.3 图像分析 由2名具有10年以上乳腺超声诊断经验的主治医师对IBUS图像进行分析,意见不一致时,以各征象分级较高者为最终结果。在冠状面图像上观察病灶边界、形态、纵横比、钙化、“牵拉聚集”征、“火山口”征、周边晕环及导管扩张等征象。“牵拉聚集”征为冠状面图像上病灶外围呈放射状分布的高回声及其对周边正常腺体组织放射状牵拉聚集的现象;“火山口”征为冠状面图像上肿块周边中-高回声与低回声相间的征象。
1.4 统计学分析 采用SPSS 21.0统计分析软件。计数资料以百分率表示,基于实验组患者,以χ2检验对声像图特征进行单因素分析,以病理结果为因变量,声像图特征为自变量,建立多因素Logistic回归模型。基于验证组患者,采用逻辑回归公式计算概率,评价多因素Logistic回归模型对GM和IDC的诊断效能。P<0.05为差异有统计学意义,
2 结果
2.1 单因素分析 实验组患者中,单因素分析结果显示GM与IDC患者病灶的周边晕环、形态、“火山口”征、“牵拉聚集”征、导管扩张和钙化的差异均有统计学意义(P均<0.05),而纵横比及边界差异均无统计学意义(P均>0.05),见表1及图1、2。
2.2 多因素Logistic回归分析 将单因素分析有统计学意义的特征(考虑形态差异可能由导管扩张、“火山口”征、“牵拉聚集”征等因素影响造成,故排除了形态特征)进行多因素Logistic回归分析,回归方程为:Logistic(P)=-42.504-22.242×周边晕环+20.109ד火山口”征+42.824ד牵拉聚集”征+21.766×导管扩张+22.408×钙化,其中“牵拉聚集”征是优势比(44.33)最大的独立危险因素(表2)。
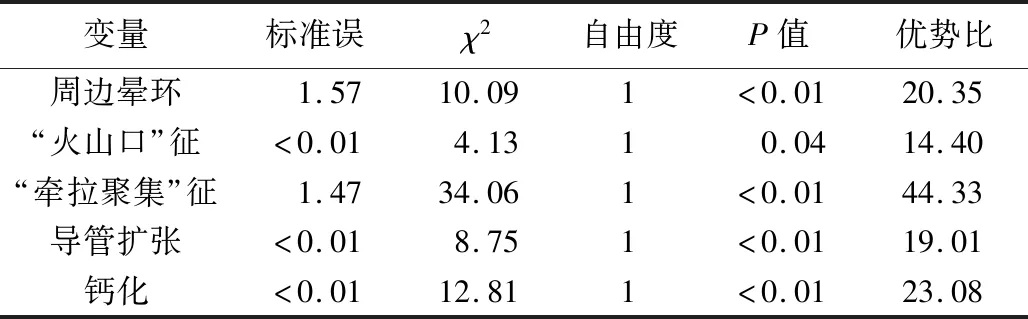
表2 实验组多因素Logistic分析结果
2.3 多因素Logistic回归方程在验证组中的诊断效能 将验证组36例GM与59例IDC代入建立的Logistic回归模型进行验证,结果显示,验证组中,多因素Logistic回归方程对GM判断准确率为91.67%(33/36),对IDC判断准确率为89.83%(53/59)。
3 讨论
GM属于自身免疫性疾病[2],与服用避孕药有关。肿块型GM症状常不典型,有时仅表现为乳腺局部质地较硬的肿块,极易误诊为IDC,误诊或延误治疗会形成经久不愈的窦道[3]。GM的病理表现为导管壁纤维性增厚,周围常有混合炎性细胞浸润,导管内常有炎性渗出物及脱落上皮等,部分可见微脓肿[4]。IDC属于高度异质性肿瘤,是乳腺癌中最常见的一种类型[5],病理表现为肿瘤细胞质丰富、形态各异且排列无规律,间质纤维组织增生等。GM与IDC在声像图上均表现为肿块形态不规则,边缘不清,内部回声不均匀等,鉴别较为困难。
研究[6-7]表明,IBUS对乳腺癌的检出率及乳腺实性病灶良恶性的鉴别诊断能力均高于传统二维超声。本研究对比分析GM与IDC的IBUS特征,并对所有超声特征进行单因素分析,发现边界及纵横比对鉴别GM和IDC无统计学意义(P均>0.05)。GM是一个缓慢炎性浸润的过程,故边界大多不清,而IDC的浸润性生长方式使肿块与正常腺体组织分界不清。IBUS图像重建后可直观显示病灶及周围组织,但本研究结果显示冠状面上肿块的纵横比对鉴别良恶性病变无统计学意义。Wang等[8]认为病灶边缘低回声晕环及外缘线状中-高回声边界是良性肿块的指标,病灶周边“牵拉聚集”征、“火山口”征及簇状钙化等是恶性指标。
本研究实验组患者中,85.53%(65/76)IDC出现“牵拉聚集”征,Logistic回归方程也表明其诊断优势比最高(44.33),是鉴别GM和IDC最有价值的指标。“牵拉聚集”征的形成机制尚未明确,可能与恶性肿瘤生长过程中对周围腺体、肌肉以及筋膜不均匀浸润,牵拉纠集周围正常腺体组织,侵犯Cooper韧带等有关;也有学者[9]认为与乳腺癌周围的纤维结缔组织反应性增生有关。研究[10]报道,“牵拉聚集”征诊断乳腺恶性肿瘤的特异度为100%,准确率为96.8%。本研究实验组36例GM患者中3例出现“牵拉聚集”征,可能是由于肿块位置表浅且体积较大,检查过程中容积探头加压力度造成了肿物及其周边组织结构扭曲所致。乳腺病灶内钙化的形态及分布对判断良恶性也有重要意义[11],IDC的钙化大多表现为簇状分布[12],IBUS对微钙化的检出率明显高于常规超声[13]。本研究实验组患者中,63.16%(48/76)的IDC病灶发现钙化,明显高于GM患者(4/36,11.11%),但因乳腺钙化的形成机制尚未明确,良恶性肿块内均可能出现钙化,故应提高对于钙化、尤其是簇状微钙化的警惕。二维超声仅能显示单个导管的长轴,不能显示导管整体,而IBUS可以连续动态观察扩张导管的走行,显示病变导管数量、受累范围、与周边正常腺体的关系及导管内异常回声[14]。本研究实验组中IDC病变周围导管扩张数目明显高于GM,提示此点对二者鉴别诊断有重要意义。此外,GM在冠状面上还可以观察到肿块周边界限清晰的无回声晕环,边缘平滑,这与GM的病理特点为炎细胞浸润有关。本研究实验组中80.56%(29/36)GM可发现病变周边晕环,21.05%(16/76)IDC可发现周边晕环,与严丽霞等[15]结果类似。周军华等[16]提出“火山口”征是恶性肿瘤的特征,认为IDC的癌组织突出管壁基底膜,并向周围间质呈非均匀浸润,IBUS表现为肿块周边呈放射状中-高回声和低回声相间。本研究实验组中发现13.89%(5/36)GM及75.00%(57/76)IDC出现“火山口”征,与周军华等[16]的结果基本一致。
本研究使用逻辑回归公式计算概率,结果显示,验证组中,多因素Logistic回归方程对GM和IDC的诊断准确率均较高,在36例GM患者中准确判断33例(33/36,91.67%),59例IDC患者中准确判断53例(53/59,89.83%)。
本研究的局限性:①IBUS不能显示病灶的血供,无法检查腋下淋巴结,也不能进行弹性成像;②对IBUS图像的解读及判断与医师经验有关,可能存在一定偏倚;③样本数量有限,建立的Logistic模型的预测准确率可能受到一定影响。
综上所述,当传统二维超声无法明确诊断乳腺肿块时,联合应用IBUS进行综合分析有助于准确诊断。

