多层螺旋CT评价不同类型心房颤动患者左心房和左心耳功能
卓利勇,李彩英,袁迎芳,田伟伟,杨 兰,陈 琛
(河北医科大学第二医院医学影像科,河北 石家庄 050000)
心房颤动(atrial fibrillation, AF)是临床最常见的心律失常,可通过重塑左心室、左心房、左心耳等结构诱导形成心源性栓子[1],并可致左心耳、左心房体积增大,且超过90% AF患者的心源性栓子来源于左心耳[2]。多层螺旋CT具有超高扫描速度、空间分辨率和完善的后处理功能,可为分析左心耳及左心房功能提供技术支持。本研究采用多层螺旋CT评估不同类型AF患者左心房、左心耳功能,为进一步探讨AF患者左心房及左心耳重塑机制奠定基础。
1 资料与方法
1.1 一般资料 连续收集2017年6月—2018年12月我院于射频消融术前接受心脏CTA检查的71例AF患者,男43例,女28例,年龄24~77岁,平均(55.4±11.1)岁;根据2014年美国心脏协会/美国心脏病学会基金会/美国心律协会心房颤动患者管理指南[3]提出的分类标准,其中 40例为阵发型AF(paroxysmal AF, PAF)患者(PAF组),31例为持续型AF(persistent AF, PeAF)患者(PeAF组)。排除CTA检查禁忌者、佩戴起搏器或有其他心脏内置入物者、甲状腺功能亢进及有器质性心脏病患者。
1.2 仪器与方法 采用Philips Brilliance iCT。采用回顾性心电门控技术,屏气后扫描,扫描范围为气管分杈下方0.5 cm至心脏膈面。采用双筒高压注射器以4~5 ml/s流率注入非离子型对比剂碘海醇(350 mgI/ml,0.8 ml/kg体质量)。扫描参数:管电压80~120 kV,管电流280~350 mAs,准直128×0.625 mm,螺距0.18,旋转时间330 ms,矩阵512×512。
1.3 图像后处理及测量方法 应用回顾性心电门控方法对原始图像进行重建:R-R间期内重建10个期相(即5%~95%,间隔10%)。将重建图像传输至Philips EBW4.5工作站,采用心功能分析软件获得左心房及左心耳3D图像,并测量各个期相左心耳(图1)及左心房体积,选取10个期相中左心耳最大容积(maximum volume of left atrial appendage, LAAVmax)、左心耳最小容积(minimum volume of left atrial appendage, LAAVmin)、左心房最大容积(maximum volume of left atrium, LAVmax)和左心房最小容积(minimum volume of left atrium, LAVmin),并计算获得左心耳射血分数(left atrial appendage ejection fraction, LAAEF)、左心耳射血量(left atrial appendage ejection volume, LAAEV)、左心房射血分数(left atrial ejection fraction, LAEF)及左心房射血量(left atrial ejection volume, LAEV)。
1.4 统计学分析 采用SPSS 21.0统计分析软件。符合正态分布的计量资料以±s表示,采用独立样本t检验比较2组间差异;不符合正态分布者以中位数(上下四分位数)表示,2组间比较采用Mann-WhitneyU检验。采用χ2检验比较2组间计数资料差异。LAAEF与其他指标的相关性分析采用Spearman线性相关。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 PeAF组患者年龄大于PAF组,差异有统计学意义(P=0.02);PAF组与PeAF组间性别、体质量指数(body mass index, BMI)、AF持续时间、高血压及糖尿病史差异均无统计学意义(P均>0.05),见表1。
2.2 左心耳及左心房功能指标 PeAF组LAAEF、LAEF、LAEV均小于PAF组(P均<0.01),LAAVmax、LAAVmin、LAVmax、LAVmin均大于PAF组(P均<0.05),2组间LAAEV差异无统计学意义(P=0.23),见表2。
2.3 相关性分析 LAAEF与LAEF呈正相关(rs=0.57,P<0.01,图2A),LAAEF与AF持续时间呈负相关(rs=-0.26,P=0.03,图2B),LAAEF与身高(rs=0.03,P=0.83)、体质量(rs=0.17,P=0.15)、性别(rs=0.14,P=0.23)、体表面积(rs=0.15,P=0.22)均无明显相关性。
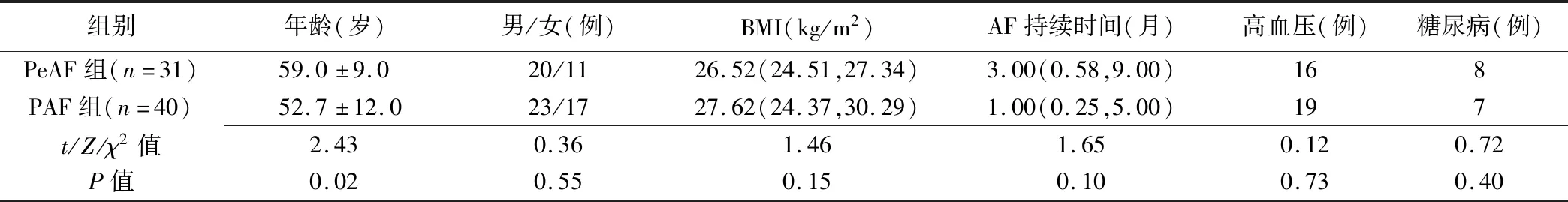
表1 PeAF组与PAF组患者一般资料比较

表2 PeAF组与PAF组左心耳及左心房功能比较[中位数(上下四分位数)]
图1 AF患者不同期相左心耳体积 A~J.依次为5%、15%、25%、35%、45%、55%、65%、75%、85%、95% R-R间期
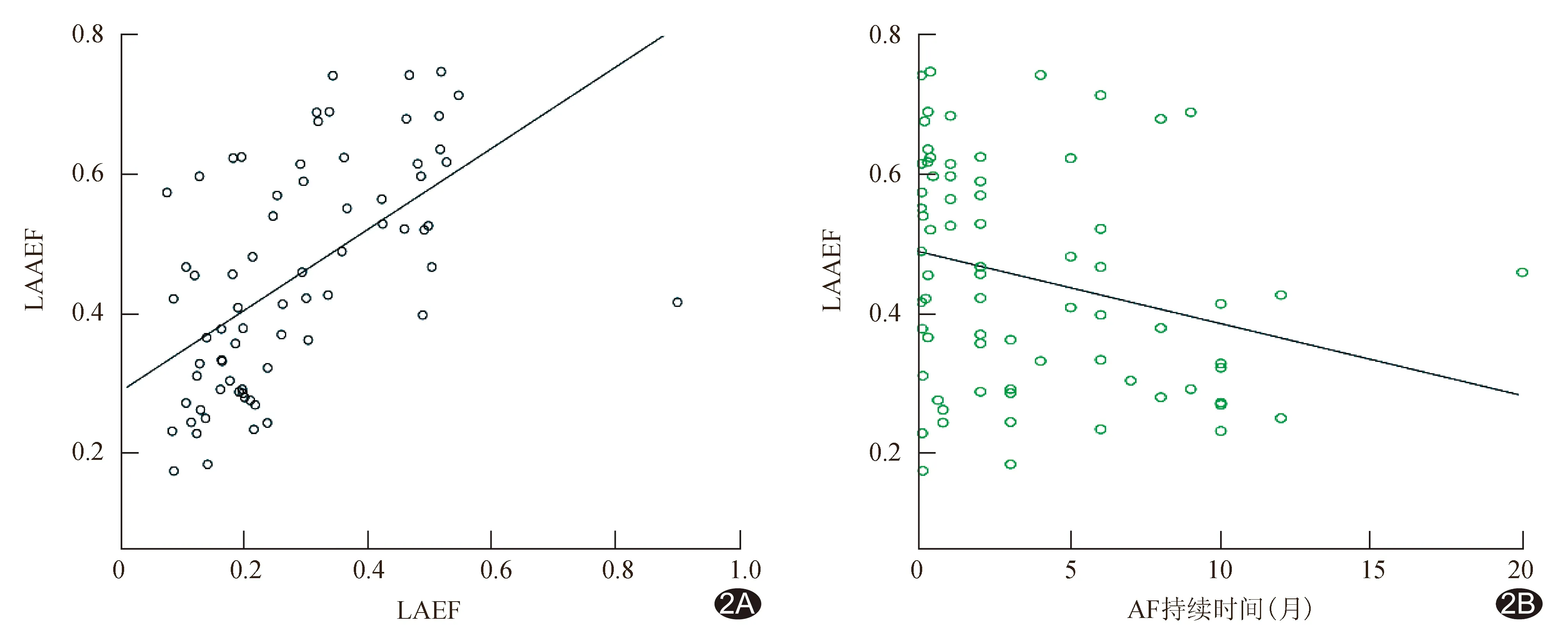
图2 LAAEF与LAEF(A)和房颤持续时间(B)的相关性分析散点图
3 讨论
左心耳不仅是左心房的长钩状真性憩室,还构成一个独立的心脏腔室,具有与左心房不同的胚胎学、解剖学和功能特征,且不同个体间左心耳的结构及形态有所不同[4]。心源性栓塞可能是AF患者心源性卒中的发生机制,也可能是隐源性卒中的主要机制[5]。既往对于不同类型AF患者的左心耳功能研究较少。Park等[6]发现在有或无卒中及短暂性脑缺血发作病史的PAF患者之间年龄和LAAEF存在明显差异,由于该研究以左心房血管造影测量左心耳及左心房功能,检查过程中因无法维持PeAF患者稳定的窦性心律而未能采集其功能信息。另有国外学者[7]提出慢性AF患者左心房功能受损程度与左心耳假性充盈缺损程度明显相关。Hwang等[8]认为左心房体积和功能减低导致LAAEV降低,且可据此预测左心房血栓形成的风险。目前AF患者左心耳电生理结构重塑及其对卒中风险的潜在影响机制尚不明确。准确评估左心耳的解剖和功能对临床进行危险分层、制定治疗方案具有重要价值。
在左心耳功能和解剖学多个参数(如LAAVmax、LAAVmin、LAAEF等)中,LAAEF可能是最可靠的血栓预测因素之一[6]。本研究结果显示PeAF组LAAVmax、LAAVmin、LAVmax及LAVmin均大于PAF组,而LAAEF、LAEF较PAF组减低,原因可能在于相比PAF患者,PeAF患者AF频率更高、持续时间更长,可能具有更广泛的电生理重构[9],导致左心耳和左心房体积增大、梳状肌萎缩和心内膜弹力纤维增生,左心耳开口增大,顺应性减低,舒张期血流排空峰值减低,血流排空能力下降,进而导致血流速度减低甚至淤滞,增加患者心源性血栓形成风险。LAAEF减低是AF患者卒中及短暂性脑缺血发作的有力预测因素[6]。本研究发现LAAEF与AF持续时间呈负相关,随AF持续时间延长而减低,考虑是因为较长的AF持续时间导致左心耳发生更大程度的重塑,不能进行有效收缩与舒张,使左心耳血流排空能力减低[6]。本研究中2组间LAAEV无明显差异,但PeAF组LAEV小于PAF组,考虑是由于AF患者左心耳肌细胞溶解和间质纤维化少于左心房[10],左心耳比左心房更易扩张、顺应性更高,导致排血量无明确改变[11]。
本研究中PeAF组患者年龄大于PAF组。国外学者[12]通过长达10年的随访研究发现AF患者的年龄与PeAF持续进展紧密相关。另一方面,由于AF起病隐匿,常无明确前期症状,临床难以确定准确的初发时间,使得PeAF患者往往在症状出现较长时间后才获得确诊[13]。
Boucebci等[14]认为LAAEF在正常人群中不同性别间差异无统计学意义。本研究中AF患者LAAEF与性别亦无明显相关,与Boucebci等[14]的结果一致,表明性别并非LAAEF的影响因素。本研究中AF患者LAAEF与身高、体质量、体表面积无明显相关性,与Li等[15]对于正常人LAAEF的研究结果一致,提示AF患者LAAEF可能与体型无明显相关。当部分生理(如剧烈运动)或病理条件导致左心房压力及体积增大时,左心耳扩大并充当血库,左心耳内丰富的梳状肌及相对较高浓度的心房钠尿肽使其能够通过激活拉伸敏感受体来调节左心房压力,并引发适应性反应(如心率增加、促进尿钠排泄等),以此改善心输出量和控制循环血容量[16]。本研究结果显示LAAEF与LAEF呈正相关,与国内学者对于正常人的相关研究[17]结果一致。左心耳封堵术或者结扎术可能引起左心房容量或压力发生改变,进一步导致远期的心功能恶化或心律失常[18],因此需要进一步提高对左心耳生理功能和病理变化的认识,以避免这种可能存在的远期副作用。
本研究为单中心、回顾性研究,可能存在选择偏倚。理论上重建的心动周期与原始图像重建的心动周期间隔越短,时相越多,所测量的功能参数越准确。本课题组前期研究[17]发现,重建10个期相可以保证测量数据的准确性。
综上所述,多层螺旋CT能够在不增加辐射剂量的前提下准确评价左心耳解剖结构,同时分析左心耳功能。本研究结果显示PeAF患者左心房及左心耳功能较PAF患者减低,且左心耳功能随AF持续时间延长而减低,可为进一步了解左心耳和左心房功能与AF类型之间的关系提供重要参考。

