存储时间对玉米秸秆理化性状及产甲烷潜力的影响
袁玲莉,刘研萍,袁 彧,周丽烨,3
存储时间对玉米秸秆理化性状及产甲烷潜力的影响
袁玲莉1,刘研萍2,袁 彧2,周丽烨1,3※
(1 杭州能源环境工程有限公司,杭州 310020;2 北京化工大学环境科学与工程系,北京 100029;3 江苏维尔利环保科技股份有限公司,常州 213125)
收割后的秸秆需要经过时间不等的存储后进入到厌氧系统生产沼气,而秸秆的存储时间不同对产甲烷潜力有一定的影响。该文对收割后的玉米秸秆分别经过0、2、5、10、20、30和45 d自然堆放存储,分析不同存储时间秸秆的理化性质变化以及对产甲烷潜力的影响。通过分析不同存储时间秸秆的感官性状、总固体(total solid,TS)、挥发性固体(volatile solid,VS)、pH值、木质纤维素、叶绿素、挥发性脂肪酸(volatile fat acid,VFA)等理化性质,发现秸秆存储20 d后各个性状趋于稳定。对不同存储时间处理的秸秆进行产甲烷潜力(biochemical methane potential,BMP)测试,结果显示,存储0、2、5、10、20、30、45 d的BMP分别为325.49、315.35、297.85、296.71、295.25、287.83、291.01 mL/g(以VS计)),随着存储时间的增加,BMP总体上呈下降趋势,且存储0~5 d的下降较快,存储大于5 d的秸秆BMP结果相近。试验得出,秸秆存储时间不同对产甲烷潜力有明显影响,主要由于受到多种原料性质的影响,尤其是木质纤维素、可溶性化学需氧量、还原糖、挥发性脂肪酸。研究结果可为工程化秸秆沼气项目和生物天然气项目的运行提供参考。
沼气;秸秆;厌氧发酵;产甲烷潜力;存储时间
0 引 言
中国是农业大国,农作物秸秆作为农业废弃物的主要资源,2015年理论资源量高达10.4亿t,可收集资源量约9亿t,可作为生产沼气原料的资源量约1.8亿t,沼气潜力约500亿m3[1]。作为一种产量大、分布广的生物质能,秸秆具有肥料化、饲料化、基料化、原料化和能源化五大资源利用方式[2]。然而,将秸秆未经处理直接用作还田、饲料和原料等传统模式并未有效利用秸秆中蕴含的生物质能,对经济效益和社会发展尚无明显增益。能源化则可高效利用秸秆生物质能,生产生物天然气或发电,既优化了能源配置,促进了能源与环境的可持续发展,同时可以获得良好经济效益,推动社会及生态文明建设。如何针对秸秆提供行之有效的处理和高效资源化利用方式已经成为中国亟需解决的问题[3-5]。
厌氧发酵(anaerobic digestion,AD)生产沼气是秸秆在能源化利用方面的一种高效清洁方式[1-3,6-9]。在实际沼气工程应用中,由于作物种植具有季节性的特点,导致秸秆供应期多为秋季,一般都需要经过时间不等的存储过程才会进入到厌氧发酵系统中生产沼气[10],秸秆自然堆放存储是中国目前沼气工程中使用最为普遍的存储方式。
秸秆收割后植物细胞依然具有活性。离体后,细胞组织呼吸作用加强,自身的营养物质被大量消耗并加快老化;植物细胞次生壁逐渐加厚,出现纤维化和木质化的现象,加快了老化程度;此外,植物细胞生成一些酶,如过氧化物酶、苯丙氨酸解氨酶、过氧化氢酶、超氧化物歧化酶、多酚氧化酶等,加速木质化,加快组织衰老[11-12]。
此外,存储过程中也有许多微生物的作用。由于新鲜秸秆具有一定的湿度和丰富的营养物质,能够为微生物提供合适的生存条件,促使大量的真菌如白腐真菌、霉菌的生长,出现霉变的现象,但同时由于真菌对于木质纤维素的降解作用,能够部分破坏木质纤维素,生成一些易降解的中间产物为自身和其他微生物提供营养[13]。除真菌外,还有酵母、各种产酸菌等的作用。堆实紧密处也会出现厌氧菌或兼性厌氧菌的作用。但随着植物存储过程中的不断干燥和可溶性营养成分的消耗,微生物活性逐渐减弱。
自然堆放的存储方式会造成较多的有机物损耗,干物质损失率可以达到18%~70%,一般来说会造成产甲烷潜力的下降[14-16]。但也有研究表明,由于存储时间不同,产甲烷潜力会出现不同的变化趋势[17-18]。但是对玉米秸秆存储过程中的性状变化以及产甲烷潜力(biochemical methane potential,BMP)的影响方面的研究较少。
本文探究了不同存储时间对玉米秸秆产甲烷潜力的影响,并通过感观及理化分析对存储过程中玉米秸秆的理化性质变化进行分析。将玉米秸秆经过不同存储时间处理后,进行产甲烷潜力测试,并分析存储时间和性状对BMP的影响,为秸秆通过自然堆放存储方式,用以生产沼气和生物天然气的工业应用方面提供参考。
1 材料与方法
1.1 试验材料
新鲜玉米秸秆取自河北省保定市,收割时间为2015年8月底,并去除玉米果实,新鲜玉米秸秆的部分性质如表1所示。将新鲜玉米秸秆切成2~3 cm的小段,用以进行存储试验。
本试验使用的存储方式为室内自然堆放存储,存储地点为北京36.97°N,116.42°E,存储时间为冬季,气候干燥少雨。室内温差较小,流通性较低。白天温度为14~25℃,夜间温度为12~20 ℃,相对湿度为7%~24%,
存储方式和分组如下:将切碎至2~3 cm的新鲜玉米秸秆取小部分置于-20℃冰箱中冷藏,并标记为D0;剩下的新鲜玉米秸秆分别放入箱子内并置于室内,进行自然堆放,分别存放2、5、10、20、30、45 d后混匀取样,并每天记录天气情况,以及存储环境的室温、相对湿度。以上存储原料分别标记为D2、D5、D10、D20、D30和D45。记录并观察存储期间玉米秸秆的感官变化。
对存储之后的玉米秸秆粉碎处理至20目,用以进行BMP试验和性质测定。每组BMP试验和性质测定试验重复3次。未使用时置于-20 ℃冰箱保存。对于茎叶湿润的原料,粉碎过程中的水分损失率在1.5%~3%。
接种泥取自北京市顺义区南坞沼气站出料污泥,存放在室内阴凉处保存(10~20 ℃)。试验接种泥性质见表2所示。

表1 新鲜玉米秸秆性质

表2 接种泥性质
1.2 分析方法
原料的总固体(total solid,TS)和挥发性固体(volatile solid,VS)测定使用重量法[19]。各原料和接种泥的总氮和总碳使用有机元素分析仪(Vario EL/micro cube,德国elementar Inc.)测定。原料中的金属含量使用原子发射光谱仪(iCAP 6000 Series,美国ThermoFisher公司)测定。新鲜玉米秸秆和存储后玉米秸秆的木质纤维素组分根据Soest[20]的方法测定。酸性洗涤纤维(acid detergent fiber,ADF)和中性洗涤纤维(neutral detergent fiber,NDF)含量使用纤维素分析仪(A2000i,美国)和200 F57滤袋技术测定。使用傅里叶红外光谱法(FT-IR 8700,美国UNICO公司)分析存储前后原料的官能团变化情况,从而对比不同存储时间对原料性状的作用。叶绿素测定采用分光光度法。
浸提法测定方法为:取10 g原料,加入100 mL蒸馏水,4 ℃条件下浸泡12 h后去渣,取液体部分测定pH值、挥发性脂肪酸(volatile fat acid,VFA)、可溶性化学需氧量(soluble chemical oxygen demand,SCOD)、有机酸、还原糖和氨氮。VFA和乙醇使用气相色谱法(GC2010,日本岛津公司)测定。SCOD使用COD测定仪(HACH DR/2000,美国HACH公司)进行消解,后使用分光光度法进行测定。还原糖采用DNS试剂法和分光光度法测定。氨氮采用凯氏定氮法测定。
1.3 理论甲烷产量及生物降解性
原料通过有机成分分析仪测定后得到C、H、O、N的含量,再将其转化为分子式CHON表示,可通过式(1)和式(2)得到单位VS的甲烷理论产量,通过式(3)可计算得出生物降解性[6]。
式中V为理论甲烷产量,L/g(以VS计);V为累积甲烷产量,L/g(以VS计)。
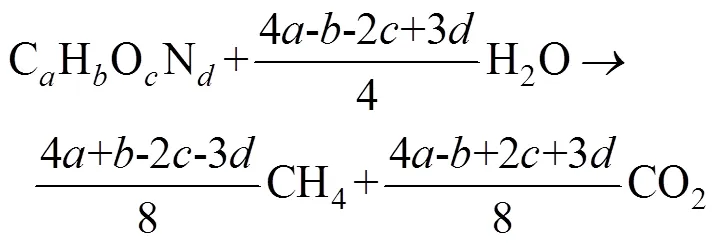


1.4 BMP测试试验设计
BMP测试装置中,厌氧反应瓶为500 mL血清瓶,用橡胶塞和封口膜进行密封,在35℃水箱中恒温反应。手动摇匀,每日固定时间采用排水法,利用量筒测定产气量,并用气相色谱仪(SP-2100,北京北分瑞利仪器公司)测定沼气各组分含量。
厌氧反应瓶总体积为500 mL,厌氧消化反应体积为300 mL。接种泥(I)和底物(S)的比值I:S=2(基于VS比),原料添加1.5 g(以VS计),接种泥加3 g(以VS计),根据原料和接种泥VS性质倒算回原料添加量(见表3),各厌氧反应瓶均补充蒸馏水到300 mL。在中温35℃下厌氧消化运行40 d。每组试验重复3次,并设置只添加接种泥的空白对照试验,以扣除接种泥自身产生的甲烷。接种泥性质见表2,各试验组别的原料和接种泥添加量见表3。

表3 原料和接种泥的添加量
注: 1. 原料和接种泥添加量基于:设计VS量/原料或接种泥VS%;2. 厌氧消化试验组按不同存储时间的原料进行分组。
Note: 1) The additive amount of material and inoculation are depending on the ration of additive VS amount and the VS% of material or inoculation. 2) The AD treatment groups are grouped according to the raw materials in different storage time.
2 结果与分析
2.1 不同存储时间玉米秸秆的性状分析
2.1.1 感官性状及化学性质分析
对经过不同时间存储后的玉米秸秆样品,进行感官和性质分析,分析结果分别见表4和表5。

表4 不同存储时间玉米秸秆感官性状
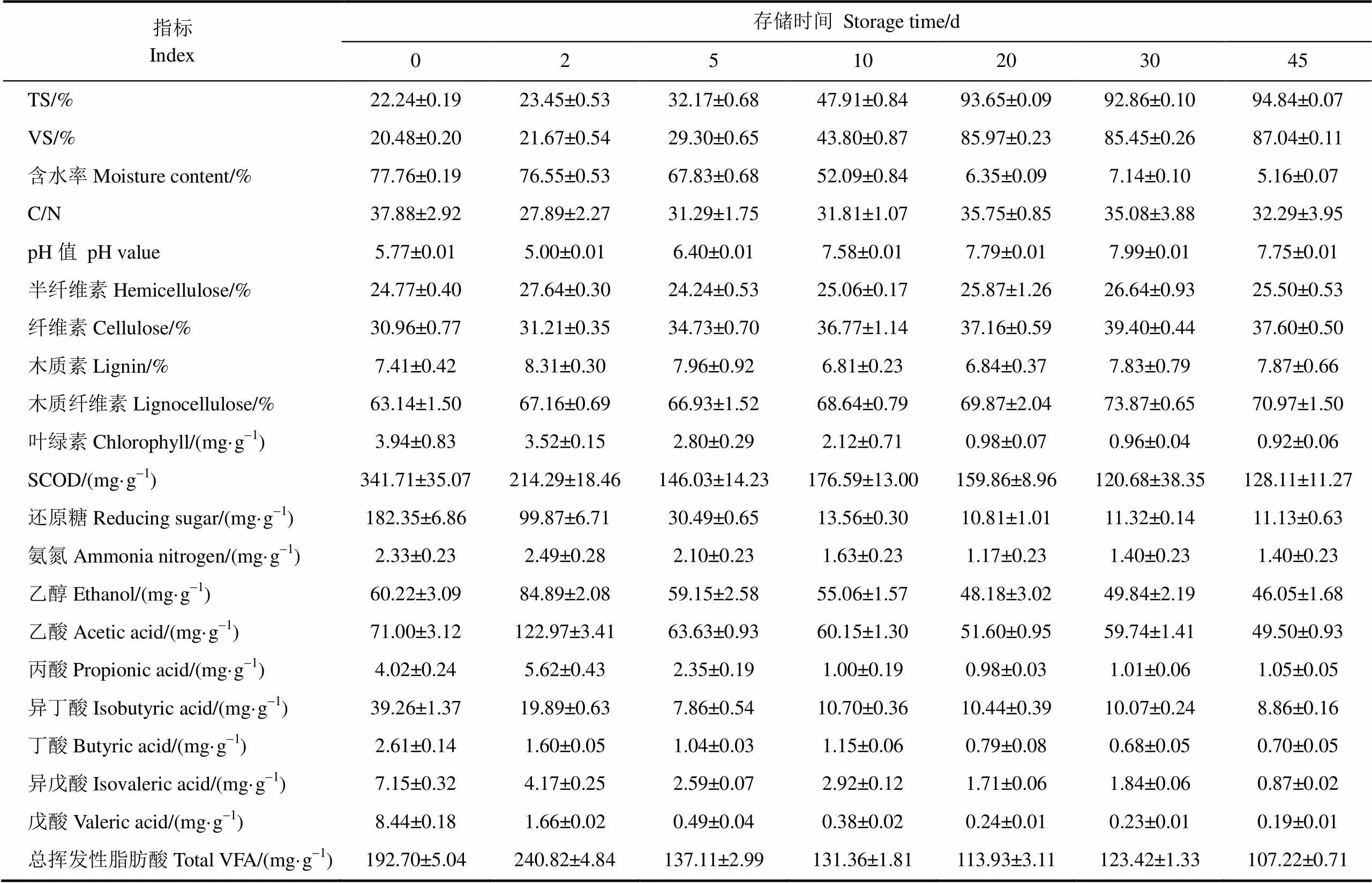
表5 不同存储时间玉米秸秆的性质
注:除TS、VS以外,其他性质的单位均基于干质量。
Note: The characteristics are based on the TS apart from TS and VS.
水分的变化最为直观,随存储天数增加,玉米秸秆含水率从77.76%下降到5.16%。存储20 d的秸秆(D20)感官上已经呈现干草状。观察TS和VS的变化,由于水分的不断下降,在存储0~20 d(D0~D20)TS和VS持续上升,在存储了20~45 d(D20~D45)TS和VS基本稳定,D20~D45含水率均低于8%。玉米秸秆在存储过程中水分不断蒸发,含水率下降,含水率会受到环境因素的影响,尤其是空气湿度。存储第9天至第19天有较长时间的大风晴好天气,空气平均相对湿度较低,在5%~12%之间,造成玉米秸秆较快的水分流失,因此D10~D20的TS明显上升,且D20的TS略高于D30。
通过对不同存储时间下玉米秸秆的性状观察发现(见表4),茎叶的颜色也有明显变化,从新鲜玉米秸秆的鲜绿色,到之后叶片呈现暗绿色,茎秆变黄。测定了样品叶绿素含量(见表5),结果发现,随着存储时间的延长,叶绿素含量下降,含水率较高的0~10 d叶绿素含量(2.12~3.94 mg/g)高于干草状的20~45 d叶绿素(0.92~0.98 mg/g)。可能是在存储过程中,叶绿素b转化为叶绿素a,经过多种酶的作用,最终降解为无色单毗咯氧化降解产物[21]。
存储过程中的木质纤维素含量总体呈现上升趋势(见表5),从新鲜玉米秸秆的63.14%到30 d的73.87%,45 d的木质纤维素含量略有下降,可能是微生物对纤维素和半纤维素的降解所致[22]。木质纤维素各成分中,具有明显上升趋势的是纤维素,纤维素作为细胞壁的主要支架,被半纤维素、木质素和果胶、蛋白质等物质包裹起来,且其结晶结构难以被微生物利用[23]。从表4可知,从2 d开始出现微生物活动的痕迹,2~45 d均有可见菌斑,通过颜色判断,以褐腐菌和霉菌为主要可见菌种。真菌作用分泌的酶类可以部分降解木质纤维素成分[24];而活性植物细胞和大部分微生物会优先利用除木质纤维素成分以外的易降解可溶性成分,同时离体后的植物细胞会加速老化,出现木质化[11-12],这会导致干物质中的木质纤维素含量上升。
各不同存储时间玉米秸秆的浸提性质(pH值、VFA、SCOD、还原糖、氨氮)变化较大(见表5)。
新鲜玉米秸秆浸提液pH值为弱酸性5.77,但存储2 d后(D2)pH值下降到最低5.00,之后pH值上升,从10 d开始pH值上升到弱碱性并稳定。通过表4的感官性状可知,2 d时有青贮感,气味有轻微酸味,尤其是下层未接触空气的部分,形成的厌氧环境促进了乳酸菌和其他产酸菌的作用[25]。随着存储时间的增加,有机酸和VFA被活性植物细胞和微生物作用进一步分解,VFA的部分挥发作用[26],以及植物细胞中生物碱的生成和释放[27],这些因素使得浸提液pH值上升。
VFA各组分随存储时间的变化情况见表5,0~5 d的VFA波动明显,2 d达到峰值,2~5 d迅速下降。而5 d之后的VFA含量比较稳定,说明原料降解产生的VFA和消耗量达到平衡。VFA各个组分占比最高为乙醇、乙酸,其他各成分基本随着存储时间的增加而下降,而乙醇和乙酸在2 d达到峰值,因微生物作用而产生的有机酸使得2d的pH值下降。主要是由于存储过程中下层玉米秸秆处在厌氧环境下,因为产酸菌和酵母菌的厌氧作用,出现产乙酸和产乙醇现象[12,21]。
SCOD单位TS含量的变化趋势在0~5 d迅速下降,降幅57.26%,10 d的出现略微上升,之后趋于稳定,0~45 d整体降幅达到62.51%。10 d的玉米秸秆在所有存储过程中霉味最重,在茎秆上出现了大量可见霉斑。含水率在12%~60%的范围微生物活性最大[28],10 d前后正好处在这一含水率范围。活跃的霉菌和腐败菌作用可能导致原料的分解加剧,从而使得SCOD略有上升。
还原糖的变化趋势可见,新鲜玉米秸秆具有很高的还原糖含量,而0~5 d迅速下降,下降了83.28%,10~45 d还原糖含量维持在较低水平,0~45 d总体下降了93.90%,可溶出还原糖基本消耗殆尽。由于还原糖是活性植物细胞和微生物优先利用的碳源[22],因此呈现初期迅速下降,之后保持低浓度稳定。较低的还原糖含量会抑制主要依赖其为碳源的微生物的生长[12]。
氨氮产生于生物作用下含氮物质的降解及转化过程[29]。在2 d时氨氮达到最大值,由于此时旺盛的生物活性。之后由于生物活性减弱和氨氮的挥发,随着存储时间增加氨氮含量降低并趋于稳定。
上述各浸提性质在0~5 d均出现了较大的变化,而之后逐渐趋于稳定。其他各性状及化学性质在20~45 d也比较相近。微生物利用原料进行降解的过程,水分含量起到重要作用,较低的水分含量抑制了微生物的生长[28,30],对原料的降解作用较低,因而20~45 d的各性质变化幅度小,较为稳定。
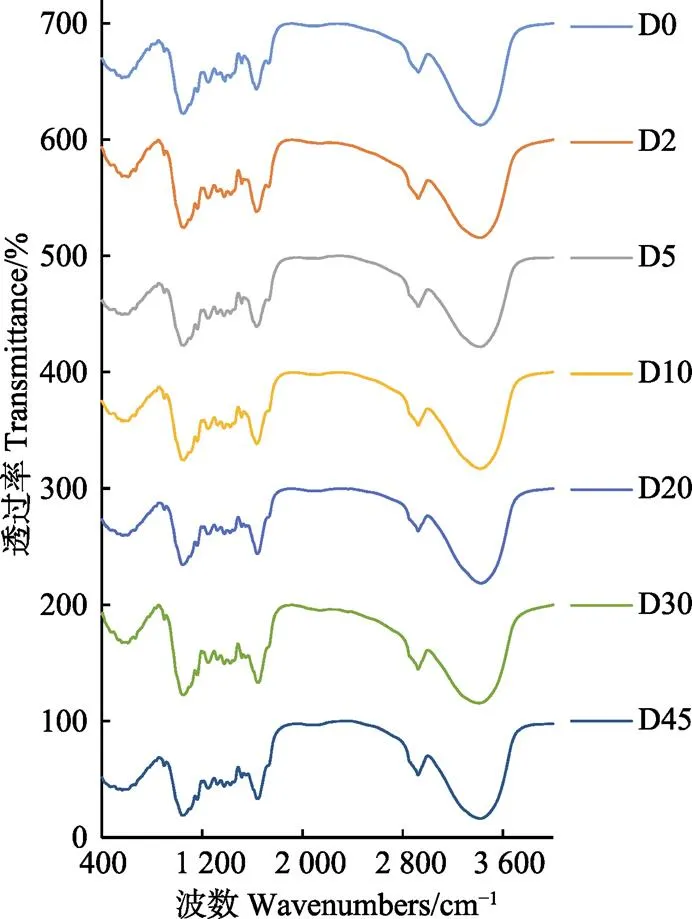
2.1.2 不同存储时间玉米秸秆的FT-IR分析
图1为不同存储时间的FT-IR图谱。在3 421 cm-1和2 924 cm-1附近的峰主要为纤维素上氢键的C-H和O-H振动峰[31],可以表征结晶纤维素的变化。相较新鲜玉米秸秆,经过存储的玉米秸秆在2 921 cm-1附近的峰有所加强,说明结晶纤维素所占比例增加。1 730 cm-1附近的峰表征半纤维素中的乙酰基,木质素的糖醛酯键或半纤维素中的阿魏酸和香豆酸羧基的酯键[25],在D0和D2有明显的峰值,之后的存储时间几乎不出峰,说明存储过程半纤维素和木质素中的乙酰基和酯键被明显破坏,部分半纤维素和木质素降解。1 516和1 424 cm-1附近的峰表征了木质素中的芳香环,1 247 cm-1附近的峰表征了愈创木基中的C-O振动峰[7],以上能够表征木质素的基团结构变化,对比发现,这3个峰均在D0~D5加强,D10和D20出现减弱,之后D30和D45又逐渐加强,此现象和木质素测定结果一致,可能由于D10前后活跃的真菌活动导致木质素的部分降解,使得峰值减弱,随着存储时间的延长,对非木质纤维素成分的进一步生化降解作用使得木质素占干物质的比例上升。
2.2 不同存储时间玉米秸秆的BMP
2.2.1 不同存储时间玉米秸秆的累积和日产甲烷量
图2为不同存储时间秸秆产沼气中的甲烷含量。图3a和图3b分别为经过水力停留时间(hydraulic retention time,HRT)为40 d厌氧消化的反应,不同存储时间玉米秸秆基于单位VS计算的累积产甲烷量和日产甲烷量图。
图2展现了不同存储时间秸秆产沼气中的甲烷含量的变化趋势,可以发现每组原料厌氧消化产生的沼气中甲烷含量变化趋势一致,均为刚开始厌氧消化甲烷含量迅速上升,至厌氧消化第4天,甲烷占比>50%,之后稳定在54%~60%之间。
注:D0~D45表示不同存储时间下的原料,下同。
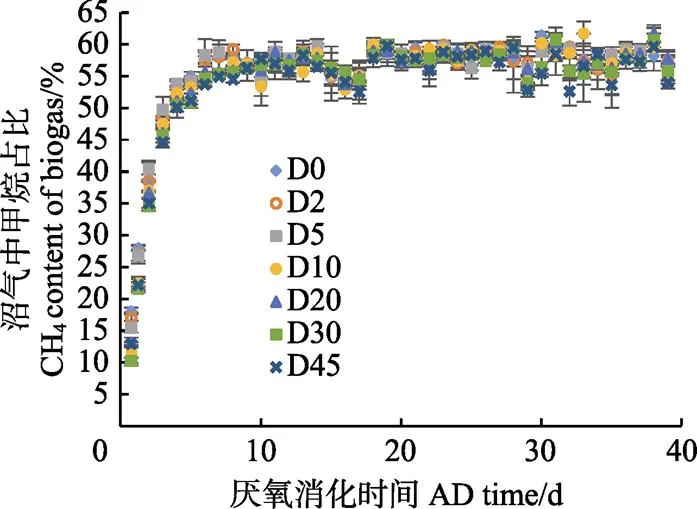
图2 不同存储时间玉米秸秆产气的甲烷含量
不同存储时间玉米秸秆累积产甲烷量见图3a,各试验组的累积产甲烷量趋势相近。厌氧消化进行2~10 d具有很高的产甲烷速率,且各组初期的产甲烷速率,随着存储时间的增加而下降;在厌氧消化20 d以后,各组的累积产甲烷量趋于稳定。D0始终具有最高的累积产甲烷量,D2的产甲烷速率和累积产甲烷量均略低于D0。D5和D10的累积产甲烷量居中。D20、D30和D45的累积产甲烷量图线大致重合,各阶段的累计产甲烷量接近(>0.05)。这3组的原料状态均为干草,且各个感官性状和化学性质较为相似。可能由于原料中较低的可溶性成分含量,D20~D45在厌氧发酵初期(0~15 d)甲烷产量低于其他各组。Miao等[18]的研究结果表明,自然存储15 d 的蓝藻具有最高的累积产甲烷量,明显高于新鲜蓝藻,这与本试验结果不同。分析原因为,Miao等在存储过程中添加蒸馏水以补充存储过程中的水分损失,湿润的环境保持了存储过程中微生物的活性,从而促进微生物对原料的分解,生成具有甲烷潜力的物质,此外,玉米秸秆和蓝藻的成分差异也是累计产甲烷趋势差异的原因。
不同玉米秸秆日产甲烷量的情况见图3b,各组均表现为出现一个明显的产甲烷高峰(AD进行1.25~6 d)和一个较低的产甲烷峰值(AD进行6~10 d),之后日产甲烷量趋于平缓。各组均在厌氧消化进行的3 d或是4 d到达甲烷产量高峰,其中D0在4 d达到日产甲烷量最大值为38.40 mL/g,其他各组D2~D45峰值分别为35.66、31.75、25.20、10.57、9.30、9.50 mL/g,日产甲烷量的最大峰值基本随着存储时间的增加而降低。D0在AD进行初期的延滞时间很短,D2和D5的延滞时间为18 h左右,其他各组延滞时间在30 h左右。由于D0和D2原料中具有较高的可溶性有机物质,如乙酸、乙醇、还原糖等,AD过程中可以较快被微生物利用[32],从而提高了初期的日产甲烷量,缩短了延滞时间。可以观察到,D20~D45虽然初期具有较低的峰值和较长的延滞时间,但厌氧消化进行10 d以后的日产甲烷量较其他组相比略高,并一直保持到厌氧消化进行40 d。

图3 不同存储时间玉米秸秆的累积和日产甲烷量
2.2.2 不同存储时间玉米秸秆的BMP分析
1)不同存储时间玉米秸秆的BMP、理论产甲烷量及生物降解性
不同存储时间玉米秸秆的理论产甲烷量、实际产甲烷量和生物降解性的数值见表6所示。实际产甲烷量即为试验得到的BMP值。D0的BMP最高,达到325.49 mL/g,之后随着存储时间的延长,BMP呈现下降趋势,其中,D5的BMP为297.85 mL/g,较D0降低了8.49%,BMP最低的D30为287.83 mL/g,较D0降低了11.57%。存储时间大于5 d的玉米秸秆(D5~D45)值较为相近,变化率在3.5%以内。
各组的生物降解性D0最高,且随着存储时间的增加,生物降解性下降。D2的生物降解性下降明显,在存储时间大于5 d以后,生物降解性较相近。由于存储初期阶段(D0~D5),植物活性细胞和微生物具有较高的生物活性,利用了原料中部分可生物降解成分以完成自身新陈代谢[12],而随着存储时间的延长,含水率大大降低,植物活性细胞和微生物不能维系细胞的新陈代谢作用,致使物活性降低或细胞死亡[28],这使得随着存储的进行,微生物对原料的降解速率大大下降,从而使得甲烷化过程的生物降解性明显下降;同时,原料的易生物利用组分如还原糖在存储初期被大量消耗,而原料降解作用产生的还原糖不能及时供给生物利用,对生物活性有一定的抑制作用[25]。因而,存储后期的原料因性状差异小,对甲烷化的生化降解性影响不大。
值得注意的一点,在存储过程中存在明显地干物质损失。通过存储记录和计算发现,本试验新鲜玉米秸秆经过45 d的堆放存储,干物质损失率达到了27.95%。如此高的干物质损失率会造成原料大量的能量流失,损失了较多的甲烷潜力[33]。由于植物活性细胞的呼吸作用和多种微生物,如霉菌、腐败菌、梭菌和酵母等,大量繁殖导致自然存储过程中干物质损失严重[25]。当考虑存储45 d的干物质损失时,玉米秸秆产甲烷潜力换算为单位VSorig,为206.76 mL/g(基于单位VSorig),和新鲜玉米秸秆的BMP相比,下降了36.48%,甲烷潜力损失严重。
2)不同存储时间玉米秸秆和BMP关系
从表6中可知,随着存储时间的延长,BMP值呈现下降趋势。在D0~D5下降明显,D5之后趋于稳定。此变化趋势和不同存储时间玉米秸秆的浸提性质变化规律一致,BMP值可能受到原料中可溶性成分的影响。对玉米秸秆进行自然堆放存储,短期的存储(小于5 d)会明显降低玉米秸秆的甲烷潜力,但延长存储时间对BMP的影响可能不大,因其较低的含水量和稳定的化学成分。

表6 不同存储时间试验组的理论产甲烷量、实际产甲烷量和生物降解性
2.2.3 性状与BMP的相关性
表7为各个存储时间玉米秸秆性质与BMP的相关性和显著性分析。其中,木质纤维素和BMP呈现负相关关系,相关系数值为-0.886 6,而木质纤维素组分中的纤维素和BMP的相关性达到了-0.9567,说明较高的木质纤维素含量不利于厌氧消化生产甲烷,尤其是较高的纤维素含量。浸提性质中的SCOD、还原糖和总VFA的相关性分别为0.958 1、0.968 2、0.852 5,相关性均较高,说明原料中较高的SCOD、还原糖和总VFA可溶性成分含量可以提高产甲烷潜力。

表7 原料性质与BMP的相关性
3 结 论
1)含水率随着玉米秸秆存储时间的增加而下降,存储20 d以后秸秆呈干草状。木质纤维素含量随存储时间的增加略有上升。存储2 d的玉米秸秆具有最低的pH值和最高的总挥发性脂肪酸含量。可溶性化学需氧量和还原糖等浸提性质含量均在存储0~5 d间迅速下降,之后随着存储时间的延长趋于稳定。
2)存储0、2、5、10、20、30、45 d的产甲烷潜力分别为325.49、315.35、297.85、296.71、295.25、287.83、291.01 mL/g(以VS计)。随着存储时间的增加,产甲烷潜力下降,且存储0~5 d的下降速率较快,存储大于5 d的产甲烷潜力相近。同样,生物降解率也随存储时间延长而下降。考虑45 d存储过程中的干物质损失,甲烷潜力损失达到36.48%。
3)产甲烷潜力受到多种原料性质的影响。尤其是木质纤维素、可溶性化学需氧量、还原糖、挥发性脂肪酸。
[1] 国家发展和改革委员会,农业农村部. 全国农村沼气发展“十三五”规划[Z]. 2017.
[2] 国家发展和改革委员会,农业农村部. 关于印发编制“十三五”秸秆综合利用实施方案的指导意见的通知[Z]. 2016.
[3] 杨茜,鞠美庭,李维尊. 秸秆厌氧消化产甲烷的研究进展[J]. 农业工程学报,2016,32(14):232-242.Yang Qian, Ju Meiting, Li Weizun. Review of methane production from straws anaerobic digestion[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(14): 232-242. (in Chinese with English abstract)
[4] 刘旭凡,冯紫曦,孙家堂. 农户秸秆处理行为研究综述[J]. 中国人口·资源与环境,2013,23(11):412-415.Liu Xufan, Feng Zixi, Sun Jiatang. Research on farmer household behavior of straw processing[J]. China Population,Resources and Environment, 2013, 23(11): 412-415. (in Chinese with English abstract)
[5] 童晶晶,刘蕊,张明顺. 关于生物质能利用现状及政策启示[J]. 环境与可持续发展,2015,40(4):127-129.Tong Jingjing, Liu Rui, Zhang Mingshun. Current situation and policy implication for biomass energy utilization[J]. Environment and Sustainable Development, 2015, 40(4): 127-129. (in Chinese with English abstract)
[6] 周琪. 餐厨垃圾与玉米秸秆联合协同近同步厌氧消化性能的研究[D]. 北京:北京化工大学,2015. Zhou Qi. Effect of Synergistic Effect and Near-synchronization of Food Waste and Corn Stover Anaerobic Co-digestion[D]. Beijing: Beijing University of Chemical Technology, 2015. (in Chinese with English abstract)
[7] 刘志华. 粉碎和存储方式对木质纤维素转化影响的研究[D]. 天津:天津大学,2013.Liu Zhihua. Evaluation of Size Reduction and Storage Methods for the Conversion of Lignocellulosic Biomass[D]. Tianjin: Tianjin University, 2013. (in Chinese with English abstract)
[8] 王雅雅. 几种典型农业废弃物高含固率厌氧共发酵产气性能与协同机理研究[D]. 北京:中国农业大学,2018.Wang Yaya. Performance of Methane Production and Synergy Mechanism at High Solid Content Anaerobic Co-digestion Using Typical Agricultural Wastes[D]. Beijing: China Agricultural University, 2018. (in Chinese with English abstract)
[9] Li Kun, Liu Ronghou, Sun Chen. A review of methane production from agricultural residues in China[J]. Renewable and Sustainable Energy Reviews, 2016, 54: 857-865.
[10] Wellinger A, Murphy J, Baxter D. The Biogas Handbook[M]// Bochmann G, Lucy F R. Storage and Pre-treatment of Substrates for Biogas Production. Cambridge: Woodhead Publishing Limited, 2013: 85-103.
[11] 公美玲. 玉米秸秆青贮过程中的营养动态研究[D]. 济南:山东农业大学,2013.Gong Meiling. Study on the Nutrient of Dynamic of Corn Stalks in Silage[D]. Jinan: Shandong Agricultural University, 2013. (in Chinese with English abstract)
[12] 王寒. 玉米秸秆的青贮及水解方法的研究[D]. 天津:天津大学,2011. Wang Han. The Research on Silage and Hydrolysis Methods of Corn Stalk[D]. Tianjin: Tianjin University, 2011. (in Chinese with English abstract)
[13] Carrere H, Antonopoulou G, Affes R, et al. Review of feedstock pretreatment strategies for improved anaerobic digestion: From lab-scale research to full-scale application[J]. Bioresource Technology, 2016, 199: 386-397.
[14] Egg R P, Coble C G, Engler C R, et al. Feedstock storage, handling and processing[J]. Biomass & Bioenergy, 1993, 5(1): 71-94.
[15] Moller H B, Sommer S G, Ahring B K. Biological degradationand greenhouse gas emissions during pre-storage of liquid animal manure[J]. Journal of Environmental Quality, 2004, 33: 27-36.
[16] 袁玲莉,王林军,刘刚金,等. 储存时间对芒草能源作物产甲烷潜力的影响[J]. 中国沼气,2016,34(3):24-30. Yuan Lingli, Wang Linjun, Liu Gangjin, et al. Effect of storage times on biochemical methane potential after miscanthus sinensis harvest[J]. China Biogas, 2016, 34(3): 24-30. (in Chinese with English abstract)
[17] 赵明星,阮文权. 不同存放时间太湖蓝藻产沼气潜力[J]. 环境工程学报,2013,7(4):1495-1499. Zhao Mingxing, Ruan Wenquan. Biogas production potential of Taihu cyanobacteria at different storage times[J]. Chinese Journal of Environmental Engineering, 2013, 7(4): 1495-1499. (in Chinese with English abstract)
[18] Miao Hengfeng, Lu Minfeng, Zhao Mingxing, et al. Enhancement of Taihu blue algae anaerobic digestion efficiency by natural storage[J]. Bioresource Technology, 2013, 149(4): 359-366.
[19] Greenberg A E, Clesceri L S, Eaton A D. Standard methods for the examination of water and wastewater[J]. Am J Public Health Nations Health, 1966, 56(3): 387-388.
[20] Soest P J V, Robertson J B, Lewis B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597.
[21] 杨晓棠,张昭其,徐兰英,等. 植物叶绿素的降解[J]. 植物生理学通讯,2008(1):7-14. Yang Xiaotang, Zhang Zhaoqi, Xu Lanying, et al. Plant chlorophyll degradation[J]. Plant Physiology Journal, 2008(1): 7-14. (in Chinese with English abstract)
[22] 范华. 秸秆保存方法和时间对营养价值的影响[D]. 太谷: 山西农业大学,2001. Fan Hua. Effects of Conservation Methods and Time on the Nutritive Value of Straw[D]. Taigu: Shanxi Agricultural University, 2001. (in Chinese with English abstract)
[23] Van Dyk J S, Pletschke B I. A review of lignocellulose bioconversion using enzymatic hydrolysis and synergistic cooperation between enzymes-Factors affecting enzymes, conversion and synergy[J]. Biotechnology Advances, 2012, 30 (6): 1458-1480.
[24] Hélène Carrere, Antonopoulou G, Affes R, et al. Review of feedstock pretreatment strategies for improved anaerobic digestion: From lab-scale research to full-scale application[J]. Bioresource Technology, 2015, 199: 386-397.
[25] Pahlow G, Muck R E, Driehuis F, et al. Microbiology of ensiling[M]// Al-Amoodi L, Barbarick KA, Volenec JJ, et al. Silage Science and Technology. USA: American Society of Agronomy, 2003: 31-93.
[26] 李国媛. 秸秆腐熟菌剂的细菌种群分析及其腐熟过程的动态研究[D]. 北京:中国农业科学院,2007. Li Guoyuan. Study on Bacteria Communities of Straw-Decomposing Inoculant and the Dynamic Change in the Process of Fermentation[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007. (in Chinese with English abstract)
[27] 唐中华,于景华,杨逢建,等. 植物生物碱代谢生物学研究进展[J]. 植物学通报,2003,20(6):696-702. Tang Zhonghua, Yu Jinghua, Yang Fengjian, et al. Metabolic biology of plant alkaloids[J]. Chinese Bulletin of Botany, 2003, 20(6): 696-702. (in Chinese with English abstract)
[28] 罗维,陈同斌. 湿度对堆肥理化性质的影响[J]. 生态学报, 2004,24(11):2656-2663. Luo Wei, Chen Tongbin. Effects of moisture content of compost on its physical and chemical properties[J]. Acta Ecologica Sinica, 2004, 24(11): 2656-2663. (in Chinese with English abstract)
[29] Chen Ye, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: A review[J]. Bioresource Technology, 2008, 99(10): 4044-4064.
[30] 金钟跃,包怡红,王振宇,等. 植物纤维素微生物降解条件[J]. 东北林业大学学报,2004,32(3):44-45. Jin Zhongyue, Bao Yihong, Wang Zhenyu, et al. Microbial degradation conditions for plant cellulose[J]. Journal of Northeast Forestry University, 2004, 32(3): 44-45. (in Chinese with English abstract)
[31] Fu Shanfei, Wang Fei, Yuan Xianzheng, et al. The thermophilic (55°C) microaerobic pretreatment of corn straw for anaerobic digestion[J]. Bioresource Technology, 2015, 175: 203-208.
[32] Mcdonald P, Henderson A R, Heron S J E. The Biochemistry of Silage[M]. Marlow: Chalcombe Publications, 1991: 341.
[33] Herrmann C, Idler C, Heiermann M. Improving aerobic stability and biogas production of maize silage using silage additives[J]. Bioresource Technology, 2015, 197: 393-403.
Effect of storage time on physiochemical properties and methanogenesis potential of maize straw
Yuan Lingli1, Liu Yanping2, Yuan Yu2, Zhou Liye1,3※
(1.310020,2.1000293.213125)
China is a large agricultural country, and crop straw is one of the main components of the agricultural waste. Anaerobic digestion (AD) to produce biogas is an efficient way for straw utilization. Utilizing straws as raw materials in biogas projects are usually need to be stored for a period of time after harvesting. Different storage time has effects on the biochemical methane potential (BMP) of straws. In this paper, we analyzed the change of physical & chemical properties and effects on the BMP of maize () straw under the circumstances of storage time for 0, 2, 5, 10, 20, 30 and 45 days piled naturally with room temperature. Physicochemical properties, such as sensory properties, total solid (TS), volatile solids (VS), pH, lignocellulose, chlorophyll, volatile fat acid (VFA), ammonia nitrogen, etc., were analyzed under different storage time. The results indicate that the properties of straws tended to be stable after 20 days of storage. As the storage time increased, the water content decreased, and the straw looked like hay after 20 days of storage. The soluble characteristics extracts, such as soluble chemical oxygen demand (SCOD), reducing sugar and VFA, decreased rapidly during storage for 0 - 5 days, and then were stable after around the 5th days. The content of lignocellulose in the storage process was generally increasing. The BMP tests on straws with different storage time showed that the BMP value with different storage time for 0, 2, 5, 10, 20, 30 and 45 days were 325.49, 315.35, 297.85, 296.71, 295.25, 287.83 and 291.01 mL/g (in VS), respectively. As the storage time increased, the BMP showed an overall downward trend, and the methane production rate of storage time for 0 - 5 d was decreased significantly, while the rate tend was stable after storage for 10 days. The BMP with storage for more than 5 days (10 d, 20 d, 30 d and 45 d) were roughly similar. During the whole AD period, the cumulative methane production trends of the respective experimental group were similar, while the daily methane production showed a higher peak (AD period at 1.25 - 6 d) and a lower peak (AD period at 6 - 10 d). After the two peaks, the daily methane production tended to be stable. The biodegradability of each group showed that the fresh straw (without storage) had the highest biodegradability, and the biodegradability decreased with the storage time lasting. With the reducing of moisture content and sugar content during the storage, the metabolism of plant cells and microorganisms were weakened or even die. Thereby, extending the storage time had slight effect on each property and BMP of straw. There was a significant TS loss during the storage procedure because of the plant cell respiration and the microbial biochemistry. Considering the TS loss, the methane potential loss reached to 36.48%. We concluded that maize straw storage for different lengths of time had a significant effect on the BMP, mainly due to the influence of various chemical components, especially moisture lignocellulose, SCOD, reducing sugar and volatile fat acid. The results can provide reliable references for the straw biogas projects operation.
biogas; straw; anaerobic digestion (AD); biochemical methane potential (BMP); storage time
10.11975/j.issn.1002-6819.2019.13.025
X7
A
1002-6819(2019)-13-0210-08
2018-11-14
2019-06-05
国家科技重大专项课题-污泥与废弃物处置及资源化利用技术集成与综合示范(2017ZX07202005)
袁玲莉,工程师,从事沼气工程及固废资源化利用研究和工艺设计。Email:zghzyll@qq.com
周丽烨,高级工程师,杭州能源环境工程有限公司董事长,从事固废资源化利用及水处理资源化利用。Email:zhouliye@heee-biogas.com
袁玲莉, 刘研萍, 袁 彧, 周丽烨.存储时间对玉米秸秆理化性状及产甲烷潜力的影响[J]. 农业工程学报,2019,35(13):210-217. doi:10.11975/j.issn.1002-6819.2019.13.025 http://www.tcsae.org
Yuan Lingli, Liu Yanping, Yuan Yu, Zhou Liye.Effect of storage time on physiochemical properties and methanogenesis potential of maize straw[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(13): 210-217. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.13.025 http://www.tcsae.org

