聚苯乙烯微塑料和罗红霉素对斜生栅藻(Scenedesmus obliquus)和大型溞(Daphnia magna)的联合效应研究
姜航,丁剑楠, ,黄叶菁,陈微懿,邹华, *,史红星
1. 江南大学环境与土木工程学院,江苏 无锡 214122;2. 江苏省水处理技术与材料协同创新中心,江苏 苏州 215009;3. 国民核生化灾害防护国家重点实验室,北京 102205
塑料以其良好的经济适用性成为生产生活中必不可少的材料。据统计,全球塑料年产量已从1950年的 170万吨增长到 2016年的 3.4亿吨(Murphy et al.,2017;Prokić et al.,2019)。与此同时,大量的塑料被丢弃,不可避免地会进入土壤和水生态系统。这些废塑料经过机械磨损、热解、水解和生物降解,逐渐降解成直径小于5 mm的碎片,即所谓的微塑料(Microplastics,MPs)(Law et al.,2014)。海洋环境中的MPs污染已在世界范围内普遍证实(Eriksen et al.,2014;Andrady et al.,2011)。近期,在淡水环境中,也报道了MPs的广泛检出(Su et al.,2016;Wang et al.,2017;Eerkes-Medrano et al.,2015)。水体中的MPs容易被水生生物误食或者吸附于生物体表面(Kolandhasamy et al.,2018),通过食物链传递(Mattsson et al.,2014),进而影响水生生物的生理代谢、生长发育和繁殖等过程(Wright et al.,2013;Mao et al.,2018;Blarer et al.,2016)。
MPs具有比表面积大,疏水性强的特点,极有可能吸附水环境中的其他污染物,形成复合污染(Brennecke et al.,2016;Ziccardi et al.,2016);这也导致风险源对水生生物的污染胁迫途径愈发复杂(Savoca et al.,2017),可能会造成不可预知的生态风险。目前,有关MPs与水环境中其他污染物复合污染的研究刚刚起步,且多集中于和多环芳烃、多氯联苯等传统污染物的联合效应研究(Batel et al.,2016;Sleight et al.,2017;Karami et al.,2016;Oliveira et al.,2013),有关MPs与其他新兴有机污染物之间的相互作用研究仍然有限。
抗生素是近年来受到较高关注的一类新兴有机污染物。由于存在滥用现象,抗生素在我国水环境中的赋存较为广泛(Liu et al.,2013)。罗红霉素(Roxithromycin,ROX)是一种大环内酯类抗生素,普遍应用于呼吸道,泌尿和软组织感染等病症的治疗。目前,ROX已在世界范围内的水环境中广泛检出。在意大利北部波河流域某污水厂进出水中发现ROX 的浓度为 65-290 ng·L-1(Verlicchi et al.,2014);冬季我国湘江水体中ROX的浓度范围为1.4-190 ng·L-1(Lin et al.,2018);Kleywegt et al.(2011)甚至在加拿大饮用水中发现了ROX的赋存(5 ng·L-1)。研究表明,ROX能在水生生物体内累积,并对其神经、代谢和氧化应激等生理生化功能产生影响(Liu et al.,2014;Besseling et al.,2015;Alomar et al.,2017)。然而,水环境中共存的MPs如何影响 ROX在淡水生物的吸收、分布、累积和代谢等毒理动力学过程,是否会引发毒性增敏效应,目前还未可知。
浮游生物是水生生态系统的重要组成部分,对水生生态系统的物质循环、能量生产和传递均有重要作用。然而,目前有关MPs水生毒理学的研究多集中于鱼类(de Sá et al.,2018),有关MPs和抗生素复合污染对浮游生物的联合毒性效应研究还较为缺乏。本文以我国淡水水域中常见的浮游植物斜生栅藻(Scenedesmus obliquus)和浮游动物大型溞(Daphnia magna)作为模式生物,探究MPs和ROX复合污染对浮游生物的生理生化过程的交互效应。研究结果可为水环境中新兴污染物的生态风险评价和控制提供理论支持,同时可为水体中新兴污染物环境标准的制定提供依据。
1 材料与方法
1.1 化学品和试剂
绿色荧光聚苯乙烯(Polystyrene,PS)微球(粒径为0.1 μm,密度为10 mg·mL-1)购自大鹅(天津)科技有限公司。PS-MPs原液在4 ℃下避光储存,并在每次使用前进行超声处理。ROX标准品(纯度>98%)购自上海升德医药科技有限公司,在4 ℃下避光保存,使用甲醇制备母液,并在-20 ℃下保存。
1.2 受试生物
斜生栅藻和大型溞购自中科院水生生物研究所(武汉)。斜生栅藻在BG11培养基中培养,并置于光照培养箱(GZX-250BSH-Ⅲ,上海新苗医疗器械制造有限公司)内进行扩大繁殖和驯化培养。温度控制在(25±1) ℃,光照强度为8000 lux,光暗比为12 h∶12 h。每天定期振荡3次,每隔1-2周移种,以纯化藻种并使其同步生长。
大型溞用超纯水配制的重组水进行培养,每1000 mL重组水中含有58.5 mg CaCl2·2H2O,24.7 mg MgSO4·7H2O,13.0 mg NaHCO3和 1.2 mg KCl。大型溞置于光照培养箱中培养,温度控制在(25±1) ℃,光照强度为 2000 lux,光暗比为 12 h∶12 h。在培养期间,培养液每周更换 3次,并每天以斜生栅藻对大型溞进行喂食,喂食的藻细胞密度为105cells·mL-1。
1.3 实验设置
1.3.1 斜生栅藻暴露实验
经实验室培养驯化后,将斜生栅藻分别置于250 mL锥形瓶,将荧光PS-MPs和/或ROX原液添加到藻液。暴露处理包括空白对照、PS-MPs单独暴露(1000 μg·L-1PS-MPs)、ROX 单独暴露(2.5 μg·L-1ROX)、PS-MPs与 ROX 共同暴露(1000 μg·L-1PS-MPs+2.5 μg·L-1ROX)。每种暴露处理包括 3个平行试验,初始藻细胞密度为 1×106cells·mL-1,体积为200 mL。暴露周期为72 h,在暴露的第0、6、12、24、36、48和72小时,测定各暴露组藻细胞密度、叶绿素a含量和最大光化学量子产量(Fv/Fm)等生理指标。在各时间点用玻璃吸管取暴露液样品后,对样品进行 10 min的离心(1000×g),离心结束后,将上清液转移至 15 mL离心管,保存于-80 ℃冰箱中用于测量暴露液中ROX浓度。
1.3.2 大型溞暴露实验
经实验室培养驯化后,将空腹24 h的成年大型溞分别置于100 mL烧杯中,每杯加入50 mL培养液,将荧光PS-MPs和/或ROX原液添加到大型溞培养液中,制备试验溶液。暴露处理包括空白对照、PS-MPs单独暴露(250 μg·L-1PS-MPs)、ROX 单独暴露(5 μg·L-1ROX)、PS-MPs与 ROX 共同暴露(250 μg·L-1PS-MPs+5 μg·L-1ROX)。每种暴露处理包括3个平行试验。喂养实验选取10只大型溞,投加藻细胞密度为1×106cells·mL-1的斜生栅藻,避光暴露 5 h,测定暴露前后暴露液中斜生栅藻藻细胞密度,以计算大型溞的牧食率以及滤水率。生物标志物实验选取30-35只大型溞,绝食暴露48 h后,称重后放入-80 ℃冰箱保存待测。
1.4 生理生化指标检测
使用血球计数板在光学显微镜下检测藻细胞密度;采用丙酮萃取分光光度法测定藻胞内叶绿素 a浓度(戴欣等,2013),再根据公式:
叶绿素含量(mg·g-1)=叶绿素浓度×提取液体积×稀释倍数/样品鲜重 (1)
计算叶绿素含量(关爱农等,2009);使用FluorCam封闭式叶绿素荧光成像系统(FluorCam 800F)测定Fv/Fm。
参考Ding et al.(2015)的方法对样品中ROX浓度进行测定。将各时间点取的暴露液样品,经0.45 μm玻璃纤维过滤器过滤以去除杂质,过HLB固相萃取柱纯化,以6 mL甲醇洗脱,氮吹至干,最后用甲醇定容至1 mL。采用超高效液相色谱串联质谱仪(UPLC/MS/MS)(Waters ACQUITY UPLC Xevo TQ)对ROX进行定量分析。在Acquity BEH C18柱(100 mm×2.1 mm×1.7 μm)上进行层析分离。流动相溶液设定:A为0.1%甲酸溶液,B为100%乙腈。具体流动相梯度如表 1所示。流速设置为0.3 mL·min-1。每次样品进样体积为5 μL。质谱检测的电喷雾电离源(ESI)设定为正模式。ROX的质谱优化参数:停留时间 328 ms;母离子质荷比为837.50;子离子质荷比为158.00;碰撞能量30.0 V;碰撞电压37.0 V;保留时间1.58 min。外标法定量,ROX标准曲线的R2>0.99。

表1 流动相梯度变化Table 1 Change in mobile phase for target compound
按照商业试剂盒(中国苏州科铭生物科技有限公司)说明书要求测定超氧化物歧化酶(Superoxide Dismutase,SOD)和过氧化氢酶(Catalase,CAT)等细胞水平生物标志物。
1.5 数据分析
牧食率和滤水率是大型溞喂养实验的常规指标,常用来验证外源污染物的富集是否会影响其对食物的摄入。牧食率(I)指某特定时间内每只大型溞所消耗的绿藻的藻细胞个数,单位为cell·(ind·h)-1;滤水率(F)指一定量水样中大型溞个体在单位时间内滤过的含有一定数量绿藻的水样量,单位可表示为μL·(ind·h)-1。滤水率和牧食率的计算公式为:

式中C0和Ct分别表示为起始和终点斜生栅藻的藻细胞密度(cell·μL-1);t为试验时间;n 表示容器中大型溞的个数;V为试验水样体积;Ct′为对照组终点藻细胞密度;A是指修正系数。
研究结果采用SPSS 22.0进行统计分析,单因素方差分析进行差异性检验(One-way ANOVA,Duncan检验),分析结果用平均值±标准误(Mean±SE)表示。
2 结果与讨论
2.1 暴露液中ROX的浓度变化

图1 72 h暴露期间ROX单独暴露组和PS-MPs与ROX共同暴露组暴露液中ROX浓度随时间变化Fig. 1 Temporal change in ROX concentration in media in ROX-alone treatment and PS-MPs+ROX co-treatment during 72 h exposure
如图1所示,在ROX单独暴露组中,暴露开始时(0 h),暴露液中ROX的平均浓度为(2.4±1.0)μg·L-1。暴露开始24 h后,暴露液中ROX的浓度显著降低(P<0.05),此时 ROX 的平均浓度为(1.5±0.3) μg·L-1;随后,暴露液中的 ROX 浓度趋于平衡。而在MPs与ROX共同暴露组中,暴露开始时(0 h),ROX 的平均浓度为(2.7±0.4) μg·L-1。暴露开始 24 h后,暴露液中 ROX的浓度显著降低(P<0.05),其平均浓度为(1.2±0.3) μg·L-1。暴露 72 h结束时,单独暴露组和共同暴露组中 ROX浓度比初始暴露浓度分别下降了76.1%和83.8%。暴露液中 ROX浓度的下降可能是由斜生栅藻细胞、PS-MPs以及容器器壁的吸附导致(Smets et al.,1990)。Ding et al.(2015)发现在 20 μg·L-1ROX 暴露下,斜生栅藻会在暴露开始后数小时内迅速吸附富集暴露液中的ROX,且在24-36 h左右达到富集平衡状态,最终暴露液中 ROX浓度仅为初始暴露浓度的44.7%。在本实验中,暴露6 h后,共同暴露组中ROX的浓度要低于ROX单独暴露组(图1),这表明PS-MPs吸附了暴露液中的ROX。MPs具有疏水性,并且能够通过静电作用在水中吸附多种抗生素(Li et al.,2018),有学者甚至发现MPs能够对磺胺类抗生素磺胺甲恶唑产生不可逆的吸附作用(Razanajatovo et al.,2018)。实际水环境中,污染物组成更加复杂,MPs很可能吸附许多不同种类的污染物,并不同程度上改变复合污染体系中污染物的环境行为及毒理效应,带来不可预知的环境风险。因此,有必要深入研究MPs与抗生素等有机污染物的联合生态效应。
2.2 PS-MPs与ROX对斜生栅藻的种群增长影响
如表2和图2所示,在暴露48 h后,各单独暴露组中斜生栅藻藻细胞密度、叶绿素 a含量以及Fv/Fm均已显著低于空白对照组(P<0.05);暴露72 h后,PS-MPs单独暴露组中斜生栅藻的各项生理指标相较于空白实验组分别下降了9.4%、9.2%、8.6%,这表明PS-MPs对斜生栅藻的生长具有抑制作用,同时对其光合作用效率产生了一定的负面影响。Besseling et al.(2014)将斜生栅藻连续72 h暴露于PS-MPs,同样观察到PS-MPs抑制了藻类种群生长并降低了藻类的叶绿素a含量,该学者认为纳米级PS-MPs会吸附在绿藻细胞膜表面,减少藻类对CO2的吸收,从而导致细胞内活性氧物质(ROS)的产生,造成了氧化损伤,最终抑制了藻类的生长。Mao et al.(2018)研究了 PS-MPs暴露下,小球藻(Chlorella pyrenoidosa)在整个生长期内的生理指标变化,结果显示 PS-MPs暴露浓度为 10、50和100 mg·L-1时,藻类生长最大抑制率分别为21.0%、29.0%和38.5%,其中100 mg·L-1PS-MPs暴露下,小球藻的Fv/Fm最大抑制率高达93.5%;该研究者指出附着在藻类上的PS-MPs颗粒可以增强光衰减并降低营养和气体交换的有效性,从而引起对藻类的生长、呼吸和光合作用的不利影响。在本实验中,ROX单独暴露72 h后,斜生栅藻的藻细胞密度、叶绿素a含量以及Fv/Fm分别下降了10.2%、7.6%和7.3%。Yang et al.(2008)通过72 h的暴露实验分析了 12种抗生素对月牙藻(Pseudokirchneriella subcapitata)生长的影响,发现超过半数的抗生素对月牙藻的生长产生抑制作用,该研究者认为抗生素会结合亚基50S核糖体,抑制肽的转运和干扰蛋白质的合成,从而抑制绿藻的生长。
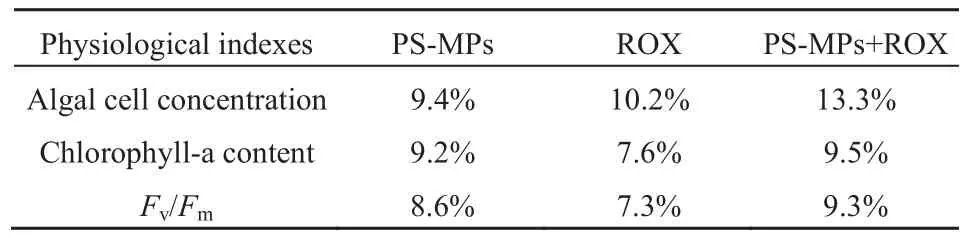
表2 暴露72 h后不同暴露组中斜生栅藻各项生理指标抑制率Table 2 Inhibition rates of different exposure groups on physiological indexes of S. obliquus after exposure for 72 h

图2 不同暴露处理72 h期间斜生栅藻(A)藻细胞密度,(B)叶绿素a含量及Fv/Fm(C)的变化Fig. 2 ( A) Algal cell concentration, (B) Chlorophyll-a concentration and(C) Fv/Fm variation of S. obliquus with different exposure treatments during 72 h exposure
MPs和 ROX联合暴露对斜生栅藻藻细胞密度、叶绿素a含量以及Fv/Fm的影响见图2和表2,随着暴露时长的增加,在暴露48 h之后,PS-MPs与 ROX共同暴露组中斜生栅藻的各项生理指标均显著低于空白对照组(P<0.05),PS-MPs与ROX共同暴露组中斜生栅藻的藻细胞密度相较于空白实验组下降了13.3%,叶绿素a含量下降了9.5%,Fv/Fm下降了 9.3%,但是与各单独暴露组无显著性差异(P>0.05),这意味着PS-MPs与ROX共同暴露对斜生栅藻生长的抑制效果并没有比二者的单独暴露更为明显。Zhu et al.(2019)研究了 4种不同类型的MPs和三氯生(TCS)对中肋骨条藻(Skeletonema costatum)的联合毒性,发现由于 TCS的吸附,使得 MPs的疏水性增加,导致MPs在水中沉淀,减少了MPs与微藻细胞之间的接触机会,从而降低了MPs和TCS的毒性。在本实验,共同暴露组中的PS-MPs对ROX的吸附可能导致二者接触斜生栅藻藻胞的机率降低,导致联合毒性效应并没有比单一毒性更加显著。Zhang et al.(2018)研究了氨基修饰的聚苯乙烯纳米粒子(nPS-NH2)和草甘膦对铜绿微囊藻(Microcystis aeruginosa)联合毒性的影响,发现nPS-NH2与草甘膦共暴露对藻类生长的抑制具有拮抗作用;该学者认为,草甘膦对铜绿微囊藻有很强的抑制作用,但由于 nPS-NH2对草甘膦具有很强的吸附能力,显著减轻了草甘膦对铜绿微囊藻的生长抑制作用。虽然本研究中PS-MPs和ROX的联合暴露对斜生栅藻的急性毒性影响并没有比单一暴露更为显著,但是自然水环境中,MPs与抗生素很可能是长期共存的,而它们对浮游植物产生的长期联合效应还未可知,因此有关MPs与抗生素的慢性毒性实验亟待展开。
2.3 PS-MPs与ROX对大型溞的毒理效应
如图 3所示,在本实验各暴露组中,大型溞的牧食率和滤水率均有明显的降低,其中,PS-MPs单独暴露组中大型溞的牧食率和滤水率相较于空白实验组分别下降了38.1%和39.4%,表明大型溞的觅食行为受到了PS-MPs的显著抑制。Cole et al.(2013)将15种浮游动物暴露于PS-MPs后,发现包括大型溞在内的 13种浮游动物均具有摄食暴露液中PS-MPs的能力,并且摄入的PS-MPs能够累积在浮游动物体内,导致摄食器官和消化道堵塞,造成能量缺乏,从而抑制其牧食率。在 ROX单独暴露组中,大型溞的牧食率和滤水率相较于空白实验组分别下降了58.9%和58.7%,表明ROX同样抑制了大型溞的觅食行为。Pan et al.(2017)在喹诺酮类抗生素诺氟沙星对大型溞的急性毒性实验中同样发现了觅食行为受到抑制的现象;该研究者认为随着抗生素浓度的增加,机体为了减少能量损失,适应环境胁迫,选择减少运动,进而导致了牧食率的降低。同样的,Yan et al.(2019)也发现磺胺类抗生素磺胺二甲嘧啶能够影响轮虫(Brachionus calyciflorus)的神经信号传递,抑制消化酶活性,最终导致摄食能力的下降。
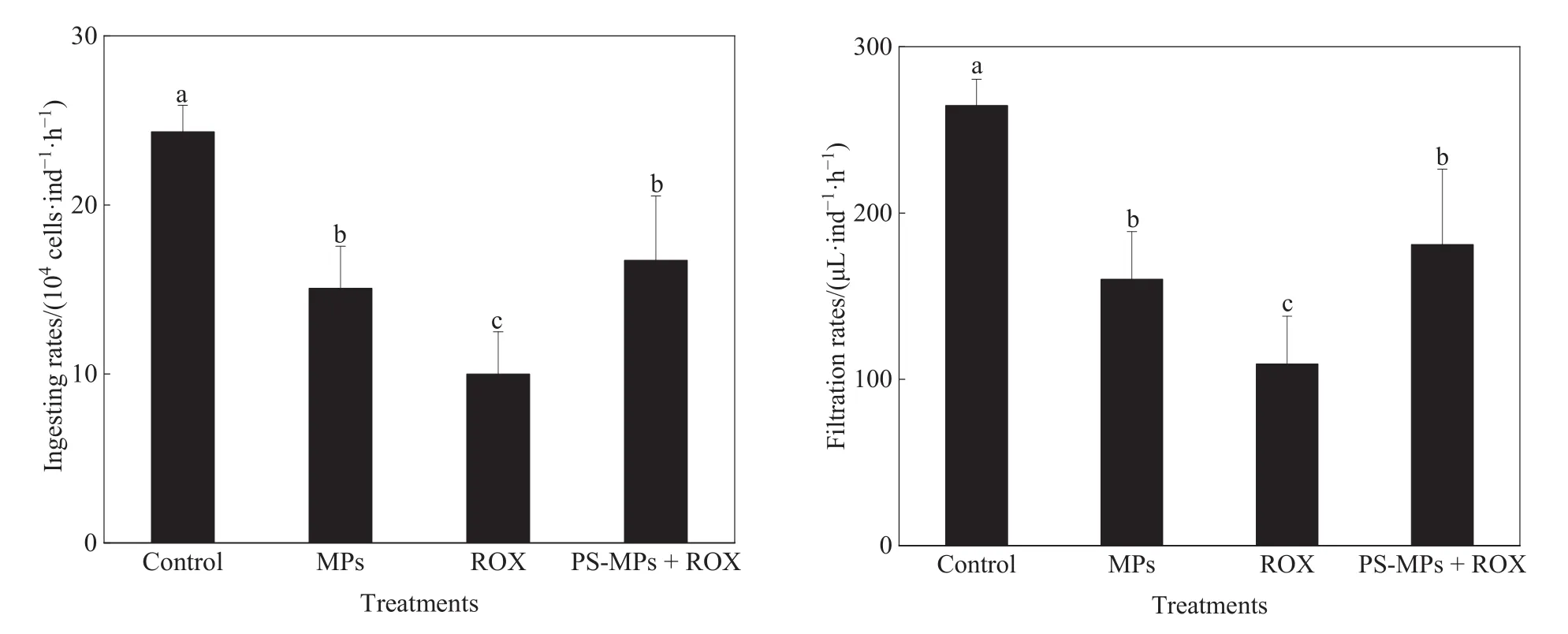
图3 不同暴露处理48 h后大型溞(A)牧食率和(B)滤水率变化Fig. 3 (A) Ingestion rates and (B) filtration rates variation of D. magna with different exposure treatments after 48 h exposure
在暴露48 h后,PS-MPs与ROX共同暴露组中大型溞的牧食率和滤水率相较于空白实验组分别下降了 31.3%和31.6%。在本实验中,共同暴露组中大型溞的牧食率和滤水率与 PS-MPs单独暴露组无显著差异(P>0.05),但远高于 ROX单独暴露组(P<0.05),说明 ROX对大型溞觅食行为的抑制效果要强于PS-MPs,但是在二者共存的情况下,PS-MPs能够降低ROX对大型溞觅食行为的影响。Zhang et al.(2019)研究了PS-MPs和ROX的交互效应对红罗非鱼(Oreochromis niloticus)的生理生化影响,观察到联合暴露下的红罗非鱼脑神经系统中乙酰胆碱酯酶(AChE)活性受抑制程度要明显小于ROX单独暴露,这表明PS-MPs存在的情况下,能够减轻ROX对红罗非鱼的觅食和运动等功能的抑制作用,该研究者认为吸附在PS-MPs表面上的ROX不能直接与AChE相互作用,从而减轻抑制作用。Fonte et al.(2016)近期研究了抗生素头孢氨苄和聚乙烯(Polyethylene,PE)MPs对虾虎鱼(Pomatoschistus microps)的联合效应,发现联合暴露和PE-MPs单独暴露96 h后对虾虎鱼捕食性能的影响没有显著差异,但是虾虎鱼在联合暴露后的捕食性能略高于抗生素单独暴露后的捕食性能,这表明 PE-MPs的存在降低了头孢氨苄的毒性;该作者认为 PE-MPs可能在生物体内发生改性,使得本要进入生物细胞内的头孢氨苄被 PE-MPs结合,导致头孢氨苄的毒性降低。虽然MPs和抗生素复合污染对水生生物觅食行为的影响机理目前还不完全清楚,但本实验研究显示在环境相关浓度的MPs和ROX暴露下,大型溞的摄食能力受到了显著抑制,这可能会导致机体缺乏营养供应,从而对大型溞的繁殖能力产生抑制作用。
2.4 PS-MPs与ROX对大型溞的生理生化影响
生物体受到某些外源污染物的胁迫时,会引起其体内 ROS的含量增多。当 ROS的含量水平超出生物体自身的清除能力时,氧化胁迫随即出现。作为抗氧化酶,SOD和CAT广泛存在于动物、植物和微生物中。SOD能够催化超氧化物阴离子发生歧化作用,生成过氧化氢和氧气,然后通过CAT作用将过氧化氢分解生成水(Piddington et al.,2001)。CAT通常与 SOD联合作用,建立起生物体对ROS胁迫的应激防御机制。在本实验中,各暴露组大型溞的SOD活性和CAT活性相较于空白实验组都有较明显的降低(图 4);PS-MPs单独暴露组和 ROX单独暴露组中大型溞的 SOD活性相较于空白实验组分别下降了 26.1%和13.7%,CAT活性分别下降了24.0%和56.0%,这表明MPs与ROX的存在使得大型溞受到污染胁迫,产生了大量 ROS,而大型溞体内的抗氧化酶SOD和CAT不足以抵抗污染物引起的氧化胁迫,从而导致氧化损伤。有学者认为,当污染胁迫超过一定限度后,将会抑制抗氧化酶的合成,这时,抗氧化酶的清除速率低于ROS产生速率,导致其体内积累过量的ROS而受到毒害(Basha et al.,2003),这可能是导致大型溞抗氧化酶活性降低的原因。

图4 不同暴露处理48 h后大型溞(A)SOD活性和(B)CAT活性的变化Fig. 4 (A) SOD activity and (B) CAT activity variation of D. magna with different exposure treatments after 48 h exposure
在暴露48 h后,PS-MPs与ROX共同暴露组中大型溞的SOD和CAT活性相较于空白实验组均受到显著抑制。在PS-MPs与ROX联合暴露下,SOD的活性抑制率为 20.8%,高于 ROX单独暴露的抑制率(13.7%),低于 PS-MPs单独暴露的抑制率(26.1%),这说明在 PS-MPs(250 μg·L-1)与 ROX(5 μg·L-1)的联合作用下,对大型溞SOD活性产生了简单相加作用;而CAT的活性在PS-MPs与ROX联合暴露下的抑制率为 60%,略大于 PS-MPs和ROX单体暴露的抑制率(抑制率分别为 24%和56%),因此我们认为在 PS-MPs(250 μg·L-1)与ROX(5 μg·L-1)共同存在的情况下,会对大型溞CAT活性产生轻微的协同作用。此外,在本实验中,共同暴露组中大型溞的SOD活性与PS-MPs单独暴露组和 ROX单独暴露组均没有显著性差异(P>0.05),这表明二者共同暴露并没有显著增加对大型溞的氧化胁迫。Zhang et al.(2019)等将大型溞暴露于的粒径为 1 μm 的 PS-MPs(100 μg·L-1)和 ROX(10 μg·L-1)后也发现联合暴露组与单一暴露组中大型溞的SOD活性没有显著性差异,并且观察到了PS-MPs单一暴露或者与ROX联合引起的谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)的显著降低,这表明二者单独或共存情况下均会对大型溞造成氧化损伤。Fonte et al.(2016)在研究头孢氨苄与PE-MPs对虾虎鱼的联合效应时,同样发现二者联合暴露与PE-MPs单独暴露对虾虎鱼的脂质过氧化损伤(Lipid Peroxidation,LPO)影响没有显著差异,该学者认为水中 PE-MPs会在一定程度上减轻头孢氨苄对虾虎鱼的毒性。此外,有研究者者发现PS-MPs与 ROX共存能够显著降低红罗非鱼肝脏中丙二醛(MDA)含量,该学者认为 PS-MPs可以通过吸附其他污染物减轻对生物体的氧化损害(Zhang et al.,2019)。现阶段有关MPs和抗生素联合毒性的研究大多集中于鱼类、贻贝等高营养级水生生物,而有关大型溞等浮游动物的毒性研究却鲜有报道,本研究结果显示在MPs和ROX共存情况下,对大型溞的抗氧化酶活性产生的明显的抑制作用,但是其中的机理还尚未明晰,亟待开展深入研究。
3 结论
本文研究了0.1 μm PS-MPs和ROX对浮游生物斜生栅藻和大型溞的单一与联合毒性。结果表明,MPs和ROX单一与联合暴露对斜生栅藻的生长以及光合作用均有明显的抑制作用,但是二者联合毒性并没有比单一毒性更加显著;MPs和 ROX单一与联合暴露对大型溞的牧食率和滤水率均有明显的抑制作用,在二者共存的情况下,PS-MPs能够降低ROX对大型溞觅食行为的影响;MPs与ROX对大型溞的SOD和CAT等抗氧化酶活性有着一定的抑制作用,在二者共存条件下,会对大型溞SOD活性产生相加作用,对CAT活性产生轻微的协同作用。本研究结果可为新兴污染物在水环境中联合毒性的深入了解提供科学依据,同时可为其在水环境中的生态风险评价和控制提供理论依据和技术支持。

