抗精噁唑禾草灵耿氏硬草乙酰辅酶A羧化酶基因研究
袁国徽,李 涛,钱振官,田志慧,刘伟堂,王金信
(1.上海市农业科学院生态环境保护研究所,上海 201403; 2.山东农业大学植物保护学院,山东泰安 271018)
耿氏硬草[Sclerochloakengiana(Ohwi)Tzvel.],又名耿氏碱茅,禾本科硬草属,是一年生或越年生疏丛型草本[1]。耿氏硬草具有较强的适应能力和繁殖能力,是我国稻麦轮作区小麦田主要恶性杂草之一,通过与作物竞争养分、水分和光照等资源,直接或间接影响作物的产量和品质[2]。据报道,耿氏硬草在部分麦田平均密度达100株·m-2,危害严重的田块可达400 株·m-2,严重影响小麦的高产和稳产[3]。
精噁唑禾草灵(fenoxaprop-P-ethyl),化学名称为(R)-2-[4-(6-氯-1,3-苯并噁唑-2-氧基)苯氧基]丙酸乙酯,是由德国Hoechst公司开发的芳氧苯氧丙酸类(aryloxyphenoxypropionate,APP)除草剂,其作用靶标为乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)。ACCase是植物体内脂肪酸合成的关键酶,它催化乙酰辅酶A生成丙二酰辅酶A[4]。精噁唑禾草灵通过在植物体内活化成酸的形式与ACCase羧基转移酶(carboxyltransferase,CT)区域结合,从而抑制丙二酰辅酶A的形成,使植物的脂肪酸合成受阻,最终导致植物死亡[5]。精噁唑禾草灵是选择性、内吸传导型苗后茎叶处理剂,具有高效、低毒、杀草谱广等优点,在我国小麦田被迅速推广,部分地区已有十几年的应用历史。随着精噁唑禾草灵使用年限的增长,其用量逐年增加,但对耿氏硬草的防除效果却越来越差,部分地区甚至出现防除失败。夏书娥等[6]报道,稻茬麦田菵草(Beckmanniasyzigachne)在连续8年使用精噁唑禾草灵后对其产生了抗药性。赵 宁等[7]研究发现,连续使用精噁唑禾草灵约10年的小麦田中看麦娘(Alopecurusaequalis)也产生了抗药性。目前,在全球70个国家有255种杂草(148种双子叶杂草,107种单子叶杂草)的496个生物型对23种不同作用机制的除草剂产生了抗药性,其中,抗ACCase抑制剂类除草剂的杂草有48种[8]。
已有研究表明,杂草对ACCase抑制剂类除草剂产生抗药性的机理主要包括:靶标酶基因突变和过量表达,对除草剂渗透和传导能力的减弱以及解毒代谢能力的提高。报道较多的是杂草ACCase基因突变导致酶结构改变,从而阻碍除草剂与靶标酶结合而产生抗药性[9]。截至目前,在ACCase的CT区域7个位点(1 781、1 999、 2 027、2 041、2 078、2 088、2 096)上总共有13种不同的氨基酸突变方式在不同的抗性杂草中报道[10]。Délye等[11]研究发现,大穗看麦娘(Alopecurusmyosuroides)ACCase的第1 781位异亮氨酸(Ile)被亮氨酸(Leu)取代而产生抗药性。Yuan等[12]报道,抗精噁唑禾草灵耿氏硬草ACCase的第1 999位色氨酸(Trp)突变为丝氨酸(Ser)。此外,ACCase第1999位色氨酸突变为半胱氨酸(Cys)也被证实是耿氏硬草对精噁唑禾草灵产生抗性的机理[13]。Yu等[14]报道,杂草对ACCase抑制剂类除草剂的交互抗性与靶标酶突变位点、突变种类以及杂草物种等因素相关。
本研究以采自山东省鱼台县的抗精噁唑禾草灵耿氏硬草种群为试验材料,采用整株水平测定法测定供试种群对不同ACCase抑制剂类除草剂的抗性,扩增和比对抗性和敏感种群ACCase基因CT区域序列,并测定耿氏硬草种群对其他常用除草剂的敏感性,为制定耿氏硬草的防除策略和延缓其抗性种群的发展提供科学依据。
1 材料与方法
1.1 材 料
供试草种:耿氏硬草抗性种群SD-23种子于2013年6月采自山东省鱼台县老砦乡四合村麦田,该麦田约有14年的精噁唑禾草灵用药历史;敏感种群SD-1种子采自山东省鱼台县王鲁镇东华村未使用过除草剂的非耕地。经前期单剂量测定试验发现,SD-1种群植株在精噁唑禾草灵田间推荐剂量下全部死亡,而抗性种群SD-23植株在2倍田间推荐剂量下生长未见被抑制。
供试除草剂:69 g·L-1精噁唑禾草灵水乳剂、30 g·L-1甲基二磺隆(mesosulfuron-methyl)可分散油悬浮剂,拜耳作物科学(中国)有限公司;15% 炔草酯(clodinafop-propargyl)可湿性粉剂、5% 唑啉草酯(pinoxaden)乳油,瑞士先正达作物保护有限公司;7.5% 啶磺草胺(pyroxsulam)水分散粒剂,美国陶氏益农公司;15% 精吡氟禾草灵(fluazifop-P-butyl)乳油,日本石原株式会社;12.5% 烯禾啶(sethoxydim)乳油,日本曹达株式会社;240 g·L-1烯草酮(clethodim)乳油,北京明德立达农业科技有限公司;70% 氟唑磺隆(flucarbazone-sodium)水分散粒剂,爱利思达生物化学品有限公司;50% 异丙隆(isoproturon)可湿性粉剂,江苏快达农化股份有限公司。
1.2 方 法
1.2.1 耿氏硬草对ACCase抑制剂类除草剂的抗性水平测定
供试材料培养参照Yuan等[15]的方法,将均匀一致的种子用1% 次氯酸钠溶液消毒20 min,然后用蒸馏水冲洗干净。经消毒处理后的种子放于含0.6% 琼脂培养基的培养皿中,置于人工气候箱内催芽(温度:白天15 ℃,晚上10 ℃;光照周期:12/12)。待种子萌发后播种于装有壤土的塑料盆中(直径12 cm),每盆15株,放于温室中培养(温度15~25 ℃,自然光照,相对湿度75%)。幼苗长至3~4叶期时,使用ASS-4型自动定量喷雾系统进行各除草剂处理,浓度(表1)根据预试验设定,茎叶喷雾(压力0.275 MPa,喷液量450 L·hm-2)。每处理设3个重复,试验重复2次。喷药21 d后剪取存活植株地上部分,在75 ℃干燥箱内烘干72 h,称干重。
1.2.2 抗性耿氏硬草ACCase基因分析
根据NCBI上报道的耿氏硬草ACCase基因序列(登录号KJ598848.1、KJ598849.1),采用Primer 5.0设计特异性引物YC-F(5′-GCTTCCACTTATCTACTTGGCT-3′)/YC-R(5′-AGGGATTCACCGTCAAATAG-3′),用于扩增ACCase CT区包含所有已知抗性突变位点的基因片段。
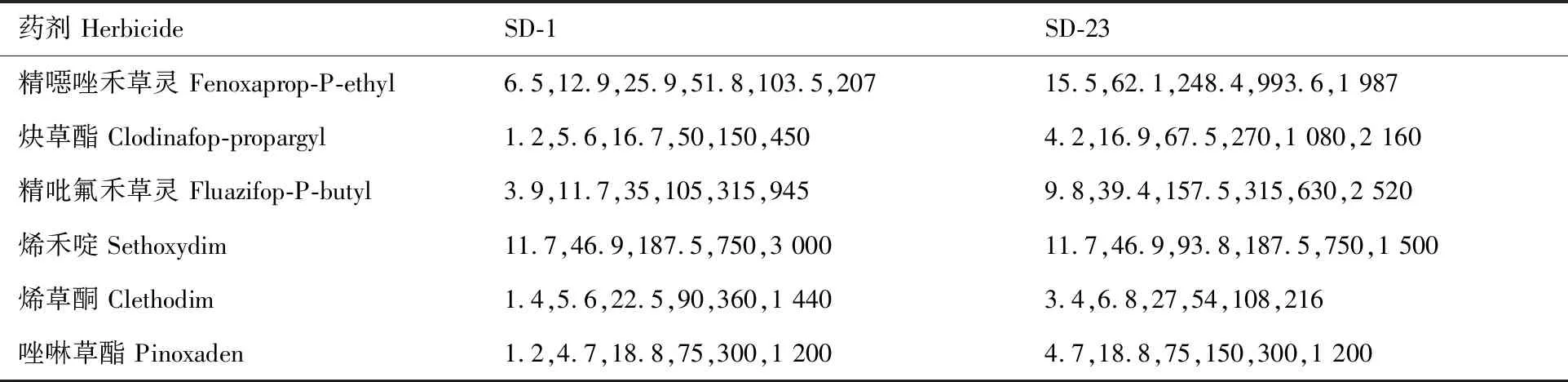
表1 抗性水平测定中除草剂及其处理剂量Table 1 Application amount of herbicide treatments in dose-response tests g(a.i)·hm-2
使用植物基因组DNA提取试剂盒对耿氏硬草抗性和敏感种群进行单株DNA提取,每个种群随机选取10株。经NanoDrop 2000微量分光光度计测定提取DNA的质量和浓度后,采用T100 PCR仪进行基因片段扩增。PCR反应体系为50 μL,包括:37 μL的ddH2O,1 μL的EasyTaq DNA Polymerase(5 U·μL-1),5 μL的10×EasyTaq Buffer,4 μL的dNTPs(2.5 mmol·L-1), 1 μL的引物YC-F(10 μmol·L-1),1 μL的引物YC-R(10 μmol·L-1),1 μL的基因组DNA。PCR 反应条件为:94 ℃预变性5 min;94 ℃变性50 s,56 ℃退火50 s,72 ℃延伸90 s,35个循环;72 ℃延伸 10 min。
PCR扩增产物用1%琼脂糖凝胶电泳检测,将含有目的条带的凝胶进行DNA回收。利用pEASY-T1载体连接回收的DNA片段,然后转到大肠杆菌感受态细胞Trans1-T1中[7],涂布于LB固体培养基(含Amp10 μg·mL-1)上,37 ℃培养过夜。挑取白色菌落于LB培养液中37 ℃振荡培养8~12 h,然后进行菌液PCR鉴定,将阳性克隆送公司测序。通过DNAMANversion 5.2.2 软件对测序结果进行比对分析。
1.2.3 耿氏硬草对其他除草剂的敏感性测定
采用单剂量测定耿氏硬草对ALS抑制剂类除草剂甲基二磺隆、氟唑磺隆、啶磺草胺和PSⅡ抑制剂类除草剂异丙隆的敏感性。各除草剂处理剂量(有效成分)分别为:氟唑磺隆31.5 g·hm-2,啶磺草胺13.5 g·hm-2,甲基二磺隆13.5 g·hm-2,异丙隆1 197 g·hm-2。耿氏硬草培养及喷药处理方式同1.2.1,施药后21 d记录每处理存活杂草株数,并剪取存活植株地上部烘干后称重,计算株防效和干重防效。株防效=(对照组杂草株数-处理组杂草株数)/ 对照组杂草株数×100%;干重防效=(对照组杂草干重-处理组杂草干重)/对照组杂草干重×100%。
1.3 数据处理
采用GraphPadPrism version5.01软件的非线性回归进行统计分析,计算各药剂对耿氏硬草抗性与敏感种群的GR50值。拟合方程:y=c+ {(d-c)/[1+(x/GR50)b]},其中y表示处理组杂草干重相对于对照的百分比,c表示剂量反应下限,d表示剂量反应上限,b表示方程斜率,x表示除草剂处理剂量,GR50表示抑制杂草50%干重的除草剂剂量。通过计算抗性种群GR50与敏感种群GR50的比值得出抗性倍数。利用IBM SPSS Statistics version 20软件对试验所得数据进行one-way ANOVA分析。
2 结果与分析
2.1 耿氏硬草抗性种群对ACCase抑制剂类除草剂的抗性
采用整株水平测定法测定了耿氏硬草SD-23种群对6种ACCase抑制剂类除草剂的抗性水平。结果(表2)显示,SD-23种群对精噁唑禾草灵产生了高水平的抗性,对炔草酯和精吡氟禾草灵产生了低水平的抗性,其抗性倍数依次为12.7、5.2和4.5;对烯禾啶、烯草酮和唑啉草酯未产生抗性,其抗性倍数均小于2。
2.2 耿氏硬草抗性种群ACCase基因分析
对耿氏硬草ACCase基因片段进行克隆与测序后,得到了一段长度为1 359 bp的序列。在NCBI网站进行BLAST分析,确认该碱基序列为耿氏硬草的质体型ACCase基因序列。将耿氏硬草抗性种群SD-23与敏感种群SD-1以及大穗看麦娘的ACCase基因序列进行比较,结果表明,抗性SD-23种群所检测的10株耿氏硬草均发生了相同的突变,即ACCase基因CT区域第6 287位(参照大穗看麦娘质体型ACCase序列)碱基G突变为C,导致第2 096位氨基酸由甘氨酸(Gly)突变为丙氨酸(Ala);敏感种群中所有植株均未发现已报道的抗性突变位点(表3)。
2.3 耿氏硬草抗性种群对其他4种除草剂的敏感性
从表4得知,在各药剂的田间推荐剂量下,抗性种群SD-23与敏感种群SD-1对甲基二磺隆、啶磺草胺、氟唑磺隆和异丙隆的株防效及干重防效之间的P值均大于0.05,所以耿氏硬草种群SD-23与SD-1之间对上述4种除草剂抗性均无显著性差异。从各除草剂对耿氏硬草种群的株防效和干重防效来看,氟唑磺隆的防除效果最差,其株防效为20.0%~22.2%,干重防效为36.6%~37.8%;而甲基二磺隆、啶磺草胺和异丙隆对耿氏硬草种群均有较好防效,其株防效为86.7%~100%,干重防效为77.4%~84.7%。因此,甲基二磺隆、啶磺草胺和异丙隆可用于抗ACCase抑制剂类除草剂耿氏硬草的防除。
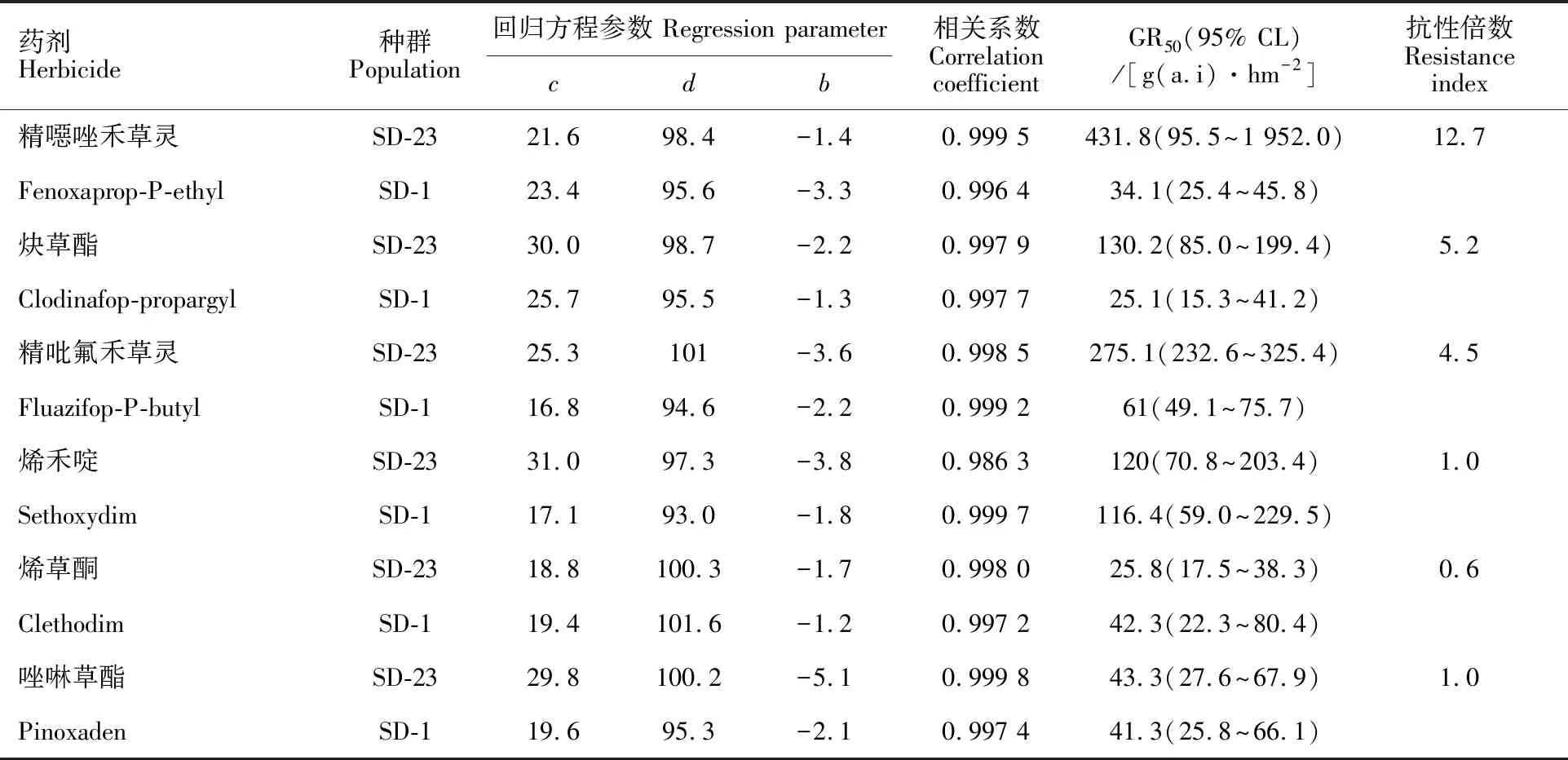
表2 耿氏硬草抗性种群对ACCase抑制剂类除草剂的交互抗性Table 2 Resistance spectrum to ACCase-inbibiting herbicides of the resistant S.kengiana population
c:剂量反应下限;d:剂量反应上限;b:斜率;GR50:抑制杂草50% 干重的除草剂剂量;95% CL:95%置信区间。
c:The minimum dosage;d:The maximum dosage;b:The relative slope; GR50:Herbicide dosage causing 50% plant growth reduction; 95%CL:95% confidence limit.
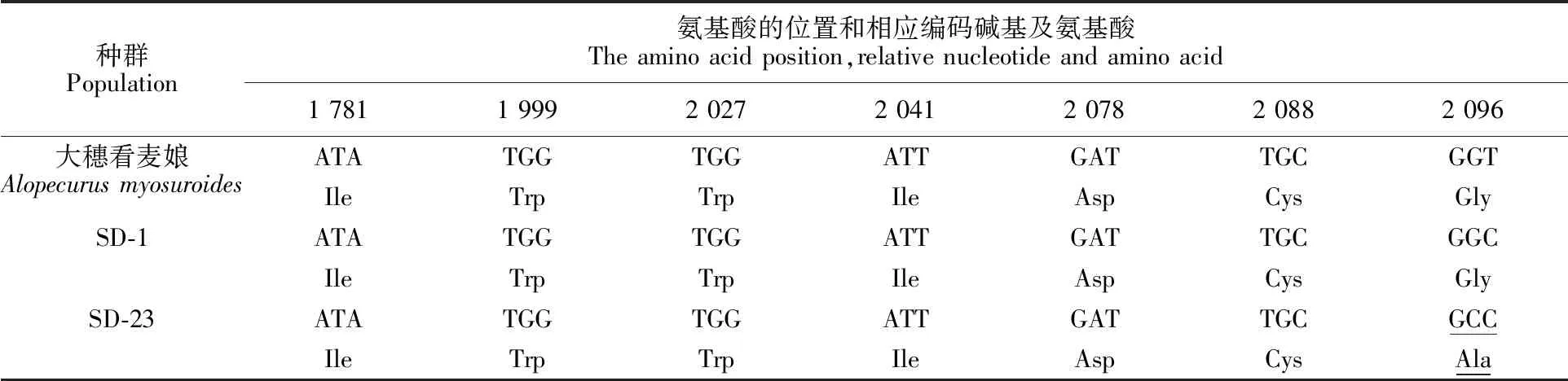
表3 耿氏硬草抗性与敏感种群ACCase CT区域基因序列分析Table 3 Sequence alignment and deducedamino acid of the resistant and susceptible S.kengiana populations
氨基酸序列位置参照大穗看麦娘质体型ACCase(AJ310767);突变氨基酸及相应的密码子在表中用下划线标出。
The amino acid residue sequence according to the plastidic ACCase sequence ofAlopecurusmyosuroides(AJ310767); the mutated amino acid residues and corresponding codon were underlined.

表4 耿氏硬草抗性种群对其他4种除草剂的敏感性Table 4 Sensitivity of the resistant S.kengiana population to other four herbicides
P>0.05表示抗性种群与敏感种群间无显著性差异。
Pvalue less than 0.05 means there is no significant difference between the resistant and susceptible populations at 0.05 level.
3 讨 论
目前,ACCase抑制剂类除草剂主要有三种类型,分别为芳氧苯氧丙酸类(APP),环己烯酮类(cyclohexanedione,CHD)和苯基吡唑啉类(phenylpyazoline,PPZ)。本研究中精噁唑禾草灵、炔草酯和精吡氟禾草灵属于APP类除草剂;烯草酮和烯禾啶属于CHD类除草剂;而唑啉草酯属于PPZ类除草剂,是较新的一类ACCase抑制剂类除草剂。由于ACCase抑制剂类除草剂的作用位点单一,长期重复使用该类除草剂极易导致杂草抗药性的产生。Tang等[16]报道,棒头草(Polypogonfugax)在连续使用炔草酯和高效氟吡甲禾灵约5年后产生了抗药性。本研究中,耿氏硬草种群SD-23对精噁唑禾草灵产生了高水平的抗性,这可能与其多年的精噁唑禾草灵用药历史有关。Neve等[17]研究发现,杂草群落内本来就存在少数具有抗药性基因的杂草,除草剂的持续选择压力使敏感性杂草数量不断减少,而抗药性杂草数量不断增加并发展成为优势杂草。
研究表明,ACCase的CT区域氨基酸发生突变是导致杂草对ACCase抑制剂类除草剂产生抗性的重要原因之一[10]。本研究通过对耿氏硬草抗性和敏感种群ACCase基因部分片段进行扩增、测序和比对,结果显示,抗性种群SD-23的ACCase第2 096位氨基酸由甘氨酸突变为丙氨酸(Gly-2 096-Ala),这可能是SD-23种群对精噁唑禾草灵产生抗性的重要原因之一,该突变方式是第一次在耿氏硬草中被发现。Gly-2 096-Ala突变是于2005年在抗性大穗看麦娘中被首次报道[18],随后Scarabel等[19]在抗性黑麦草属(Loliumspp.)中也检测到该突变方式。认为GIy-2096-Ala突变会导致杂草对APP类除草剂产生抗药性,而对CHD类和PPZ类除草剂敏感。本研究通过整株水平法测定发现,SD-23种群对炔草酯和精吡氟禾草灵产生了抗性,而对烯禾啶、烯草酮和唑啉草酯敏感,此结果与前人的研究相一致[16]。本研究还发现,甲基二磺隆、啶磺草胺和异丙隆等除草剂对耿氏硬草抗性和敏感种群均有较好防效,因此这些除草剂可以作为防治抗ACCase抑制剂类除草剂耿氏硬草的重要选择。长期施用某单一作用靶标类型的除草剂,极易导致杂草抗药性的产生[20-21]。Beckie等[22]报道,不同作用机制的除草剂混用或轮用可以有效地延缓和治理产生交互抗性的杂草。
本研究初步明确了耿氏硬草抗性种群的靶标抗性分子机制及其对不同除草剂的敏感性,对生产实践中合理选择药剂防除抗性耿氏硬草及延缓杂草抗药性的发生具有重要指导意义。本试验没有对靶标酶表达量和解毒代谢酶活性等方面进行研究,因此不能排除其对抗性产生的贡献,这有待后续试验进行证实。

