香茅醇不同旋光异构体对抑制茶炭疽病病菌活性的比较及其协同作用
向晓龙,杨文,刘惠芳,陈瑶,周玉锋,胡安龙*
香茅醇不同旋光异构体对抑制茶炭疽病病菌活性的比较及其协同作用
向晓龙1,杨文2*,刘惠芳2,陈瑶2,周玉锋2,胡安龙1*
1. 贵州大学农学院,贵州 贵阳 550025;2. 贵州省农业科学院茶叶研究所,贵州 贵阳 550006
采用菌丝生长速率法、Horsfall方法和共毒系数法测定了香茅醇不同构型对茶炭疽病病菌()的毒力以及两构型不同比例混配的协同效应。结果表明,右旋香茅醇和左旋香茅醇对茶树炭疽病菌的EC50分别为(113.27±0.95) mg·L-1和(119.87±0.20) mg·L-1。按照质量比1.6︰1将右旋香茅醇和左旋香茅醇混配,协同增效作用最高,共毒系数为130.19;质量比为1︰1.4和1︰3.8时,共毒系数分别为120.57和121.42,也具有协同增效作用。结果表明,香茅醇及两旋光异构体对抑制茶炭疽病菌具有良好的活性,将两者按一定比例混用后具有增效作用。
植物源农药;香茅醇;茶炭疽病
茶炭疽病是我国茶园中常见的主要病害之一,在高温高湿天气发病较重,在茶叶上可形成大型斑块,并造成茶树大量落叶,该病可使投产茶园秋茶减产15%~30%,严重的达到40%~50%,造成茶树产量与茶叶品质都下降[1]。茶树上登记防治茶炭疽病的杀菌剂有吡唑醚菌酯、啶氧菌酯、多抗霉素和代森锌等[2-4],施用化学农药是目前防治茶炭疽病的主要手段。目前世界各茶叶进口国加强了茶叶农药最大残留的限制,使得防治茶树病害的化学农药不宜使用。随着我国化学农药减施增效战略实施和茶叶产业的国际化、现代化、标准化的推进,茶园减施,甚至不施化学农药也将成为必然趋势。为了有效减少化学农药的使用,利用植物体内的次生代谢物质对茶树病害进行防控是有效的防治途径之一,其中利用芦柑皮、艾蒿等提取物及山苍子等植物精油来抑制茶炭疽病成为研究热点[5-7]。
香茅醇(Citronellol)来源于天然植物,是由两种异戊二烯单元(C6H8)组合产生的单萜烯类化合物,具有很好的环境兼容性。香茅醇在芳香类植物的植物精油中普遍存在,例如天竺葵和其他芳香类植物[8]。香茅醇对许多植物病原菌均具有抑制作用,表明其在植物源农药开发上具有潜力。香茅醇化学名称:3,7-二甲基-6-辛烯-1-醇,由于它具有不对称性,存在-和-两个旋光异构体[9](图1)。
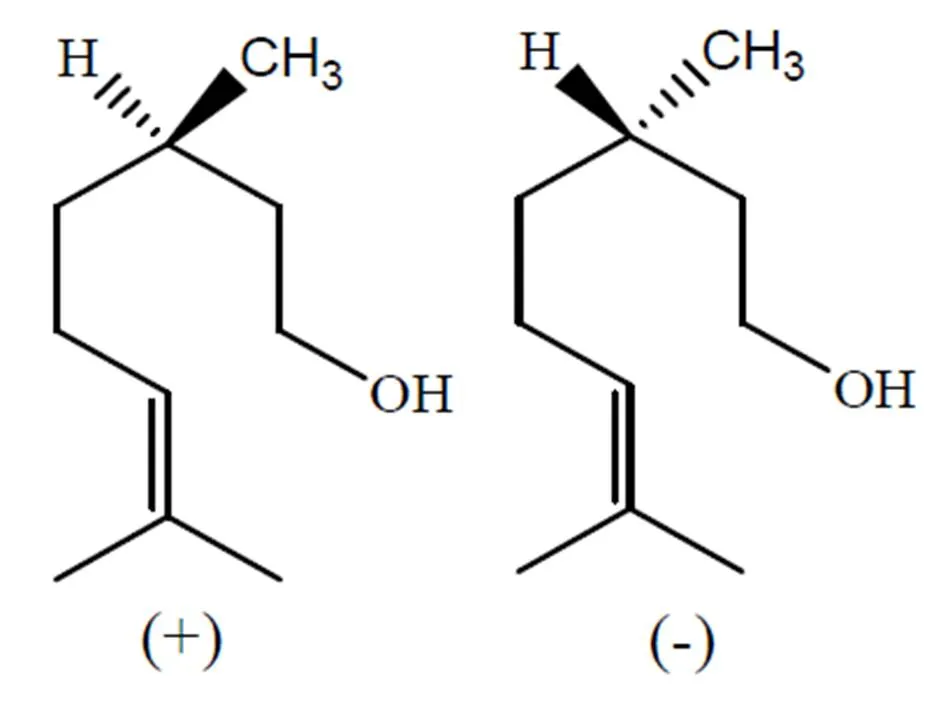
图1 香茅醇旋光异构体
Fig.1Citronella rotatory isomer
香茅醇在植物病原菌活性的研究方面,Hsouna等[10]测定了天竺葵精油中主要的化学成分和抗菌活性,抗菌的主要化学成分是香茅醇和香叶醇等;吴建挺等[11]测定了天竺葵精油对6种植物病原真菌的抑菌活性,采用GC-MS分析后,明确了主要成分为香茅醇;蒋小龙等[12]报道了香茅精油、香茅醛和香茅醇对6种储粮霉菌的抑菌作用,其中香茅醇的抑菌效果明显高于香茅精油和香茅醛的;赵丽静[13]报道了香茅醇对黄瓜菌核病菌和番茄灰霉病菌等9种病原菌有一定的抑菌作用;Pereira等[14]研究香茅醇对14株红色毛癣菌的最低抑制浓度(MIC)值在8~1 024 mg·L-1,对多株菌种的MIC值为128 mg·L-1;李晓晴等[15]报道了-香茅醇抗念珠菌活性的体外研究,-香茅醇对61株念珠菌的MIC范围为81.39~1 342.39 μg·mL-1。林霜霜等[16]报道了柠檬天竺葵精油主成分为-香茅醇约占32.21%,在800 mg·L-1时对番茄早疫病的抑制率达63.24%。
多数农药旋光异构体存在活性差异,其中一半可能是没有活性的,且农药的生产既污染环境又增加生产投入成本。香茅醇不同旋光异构体对抑制植物病原菌的活性比较及其协同效应的研究鲜有报道。本文比较了右旋香茅醇和左旋香茅醇对茶炭疽病菌的毒力差异及其混用的协同效应,为茶园新型植物源杀菌剂的研发提供了理论依据。有望在今后茶树病害生物防控中发挥重要作用,并对促进茶园减施化学农药具有重要意义。
1 材料与方法
1.1 主要仪器及药剂
99%右旋香茅醇购于上海阿拉丁试剂有限公司;97%左旋香茅醇[(-)--香茅醇]购于上海萨恩化学技术有限公司;无水乙醇(天津市富宇精细化工有限公司),10%多抗霉素可湿性粉剂购于山西奇星农药有限公司,吐温-80(天津市大茂化学试剂厂)。超净工作台(苏净集团安泰公司);电热鼓风干燥箱(上海一恒科技有限公司);电子天平(型号:BSA224S-CW);恒温培养箱(上海跃进医疗器械厂);高温蒸汽灭菌锅(上海沉汇仪器有限公司)。
供试菌株:茶炭疽病菌(),由贵州省茶叶研究所提供。
1.2 试验方法
1.2.1 香茅醇及其异构体对茶炭疽病的室内毒力
采用生长速率法[17]。在药剂初筛的基础上选出5个有效浓度梯度,配置成相应的PDA毒体培养基,用5 mm打孔器在活化好的茶炭疽病培养皿沿菌丝边缘打孔,将菌饼放入到培养皿中央,带菌丝面与PDA培养基面相接触,以含0.1%吐温-80和5%无水乙醇无菌水溶液作对照,每个处理4次重复。茶炭疽病菌株由贵州省茶叶研究所提供(已纯化);将密封保存在试管内的菌株用接种针挑取少量菌丝转移到PDA培养基中,置于25℃恒温培养箱内培养120 h,活化菌株,即可开展下一步试验。置于25℃恒温培养箱内培养120 h,采用十字交叉法测得菌丝体生长直径,计算对炭疽病病菌生长的抑制率,求出毒力回归方程及抑制中浓度(EC50)。生长抑制率公式:
生长抑制率=(∆D1-∆D2)/∆D1×100%
∆D1为对照菌落直径与菌饼直径的差值,∆D2为处理菌落直径与菌饼直径的差值。
1.2.2 香茅醇异构体不同组分增效配比筛选
根据Horsfall方法[18]设计混配比例。以右旋香茅醇和左旋香茅醇两种单剂的有效中浓度EC50为基础,配制两种单剂化合物的有效中浓度药液,按体积比(9︰1)、(8︰2)、(7︰3)、(6︰4)、(5︰5)、(4︰6)、(3︰7)、(2︰8)、(1︰9)进行混合,分别测定每组混合处理120 h后对茶炭疽病菌菌丝生长抑制率。根据体积比测度的抑制率选出较好的体积比,先配制单剂浓度梯度,再按相对应的浓度梯度顺序将两单剂按具有增效作用组合的体积比混配,得到增效配比混剂的浓度梯度。计算出各单剂和混剂处理后120 h的毒力回归方程及抑制中浓度(EC50)。
1.2.3 数据统计方法
根据Sun等[19]的方法求出共毒系数及增效倍数,共毒系数大于120表示具增效作用,小于80表示拮抗作用,介于80~120之间表示相加作用。以剂量对数值()为自变量,抑制率()为因变量,采用DPS 7.05软件计算毒力回归方程、抑制中浓度(EC50)、相关系数。共毒系数的计算方法参照李建明等[20]的方法:
2 结果与分析
2.1 香茅醇和香茅醇异构体的室内毒力
采用菌丝生长速率法,测试了香茅醇及其不同异构体(右旋、左旋香茅醇)和10%多抗霉素(对照药剂)对茶炭疽病菌的室内毒力(表1)。结果表明,经过处理后的120 h,右旋香茅醇和左旋香茅醇对茶炭疽病菌的菌丝生长抑制中浓度EC50分别为(113.27±0.95) mg·L-1和(119.87±0.20) mg·L-1,均低于香茅醇[(144.12±0.42) mg·L-1],而高于对照药剂10%多抗霉素可湿性粉剂[(105.06±0.32) mg·L-1]。
2.2 香茅醇异构体组合对茶炭疽病菌菌丝抑制作用
根据单剂毒力测定结果,对右旋香茅醇和左旋香茅醇进行混配增效配比的定性筛选。结果表明(表2),处理后120 h,右旋香茅醇和左旋香茅醇的EC50体积配比为(6︰4)、(5︰5)、(4︰6)、(3︰7)和(2︰8)时,对菌丝生长的校正毒力比均大于1,表现为增效作用;配比为1︰9时,校正毒力比明显小于1,表现出拮抗作用;其他配比的校正毒力比为1左右,表现出相加作用。
根据表2结果,采用共毒系数法,对右旋香茅醇和左旋香茅醇进行混配增效配比的定量筛选。由表3可见,处理后120 h,右旋香茅醇和左旋香茅醇的五组质量比中,配比为(1∶1.4)、(1︰3.8)、(1.6︰1)时,EC50值分别为(98.05±9.02) mg·L-1、(95.72±9.40) mg·L-1和(89.54±8.21) mg·L-1,共毒系数分别为120.57、121.42和130.19,均大于120,表现为增效作用,分别增效20.57%、21.42%和30.19%;另外两个配比的共毒系数均介于111~120之间,表现为相加作用。通过两异构体不同质量配比后能有效提升对茶炭疽病的毒力,EC50值除配比为1∶1配比外均低于对照药剂(10%多抗霉素可湿性粉剂)。
3 讨论
香茅醇及其异构体(右旋香茅醇和左旋香茅醇)对茶炭疽病()有着较好的抑菌效果,EC50值均在150 mg·L-1以下,与Nidiry等[21]的研究结果基本一致。香茅醇属于单萜类化合物,Knobloch等[22]报道精油成分在水中的溶解度直接关系到它们穿透细菌或真菌细胞壁的能力,决定抑菌活性的大小,根据这个理论,在今后实际加工使用中,可将其加工成水性化剂型,如微乳剂、水乳剂等,以提高亲水性和抑菌活性。
表1右旋香茅醇和左旋香茅醇处理后120 h对茶炭疽病菌的毒力
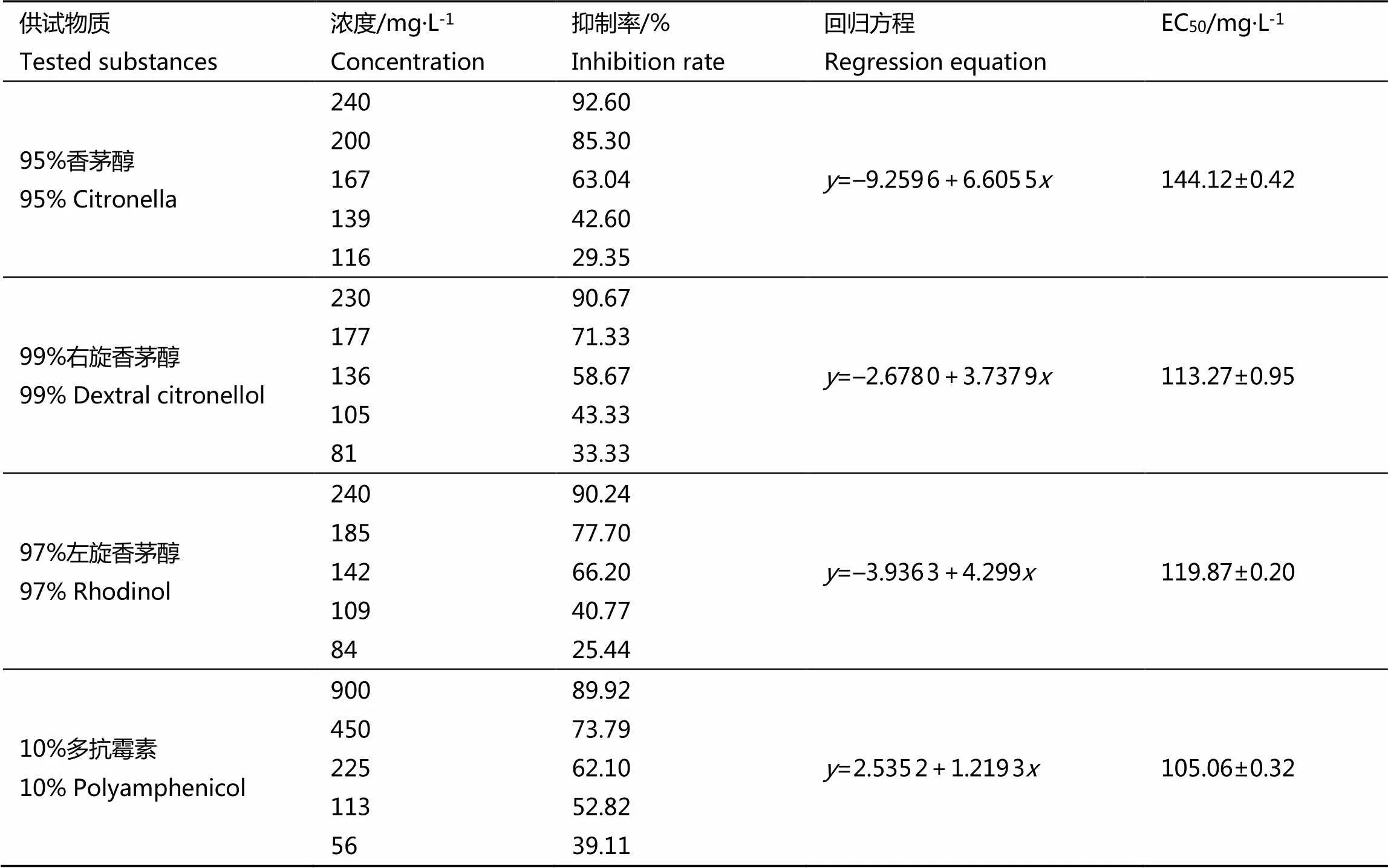
Table 1 Toxicity of dextran citronellol and rhodinol against C. gloeosporioides after 120 h
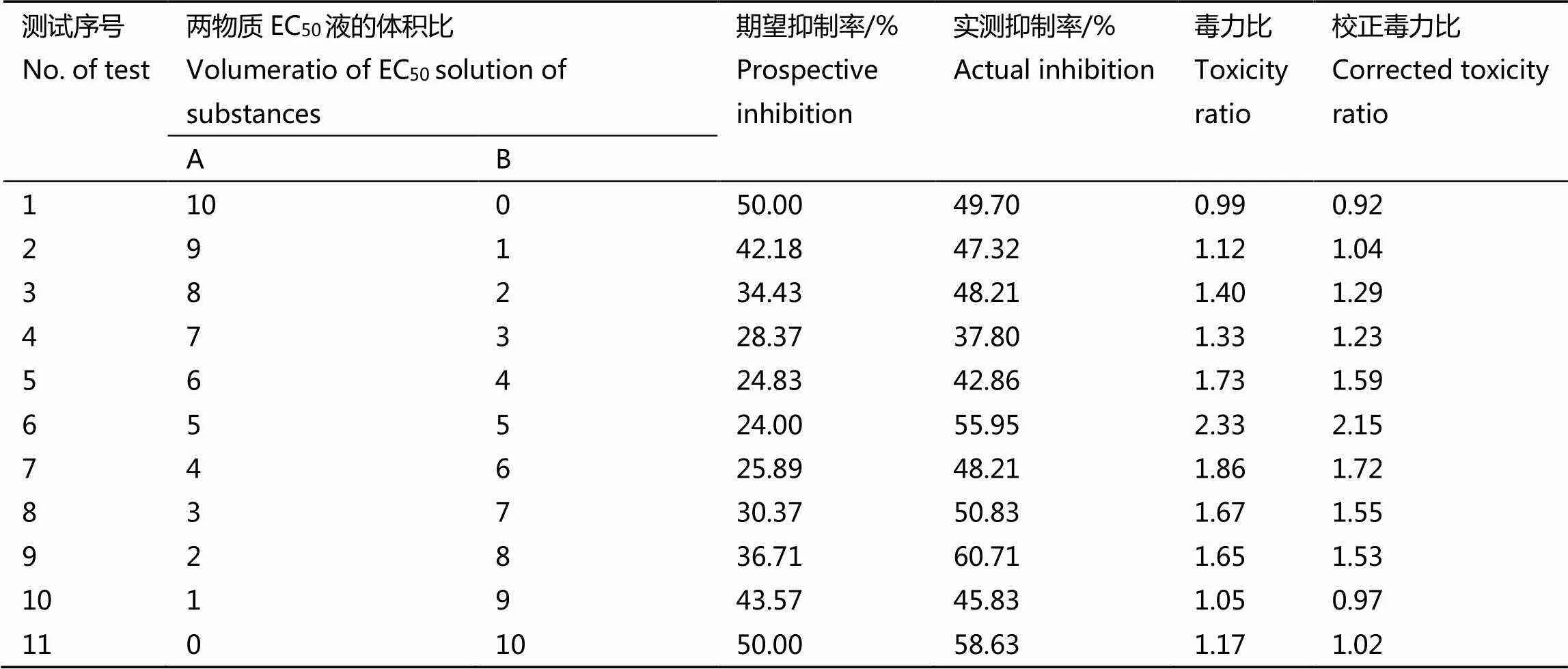
表2 右旋香茅醇和左旋香茅醇EC50液混剂处理后120 h对茶炭疽病菌的毒力
注:A为右旋香茅醇,B为左旋香茅醇
Note: A: Dextral Citronellol, B: Rhodinol
注:A:右旋香茅醇;B:左旋香茅醇;P:10%多抗霉素可湿性粉剂。**,<0.01
Note: A: Dextral Citronellol. B: Rhodinol. P: 10% Polyamphenicol WP. **,<0.01
茶炭疽记录和报道的病原菌有和[23]。本试验选用进行室内毒力测定,结果表明香茅醇、右旋和左旋香茅醇对茶炭疽病菌()的EC50分别为(144.12±0.42) mg·L-1、(113.27±0.95) mg·L-1和(119.87±0.20) mg·L-1,香茅醛还具有抑虫作用[12],因此有望开发出兼具抑菌杀虫作用的茶园新型植物源农药。
目前已知的商品化的农药中有近170余种属于手性农药,包括生物农药、天然产物制剂和化学合成农药,除了单一纯手性异构体的商品外,还有一些手性农药是含高活性手性体的消旋体商品[24]。不同的旋光异构体对药物生物活性有着很大的影响。李琳等[25]比较了松油烯-4-醇光学异构体对家蝇的熏蒸活性差异,结果表明松油烯-4-醇的光学异构体对家蝇的杀虫活性存在差异,外消旋体的活性明显高于异构体单体。本试验结果右旋和左旋香茅醇两次测定的EC50值分别为(113.27±0.95) mg·L-1、(119.87±0.20) mg·L-1和(118.87±11.57) mg·L-1、(115.54±11.78) mg·L-1,无明显差异,表明香茅醇旋光异构体之间无活性差异,其作用机理和作用方式的还有待进一步研究。
利用植物源农药和微生物农药或化学农药复配能增强对病原菌的抑菌活性,达到增效作用[26],但鲜见利用不同异构体混配的抑菌活性研究。通过Horsfall方法[18]和共毒系数法研究表明,右旋香茅醇和左旋香茅醇的EC50质量配比为(1︰1.4)、(1.6︰1)和(1︰3.8)时,共毒系数分别为120.57、130.19和121.42,均表现出增效作用。在本试验中香茅醇两个异构体都具有较高的生物活性,在增效配比下活性更高。基于此,可按本研究明确的增效配比,将香茅醇研制成植物源农药。针对目前茶园减施化学农药战略,下一步将进行复配药剂加工和田间使用技术研究。科学合理地利用天然植物源农药进行茶园病虫害防治,对我国茶叶的绿色健康发展具有重要意义。
[1] 蔡煌. 福鼎县茶树炭疽病危害严重[J]. 福建茶叶, 1992(4): 30-31.
[2] 唐美君, 郭华伟, 姚惠明, 等. 吡唑醚菌酯乳油对茶树炭疽病的防治效果[J]. 中国茶叶, 2016(2): 17-18.
[3] 唐美君, 郭华伟, 姚惠明,等. 啶氧菌酯对茶树炭疽病的田间防效[J]. 浙江农业科学, 2017, 58(8): 1418-1419.
[4] 林德锋, 吴顺章, 黄大龙, 等. 漳州铁观音茶树炭疽病发生规律及化学防治试验[J]. 浙江农业科学, 2012, 1(8): 1169-1171.
[5] 张亮, 袁争, 朱蔚, 等. 4种植物提取物对茶炭疽病菌的体外抑制作用[J]. 植物保护, 2012, 38(4): 137-140.
[6] 陈瑶, 高秀兵, 姚雍静, 等. 山苍籽油与茶皂素对茶炭疽病菌的毒力[J]. 贵州农业科学, 2014(11): 140-143.
[7] 张亮. 4种植物提取物对茶炭疽病菌及对茶树防御酶的影响[D]. 合肥: 安徽农业大学, 2012.
[8] Freire M M, Jham G N, Dhingra O D, et al. Composition, antifungal activity and main fungitoxic components of the essential oil of mentha piperita l [J]. Journal of Food Safety, 2012, 32(1): 29-36.
[9] 冉学光, 江焕峰, 朱新海, 等. 香茅醇的合成研究进展[J]. 林产化学与工业, 2003, 23(3): 97-101.
[10] Hsouna A B, Hamdi N. Phytochemical composition and antimicrobial activities of the essential oils and organic extracts from pelargonium graveolens growing in Tunisia [J]. Lipids in Health & Disease, 2012, 11(1): 1-7.
[11] 吴建挺, 张博, 张悦丽, 等. 天竺葵精油抑菌活性及其主要抑菌成分[J]. 北京农业, 2013(3): 4-5.
[12] 蒋小龙, 寸东义, 杨晶焰. 香茅精油、香茅醛、香茅醇对储粮霉菌和害虫抑制与熏杀效果的试验研究[J]. 河南工业大学学报(自然科学版), 1994(1): 39-47.
[13] 赵丽静. 苯并噻唑等三种微生物源挥发性有机化合物的农药活性初步研究[D]. 泰安: 山东农业大学, 2011.
[14] Pereira F D, Mendes J M, Lima I O, et al. Antifungal activity of geraniol and citronellol, two monoterpenes alcohols, against trichophyton rubrum involves inhibition of ergosterol biosynthesis [J]. Pharmaceutical Biology, 2015, 53(2): 228-34.
[15] 李晓晴, 惠海英, 骆志成. 香叶醇、-香茅醇和丁香酚抗念珠菌活性的体外研究[J]. 现代检验医学杂志, 2016, 31(2): 87-89.
[16] 林霜霜, 邱珊莲, 郑开斌, 等. 5种精油的化学成分及对番茄早疫病的抑菌活性研究[J]. 中国农学通报, 2017, 33(31): 132-138.
[17] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 140-141.
[18] Horsfall J G. Fungicides and their action [J]. Quarterly Review of Biology, 1945(2): 239. DOI: 10.1126/science.103.2664.87.
[19] Sun Y P, Johnson E R. Analysis of joint action of insecticides against house flies [J]. Journal of Economic Entomology, 1960, 53(5): 887-892.
[20] 李建明, 欧晓明, 裴晖, 等. Excel在杀菌剂复配研究中的应用[J]. 世界农药, 2013, 35(4): 34-36.
[21] Nidiry, Eugene S J. Quantitative structure-fungitoxicity relationships of some monohydric alcohols [J]. Journal of Agricultural and Food Chemistry, 2003, 51(18): 5337-5343.
[22] Knobloch K, Pauli A, Iberl B, et al. Antibacterial and antifungal properties of essential oil components [J]. Journal of Essential Oil Research, 1989, 1(3): 119-128.
[23] 刘威, 陈玉森, 刘伟, 等. 茶树炭疽病的病原鉴定及其生物学特性的研究[J]. 宁德师范学院学报(自然科学版), 2013, 25(1): 1-5.
[24] 李超. 顺硝烯新烟碱杀虫剂的同位素标记合成、手性分离鉴定及土壤中的归趋研究[D]. 上海: 华东理工大学, 2013.
[25] 李琳, 熊鑫, 马树杰, 等. 松油烯-4-醇光学异构体及外消旋体对家蝇的杀虫活性比较[J]. 昆虫学报, 2015, 58(7): 761-766.
[26] 李昕. 油茶炭疽病生物农药与化学农药协同防治研究[D]. 长沙: 中南林业科技大学, 2015.
Fungicidal Activity Comparison and Synergetic Effectof Citronellol Optical Isomers Against
XIANG Xiaolong1, YANG Wen2*, LIU Huifang2, CHEN Yao2, ZHOU Yufeng2, HU Anlong1*
1. Agricultural college of Guizhou University, Guiyang 550025, China;2. Guizhou Tea Research Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550006, China
In this study, the activities of dextral citronellol, rhodinol and their synergistic effect to thewas determined by method of mycelial growth rate, Horsfall and co-toxicity coefficient. The EC50of dextral citronellol and rhodinol were (113.27±0.95) mg·L-1and (119.87±0.20) mg·L-1respectively. The dextral citronellol and rhodinol were mixed according to the mass ratio. The result shows that the synergistic effect was the highest with the co-toxicity coefficient of 130.19 under the mass ratio of 1.6︰1 (dextral citronellol︰rhodinol). The co-toxicity coefficients were 120.57 and 121.42 when the mass ratio were 1︰1.4 and 1︰3.8, respectively. The results indicate that citronellol and its two optical isomers had high inhibiting activities against, and the synergistic effect could be performed by mixing them within certain proportion.
botanical fungicide, citronellol,
S435.711;S482
A
1000-369X(2019)04-425-06
2019-01-02
2019-02-11
国家重点研发计划项目子项目[2016YFD0200900]、贵州省科技计划项目[黔科合平台人才(2017)5717]、贵州省农业科技支撑项目(黔科合支撑[2016]550号)、黔农科院青年基金[2017]14号、黔科合支撑[2018]2251
向晓龙,男,硕士研究生,主要从事农产品质量安全和茶树病虫害研究方面的研究。*通信作者:alhu@gzu.edu.cn

