7例乳腺基底细胞型导管内原位癌临床病理分析
袁军,任鹏,傅亚军,夏光发
(嘉兴市妇幼保健院,浙江 嘉兴 314051)
乳腺导管内原位癌 (ductal carcinoma in situ,DCIS),是指肿瘤性上皮细胞明显增生,细胞有轻至重度异型性,且局限于乳腺导管内,尚未超出基底膜。其中,基底细胞型DCIS是一种罕见的DCIS变异型[1]。目前对于该类病例的研究有限,国内文献罕见报道。本文收集7例乳腺基底细胞型DCIS并复习相关文献,对其临床病理特征及最新研究进展加以讨论,以加深对该病的认识。
1 资料与方法
1.1 一般资料 收集本院2014年1月-2017年
12月手术切除的乳腺基底细胞型DCIS 7例,均为女性,年龄 30-67 岁,平均(49.0±4.4)岁;左侧 3 例,右侧4例。7例以疼痛和触及肿块发现为主,乳房表面皮肤均无异常,患侧腋下均未触及质硬肿大淋巴结。该7例中6例采取单侧乳腺癌单纯切除术+前哨淋巴结活检术,1例选择保乳+腋下前哨淋巴结活检。前哨淋巴结活检均阴性。术后结合化疗,随访1年,全组无死亡病例,尚未见复发。具体情况详见表1。
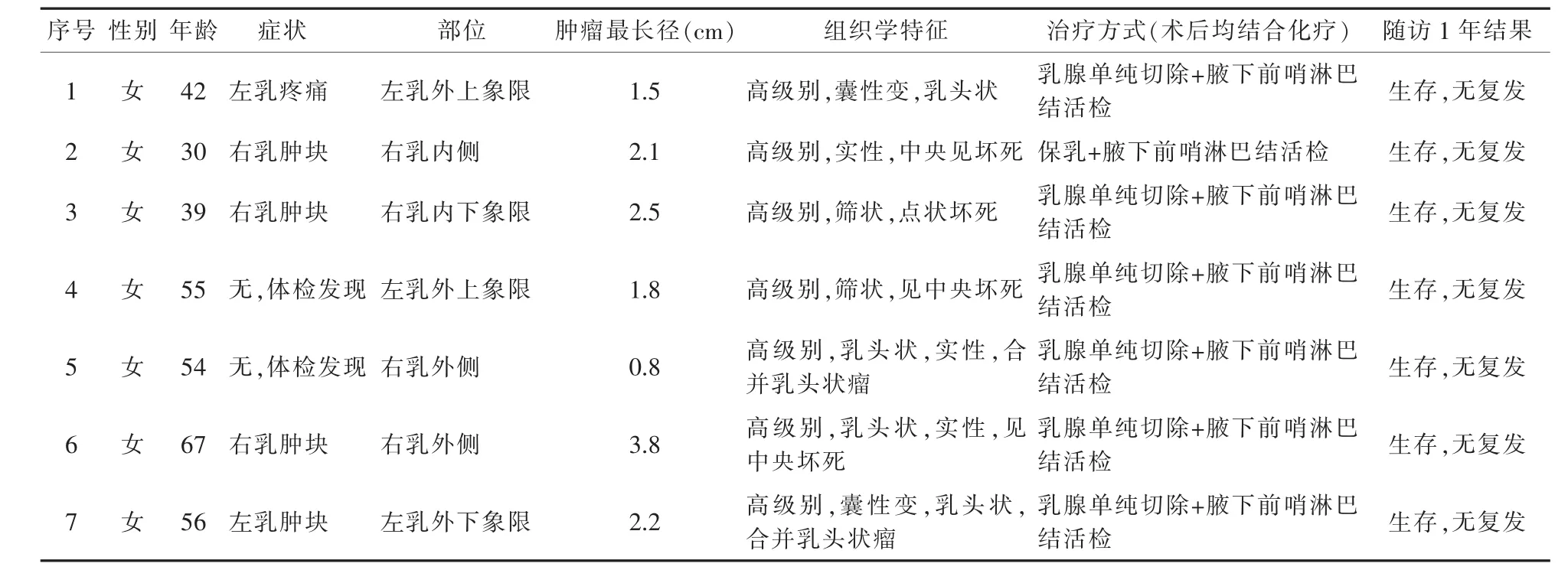
表1 7例乳腺基底细胞型导管内原位癌患者临床病理资料
1.2 方法 所有标本均采用4%中性甲醛溶液固定,常规石蜡包埋、切片、HE染色。免疫组化采用EnVision 二步法。所用抗体 ER、PR、HER-2、CK5/6、CK14、CK17、P63、EGFR、CD117、Ki-67 均来自福建迈新生物技术开发有限公司,所有一抗均为即用型单克隆抗体。操作按说明书进行,每种抗体均设阳性及阴性对照,已知阳性切片作阳性对照,PBS缓冲液代替一抗作阴性对照。ER、PR、P63、Ki-67胞核 阳 性 为 有 效 阳 性 细 胞 ,CK5/6、CK14、CK17、EGFR、CD117胞质和(或)胞膜阳性视为有效阳性细胞,阳性细胞数≥10%视为阳性。HER-2胞膜阳性(+++)视为阳性。
2 结果
2.1 大体表现 肿块实性,切面灰白、灰红色,质地偏硬,局部呈粉刺样,最长径约0.8~3.8cm。其中2例切面囊性变及出血,内含灰褐色内容物,内壁较光滑。
2.2 镜下表现 肿瘤均呈结节状生长,边界不清,切面灰白、灰红到红褐色不等,局部粉刺样改变,瘤细胞排列成实性、筛状、乳头状,多见点状坏死及中央坏死;筛孔呈圆形,腔缘平滑,细胞杂乱无极性。瘤细胞增大,瘤细胞核呈圆形或卵圆形,中等大小,呈多形性,核/质比增高(图1)。泡状核,核膜厚,不规则,染色质粗块状,具有明显小核仁及较多核分裂像。瘤细胞巢边界相对平滑、清楚,其周围存在疏松的小叶内间质和毛细血管,间质可见多少不等的炎细胞浸润。2例合并导管内乳头状瘤。
2.3 免疫组化 7例ER、PR、HER-2均阴性;CK 5/6阳性7例;CK14及CK17、P63阳性各6例(图2);EGFR 阳性 5 例;CD117 阳性 4 例;Ki-67(+30%~60%)。 详见表2。

表2 7例乳腺基底细胞型导管内原位癌免疫组化结果情况

图1 基底细胞型DCIS肿瘤细胞异型性大,核浆比高,核染色质粗糙,核仁明显,核分裂多(HE×40)。
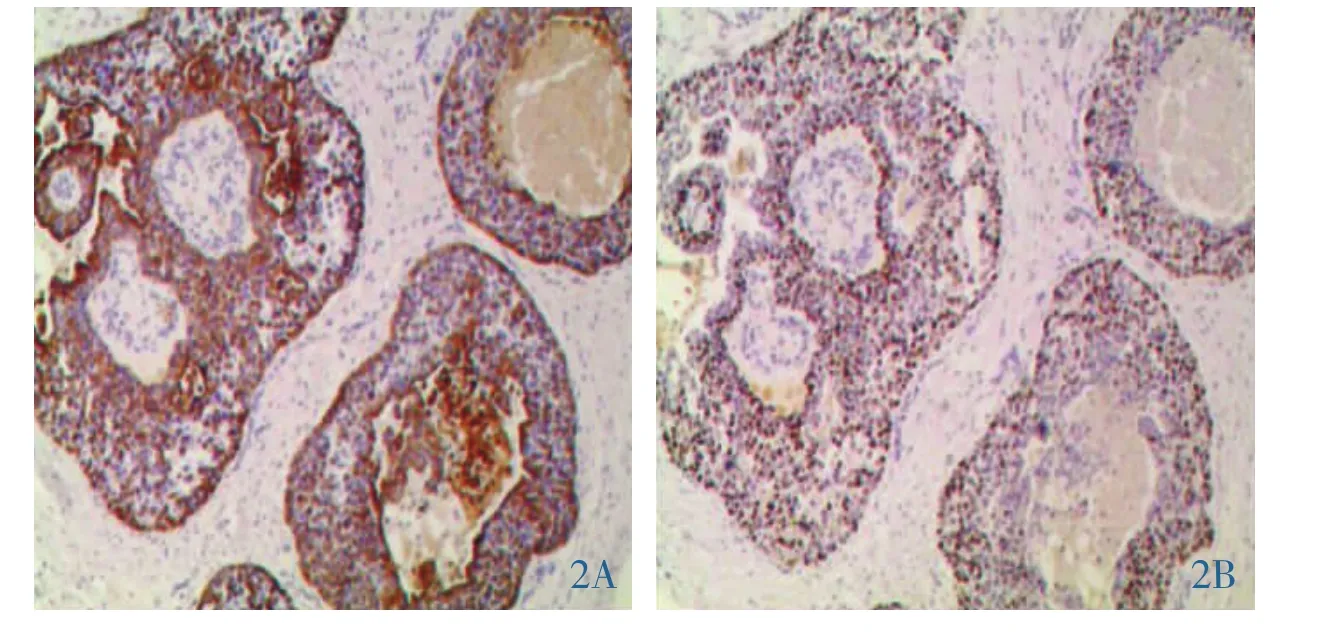
图 2 免疫标志物弥漫阳性(EnVision×40)。 2A:CK5/6(+);2B:P36(+)。
3 讨论
Bryan等[2]采用免疫组化法检测66例高级别DCIS中蛋白表达,其中4例(6%)ER、PR和HER-2阴性,且该4例均表达CK5/6,这一研究首次提出了具有基底细胞型免疫表型的DCIS可能是基底细胞样型乳腺癌(BLBC)的前驱病变。在随后的Livasy等[3]对245例DCIS研究中,证实基底细胞型DCIS是BLBC的前驱病变,可作为一种独立的DCIS亚型。
基底细胞型DCIS肿瘤细胞表现为较高的增殖指数、较大的异型性、较高的核浆比,核染色质粗糙、核仁明显、核分裂多(25-60/10HPF)(图 1)。 这些细胞的形态特征与BLBC具有很大的相似之处;此外,在免疫标记角度上,它具有同BLBC一致的CK5/6、P63等标志物阳性特征(图2);在分子角度上,基底细胞型DCIS的分子生物学改变与BLBC相同,如p53突变、c-kit突变和BRCA1突变等。由此可见,作为一种新的原位癌类型,需要及时识别,在日常诊断工作中,不可仅因为CK5/6、P63等标志物阳性,直接确诊导管内普通型增生、非典型增生,导致该类型的原位癌漏诊。
本组7例乳腺基底细胞型导管内原位癌临床表现、病变部位、肉眼观察及影像学检查与其它类型DCIS无异。组织学特征均为高级别DCIS,包括实性片状、乳头状、筛状、粉刺样生长方式;瘤细胞异型性大,圆形或卵圆形,具有多形性,核浆比高;核特征包括核膜厚,不规则,染色质粗块状,空泡状核,具有明显的核仁和核分裂,这与陈文静等[4]的研究结果相符。
该7例不表达ER、PR和HER-2,基底标记物CK5/6、CK14、CK17及P63阳性率较高,而7例均表达CK5/6,作者认为CK5/6是区分基底细胞型DClS最佳辅助性标志物[5]。此外,发现EGFR、CD117也分别有5例和4例表达,表明EGFR参与了乳腺癌的发生发展[6],可以作为重要的乳腺癌生物学行为及预后的评估指标。CD117的阳性表达提示该类患者可能伴有c-kit突变[7]。
本病需要与以下疾病进行鉴别诊断:(1)导管内普通型增生。基底细胞型DCIS与普通型导管上皮增生均表达CK5/6、P63,此时基底标记物染色结果的解释必须以组织学为基础,基底细胞型DCIS以高级别DCIS常见,具有显著的高级别核特征,并具备坏死、核分裂等特征。普通型导管上皮增生往往形成乳头状和不规则的大小裂隙,混杂有腺上皮、肌上皮等,细胞轮廓不清,罕见/无核分裂。(2)普通类型DCIS。基底细胞型DCIS有时与一些普通类型的DCIS在组织学上难以鉴别,但其具有特殊的免疫标记即CK5/6、P63阳性,而普通的DCIS腺腔内均不表达CK5/6及P63,仅在导管周围肌上皮表达上述免疫标志物。(3)导管内乳头状肿瘤。导管内乳头状瘤伴有细胞非典型性,非典型细胞呈筛状或乳头状,多见低级别的核。而基底细胞型DCIS的核几乎均为高级别,并具备坏死、核分裂等。在非典型乳头状肿瘤中散在表达CK5/6及P63,而上述标记物在基底细胞型DCIS中则为弥漫阳性表达。(4)多形性小叶原位癌累及导管。基底细胞型DCIS与小叶原位癌累及导管均可显示细胞多形性,通过免疫组化E-cadherin、P120可对两者进行鉴别。小叶性原位癌多 E-cadherin(-)而 P120 胞质(+),基底细胞型 DCIS 则 E-cadherin(+)、P120 胞膜(+)。
由于 BLBC 的 ER(-)、PR(-),故患者对内分泌治疗不敏感;其起源于乳腺导管上皮外层基底细胞,易发生远处转移,没有对应的靶向治疗法[8]。基底细胞型DCIS分子生物学改变与BLBC相同,但其尚处于BLBC的前期病变,因此有效的治疗可阻断疾病的发展。近年来国内外研究发现大多数病例表达EGFR,并伴有BRCA1突变[9]及表达CD117[10]。因此,EGFR、BRCA1和c-kit可作为新的治疗靶点,应用于具有基底细胞型DCIS的患者。由此可见,DCIS的不同分子分型同样有着不同的生物学特性,明确诊断基底细胞型DCIS这一特殊类型对其可能有重要的临床意义。
由于BLBC进展快,发展过程中处于DCIS的时期较短。研究发现,在导管内病变阶段有效地阻断疾病的发展具有非常好的预后意义,至于术后局部复发和发展为浸润癌的风险还有待于长期随访观察。

