乌头碱抑制食管癌EC-1细胞增殖与侵袭并诱导其凋亡作用研究
周小剑,李玉华,唐湘,吕钰冰,周嘉彬
乌头碱抑制食管癌EC-1细胞增殖与侵袭并诱导其凋亡作用研究
周小剑,李玉华,唐湘,吕钰冰,周嘉彬
511436 广州市番禺区新造医院检验科(周小剑、李玉华、唐湘);511400 广州市番禺区中心医院检验科(吕钰冰、周嘉彬)
研究乌头碱对食管癌 EC-1 细胞增殖、侵袭和凋亡的影响。
CCK8 法及克隆形成抑制实验检测乌头碱对食管癌 EC-1 细胞的生长抑制作用;采用 Hoechst 33258 染色检测乌头碱对 EC-1 细胞凋亡的影响;Transwell实验观察乌头碱对细胞侵袭能力的作用;Western blot 检测药物作用后细胞侵袭及凋亡相关蛋白的表达情况。
CCK8 实验结果显示,乌头碱可明显抑制食管癌 EC-1 细胞增殖,并呈时间和剂量效应(< 0.01),48 h 对 EC-1 细胞半数抑制浓度(IC50)为 6.171 μg/ml。与正常对照组相比,6.25、12.5 μg/ml 的乌头碱能明显降低 EC-1 细胞克隆形成能力,抑制细胞侵袭以及诱导细胞凋亡,并且显著下调 MMP-9 及 Bcl-2 蛋白的表达。
乌头碱具有明显的抗肿瘤作用,其机制可能与其抑制肿瘤细胞增殖、侵袭及促凋亡相关。
乌头碱; 食管肿瘤; 细胞增殖; 肿瘤侵润; 细胞凋亡
食管癌(esophageal cancer)是常见的消化道恶性肿瘤,五年内生存率在 10% 以下,手术切除后五年生存率也仅为 15% ~ 40%,严重威胁人类的生命健康[1]。由于缺乏特异的临床表现,超过 80%的食管癌患者确诊时已为中晚期,失去了手术治疗的机会,放化疗成为其主要治疗方法[2]。然而,放化疗常造成机体损伤,不良反应多,严重影响治疗效果和患者的生活质量[3]。随着对传统中药研究的不断深入,中药治疗肿瘤逐渐成为了热点。研究发现,中药治疗在提高患者免疫力、增强化疗敏感性、减轻不良反应以及延长生存期等方面发挥着重要作用[4-5]。
乌头碱(aconitine)(图 1)是存在于川乌、草乌、附子等植物中的主要有毒成分,也是发挥药效的主要有效成分,性味辛、温,临床主要用于镇痛、镇静、消炎等,尤适用于消化系统癌痛,产生局部麻醉和镇痛作用[6]。近年研究显示,乌头碱具有明显的抗肿瘤作用,可抑制癌细胞增殖及促进凋亡[7-8],但目前尚未发现乌头碱与食管癌的相关报道。本研究旨在探索乌头碱对食管癌EC-1 细胞的增殖、侵袭及凋亡等影响,为乌头碱的抗癌机制研究提供思路。
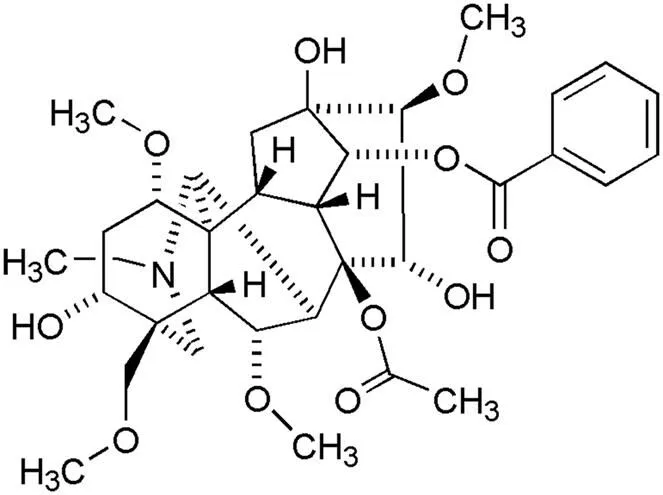
图 1 乌头碱的结构
Figure 1 Structure of aconitine
1 材料与方法
1.1 主要材料
1.1.1 细胞株 人食管癌 EC-1 细胞由中山大学附属肿瘤医院肿瘤防治中心惠赠,用含 10%的胎牛血清、1% 链霉素(100 μg/ml)和青霉素(100 U/ml)的 DMEM 培养基培养于 37 ℃、5% CO2培养箱内。取对数生长期的细胞用于实验。
1.1.2 试剂 乌头碱购自中国食品药品检定研究院,批号 112019-201601;DMEM 培养基、0.25% 胰酶、胎牛血清购自美国 Gibco 公司;CCK8试剂盒购自日本同仁公司;Transwell 小室及基质胶均购自广州蓝吉生物科技有限公司。
1.1.3 主要仪器 CO2培养箱和 Bio-Tek 酶标仪 ELX-800 购自美国Biotech 公司;1300B2 生物安全柜购自美国 Thermo 公司;DMI4000 倒置荧光显微镜购自德国 Leica 公司;750D 照相机购自日本 Canon 公司。
1.2 方法
1.2.1 CCK8 检测细胞增殖 取对数生长期的人食管癌 EC-1 细胞,0.25% 胰酶消化后制成细胞悬液,调整细胞密度至 5 × 104/ml,细胞悬液移至96 孔板,每孔 200 μl,预培养 24 h 待细胞贴壁良好。实验设空白对照组(只含培养基,不含细胞)、阴性对照组(不加入药物)及药物处理组(乌头碱浓度分别为 0.8、1.6、3.2、6.25、12.5、25.0 μg/ml),每组 6 个复孔,分别培养 24、48、72 h。吸弃旧培养液,每孔加入新鲜培养基 100 μl 和CCK8 反应液10 μl,孵育 4 h,酶标仪测定各组在450 nm 处吸光度值()。抑制率 =[(阴性对照组–药物处理组)/(阴性对照组–空白对照组)]× 100%,计算抑制率及半数抑制率(IC50)。
1.2.2 克隆形成实验 6 孔培养板接种 1200 个处于对数生长期的人食管癌EC-1 细胞。37 ℃、5% CO2孵育 24 h 后,加入适当浓度的乌头碱与培养基混合液,待药物作用 EC-1 细胞 7 d 后。弃去上清液,1 × PBS 溶液浸洗 2 次,加入 4% 多聚甲醛固定 15 min,弃固定液,加入结晶紫染液染色 15 min,洗去染液,空气中干燥,照相。随后加入 10% 冰醋酸溶液 2 ml,静置 30 min,待结晶紫溶解后,取 100 μl 加入 96 孔板中,酶标仪读取各孔 560 nm 波长处值并计算克隆抑制率。克隆抑制率(%)=(对照组–加药组)/对照组× 100%。
1.2.3 Transwell 小室检测细胞侵袭能力 Transwell 小室上室用 100 μl Matrigel 胶包被,在紫外线下照射 2 h。EC-1 细胞分别进行适当浓度的乌头碱处理 48 h 后,0.25% 胰酶消化成细胞悬液,上室进行铺胶,加入 200 μl 含约 5 × 104个细胞的无血清DMEM 培养液,下室加入含 10% 胎牛血清的 DMEM,24 h 后弃去上室培养基,拭去上室内的 Matrigel 胶和细胞,加入 4% 多聚甲醛固定 10 min,1 × PBS 漂洗 2 次,加入 0.1% 结晶紫染色 10 min,晾干,倒置显微镜观察,随机选取 3 个视野于高倍镜下计数。
1.2.4 Hoechst 33258 法检测细胞凋亡 取 1 × 106个细胞接种于 6 孔板,制备细胞爬片,24 h 后用适当浓度的乌头碱分别作用于食管鳞癌 EC-1 细胞 48 h,进行 Hoechst 染色。激发波长 350 nm左右,发射波长 460 nm 左右,于倒置荧光显微镜高倍镜下观察。在不同视野下计数 200 个细胞,计算细胞凋亡率。
1.2.5 Western blot 检测 MMP-9、Bcl-2 蛋白的表达 将 EC-1 细胞(1 × 106个/孔)置于 6 孔板中,待 24 h 细胞贴壁后加入适当浓度乌头碱孵育 48 h,收集细胞 PBS 洗涤 2 次,加入细胞裂解液冰上放置 30 min,1200 r/min、4 ℃离心2 min,取上清,BCA 法蛋白定量。调整蛋白浓度40 μg/孔进行 SDS-聚丙烯酰胺凝胶电泳后,转移至醋酸纤维膜上,5% 脱脂牛奶封闭后分别加入MMP-9(1:1000)、Bcl-2(1:1000)、β-actin(1:5000)一抗,4 ℃孵育过夜,TBST 漂洗 3 次后加入相应 HRP 标记二抗(1:3000),37 ℃孵育 1 h,TBST 漂洗 3 次后 ECL 显色剂显色并于凝胶成像系统扫描成像。
1.3 统计学处理
2 结果
2.1 CCK8 法检测细胞增殖能力
不同浓度乌头碱分别干预 EC-1 细胞 24、48 和 72 h 后,CCK8 实验检测细胞增殖抑制能力。如图 2 所示,EC-1 细胞增殖抑制率随着乌头碱浓度及作用时间的增加而增加,呈现明显的剂量、时间-效应关系,其 IC50分别为10.68、6.171 和4.104 μg/ml。根据各组抑制率结果,乌头碱作用 48、72 h 抑制率相差作用明显,为保证一定的细胞存活数量以及蛋白质提取量,故选取作用时间为 48 h,作用浓度为 6.25、12.5 μg/ml 的乌头碱进行后续实验。

细胞抑制率(%)Cell inhibition rate (%)1009080706050403020100 0.8 1.6 3.2 6.25 12.5 25.0 乌头碱浓度(μg/ml)Concentration of aconitine (μg/ml)
Figure 2 The proliferation inhibition rate of EC-1 cells was detected by CCK8
2.2 细胞克隆形成能力检测
从图 3A 可见,0、6.25、12.5 μg/ml浓度乌头碱作用于 EC-1 细胞 7 d后,各组的克隆形成数随药物浓度增加而减少,药物浓度越高,克隆能力降低越明显。溶解结晶紫后于酶标仪读取各孔 560 nm吸光度(图3B),各组间吸光度差异有统计学意义(= 127.59,= 0.00)。代入公式计算得 6.25 和12.5 μg/ml 的乌头碱对 EC-1 细胞的克隆抑制率分别为(32.17 ± 1.05)% 和(44.35 ± 0.97)%。
2.3 Transwell 实验检测细胞侵袭能力
0、6.25、12.5 μg/ml 的乌头碱处理 48 h 后,在显微镜(× 200)下每孔随机选择 3 个视野计数细胞数,三组细胞的平均穿膜细胞数分别为每视野271.5 ± 12.7、165.6 ± 8.2 和 122.4 ± 5.8,各组间差异有统计学意义(= 204.34,= 0.00),提示乌头碱能抑制 EC-1 细胞的侵袭能力(图 4A)。
2.4 细胞凋亡检测
Hoechst 33258 染色法观察 0、6.25、12.5 μg/ml 浓度的乌头碱处理 EC-1 细胞 48 h 后细胞形态学的改变。倒置荧光显微镜下可见凋亡细胞胞核呈致密浓染,或呈碎块状致密浓染,颜色发白(图 4B)。镜下计数凋亡细胞数,对照组的凋亡指数为(4.54 ± 0.57)%,6.25、12.5 μg/ml 的乌头碱作用 EC-1 细胞后凋亡指数分别为(29.43 ± 1.57)% 和(64.33 ± 3.89)%,差异有统计学意义(= 428.56,= 0.00)。
2.5 Western blot 检测 MMP-9、Bcl-2 蛋白表达
不同浓度乌头碱作用 EC-1 细胞 48 h 后,Western blot 检测得侵袭相关蛋白 MMP-9 蛋白的表达下调(0.51 ± 0.02、0.34 ± 0.01、0.18 ± 0.01),凋亡相关蛋白 Bcl-2 蛋白的表达量也减少(0.86 ± 0.04、0.67 ± 0.02、0.23 ± 0.02),且呈剂量依赖性(< 0.01)(图 4C)。
3 讨论
中药在增强机体免疫力和促进肿瘤细胞凋亡等方面具有独特的疗效,多种中药成分能有效发挥抗肿瘤作用[9-10],且其副作用低,逐渐引起众多研究者的关注。现代药理研究表明,乌头类中药如乌头、附子等具有回阳救逆、祛风除湿、温经止痛的功效,主要用于治疗跌打损伤、风湿、关节炎、中风瘫痪、神经性疼痛、胃肠炎、痈疽疮毒等症[11-12]。乌头碱作为多效性天然活性物质,在强心、镇痛、抗肿瘤、调节免疫等方面已显示了良好的疗效[6]。以往,对乌头碱的研究主要集中于对心肌细胞及心血管系统方面,与肿瘤相关研究报道较少。随着对乌头碱的研究不断深入,研究者逐渐发现乌头碱的抗癌价值。
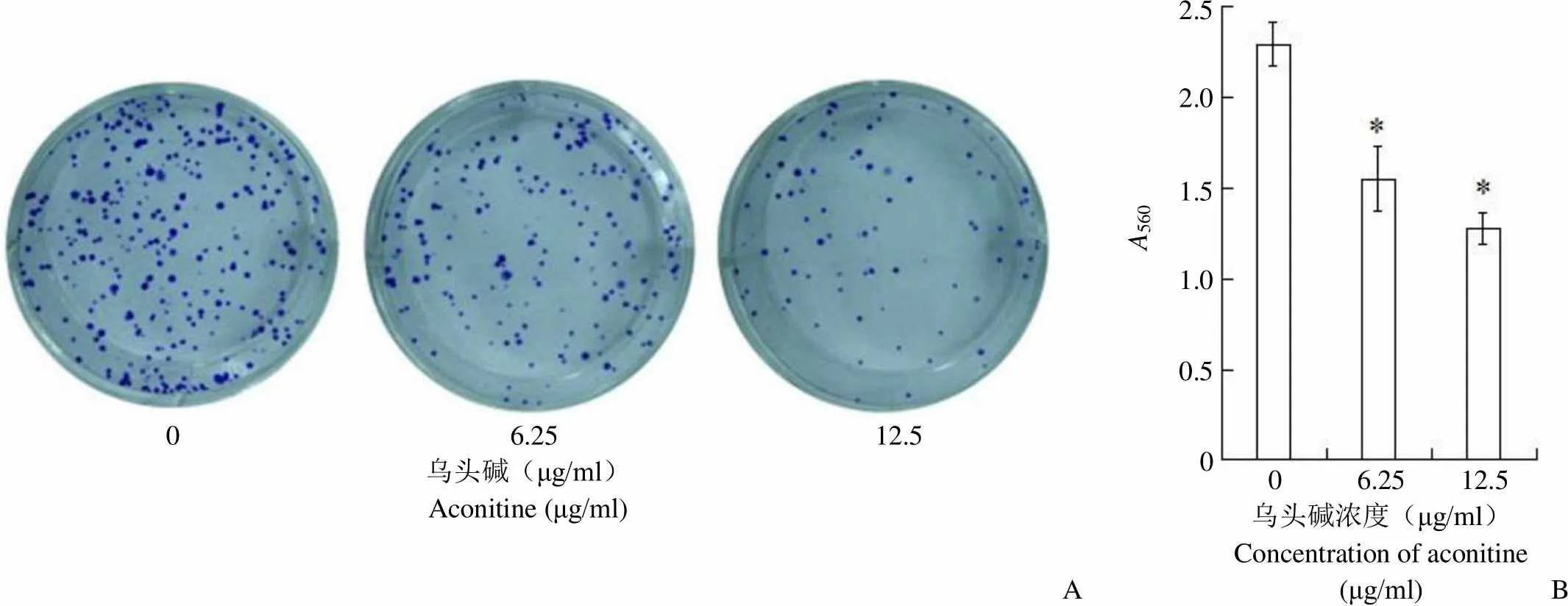
0 6.25 12.5乌头碱(μg/ml)Aconitine (μg/ml) A5602.5 2.0 1.5 1.0 0.5 0 0 6.25 12.5 A 乌头碱浓度(μg/ml)Concentration of aconitine(μg/ml)B
Figure 3 Inhibition of different concentrations of aconitine on the ability of EC-1 cells to clone and form esophageal cancer (A: Platelet assay was used to detect cell clonal ability; B: Quantitative detection of cell clonal ability by spectrophotometry;*Compared with the control group,< 0.01)
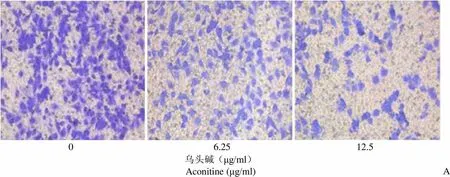
0 6.25 12.5 乌头碱(μg/ml)Aconitine (μg/ml)A
Figure 4 Effects of aconitine on the invasion and apoptosis of EC-1 cells in esophageal cancer [A: Transwell assay was used to detect changes in the invasion ability of aconitine on EC-1 cells (× 200); B: Apoptosis of EC-1 cells after treatment with aconitine was detected by Hoechst 33258 (× 200 ); C: Western blot was used to detect the effects of aconitine on MMP-9 and Bcl-2 proteins in EC-1 cells]
研究显示,乌头碱能抑制大分子 DNA、RNA 的合成,抑制肿瘤细胞增殖,通过促进肿瘤细胞凋亡及诱导肿瘤细胞分化等多种途径发挥抗肿瘤作用。Ji 等[13]研究发现,不同浓度乌头碱对胰腺癌细胞的生长抑制率呈时间和剂量依赖性,并可通过NF-κB 信号通路诱导人胰腺癌细胞的凋亡。乌头碱也可通过抑制 PI3K/AKT 和 MAPK/ERK1/2 信号通路影响 PCNA mRNA 及其蛋白的表达,从而在体内、外抑制黑色素瘤的增殖及促进癌细胞凋亡[8]。Pyaskovskaya 等[14]报道,乌头碱成分能增强二氯乙酸对 Ehrlich 癌细胞的杀伤作用。
本研究以食管癌为研究对象,利用 CCK8 法检测细胞活性,发现不同浓度的乌头碱对食管癌 EC-1 细胞有明显的生长抑制作用,并呈时间-浓度依赖关系;EC-1 细胞的克隆形成能力也随乌头碱的浓度增加而递减,证实了乌头碱能有效抑制 EC-1细胞的生长作用。浸润转移是晚期食管癌的重要死因,因此降低肿瘤细胞的侵袭能力尤为关键。乌头碱能显著抑制 EC-1 细胞的侵袭,并随乌头碱浓度的增加,抑制能力越强。据报道,在侵袭过程中细胞外基质降解或是长出基膜是造成肿瘤浸润转移的主要原因,基质金属蛋白酶(MMPs)是基质降解过程中最为关键的蛋白水解酶。对 MMPs 的研究始于 1962 年,现在已经发现了 28 种人源性MMPs,它们属于依赖锌的内生肽酶家族,其中包括 MMP-9[15]。当前,临床研究中发现,在胃癌、肺癌、乳腺癌等疾病中,MMP-9 的表达水平最高,这主要是和肿瘤的侵袭转移有关系[16]。本研究中,6.25、12.5 μg/ml 乌头碱与对照组相比能明显抑制 MMP-9 的表达,提示乌头碱通过下调 EC-1 细胞侵袭能力从而发挥抗肿瘤作用。
细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序性死亡,又称 I 型程序性细胞死亡。细胞凋亡与肿瘤发生与发展密切相关,诱导细胞凋亡可能是抑制肿瘤生长的机制之一。本研究运用 Hoechst 33258 染色法证实了乌头碱对 EC-1 细胞的诱导凋亡作用,且有浓度依赖性,提示了乌头碱抑制 EC-1 细胞生长与细胞凋亡相关,其机制可能与降低了凋亡相关蛋白 Bcl-2 的影响有关,但具体机制有待进一步实验探讨。
综上所述,本研究发现乌头碱能抑制食管癌 EC-1 细胞增殖,克隆形成能力、侵袭能力亦呈剂量依赖性降低,并能诱导细胞凋亡的发生。我们将进一步探讨乌头碱的抗癌机制,为食管癌的临床治疗提供新的思路和依据。
[1] Huang FL, Yu SJ. Esophageal cancer: risk factors, genetic association, and treatment. Asian J Surg, 2018, 41(3):210-215.
[2] Lin Y, Totsuka Y, Shan B, et al. Esophageal cancer in high-risk areas of China: research progress and challenges. Ann Epidemiol, 2017, 27(3):215-221.
[3] Wu EW, Qi HZ, Zhao HR, et al. Prognostic factors in 167 patients with advanced stage esophageal cancer after radiotherapy and chemotherapy. J Mod Oncol, 2017, 25(3):385-389. (in Chinese)
武二伟, 齐洪志, 赵化荣, 等. 167 例中晚期食管癌放化疗的疗效及预后. 现代肿瘤医学, 2017, 25(3):385-389.
[4] Liu XL, Zhou XF, Wang JY, et al. Research progress in anti-tumor mechanism of traditional Chinese medicine. China Pharm, 2016, 9(6): 1158-1162. (in Chinese)
刘雪丽, 周学锋, 王君瑜, 等. 中药抗肿瘤作用机制研究进展. 中国药师, 2016, 19(6):1158-1162.
[5] Hou Y. Researching progress in auxiliary anti-tumor treatment by TCM reinforcing the healthy Qi. Med Recapitulate, 2014, 20(15): 2728-2730. (in Chinese)
侯莹. 扶正中药辅助治疗肿瘤的研究进展. 医学综述, 2014, 20(15): 2728-2730.
[6] Han X, Hou YJ. Researching progress in aconitine pharmacological effects and toxicity. J China Prescription Drug, 2014, 12(12):149-150. (in Chinese)
韩旭, 侯娅婕. 乌头碱药理作用及毒性研究进展. 中国处方药, 2014, 12(12):149-150.
[7] Du J, Lu X, Long Z, et al. In vitro and in vivo anticancer activity of aconitine on melanoma cell line B16. Molecules, 2013, 18(1):757- 767.
[8] Chodoeva A, Bosc JJ, Lartigue L, et al. Antitumor activity of semisynthetic derivatives of Aconitum alkaloids. Invest New Drugs, 2014, 32(1):60-67.
[9] Chen LJ, Yang YC, Yuan DF, et al. Anti-esophageal cancer effect of isoliquiritigenin and its mechanism. J Mod Oncol, 2018, 26(7): 1012-1015. (in Chinese)
陈利军, 杨艺辰, 袁东方, 等. 异甘草素抗食管癌细胞活性及其机制研究. 现代肿瘤医学, 2018, 26(7):1012-1015.
[10] Han Z, Li B, Wang J, et al. Norcantharidin inhibits SK-N-SH neuroblastoma cell growth by induction of autophagy and apoptosis. Technol Cancer Res Treat, 2017, 16(1):33-44.
[11] Wang T, Lin J, Di SN, et al. Observation of aconite decoction and its demolition square 60 cases of rheumatoid arthritis sp TNF alpha, IL-6, the clinical curative effect. Acta Chin Med Pharmacol, 2016, 44(1): 85-87. (in Chinese)
王涛, 林静, 狄舒男, 等. 乌头汤及其拆方对60例寒湿型类风湿性关节炎TNF-ɑ、IL-6的临床疗效观察. 中医药学报, 2016, 44(1): 85-87.
[12] Gao Y, Fang DM. The research progress of anti-inflammation mechanism of aconite. Tianjin Pharm, 2016, 28(3):70-72. (in Chinese)
高颖, 房德敏. 乌头类药物抗炎作用机制的研究进展. 天津药学, 2016, 28(3):70-72.
[13] Ji BL, Xia LP, Zhou FX, et al. Aconitine induces cell apoptosis in human pancreatic cancer via NF-κB signaling pathway. Eur Rev Med Pharmacol Sci, 2016, 20(23):4955-4964.
[14] Pyaskovskaya ON, Boychuk IV, Fedorchuk AG, et al. Aconitine-containing agent enhances antitumor activity of dichloroacetate against Ehrlich carcinoma. Exp Oncol, 2015, 37(3): 192-196.
[15] Liu Y, Wang Y, Teng Z, et al. Matrix metalloproteinase 9 expression and survival of patients with osteosarcoma: a meta-analysis. Eur J Cancer Care (Engl), 2017, 26(1).
[16] Kurisaka C, Oku T, Itoh S, et al. Role of sialic acid-containing glycans of matrix metalloproteinase-9 (MMP-9) in the interaction between MMP-9 and staphylococcal superantigen-like protein 5. Microbiol Immunol, 2018, 62(3):168-175.
Aconitine inhibits the proliferation and invasion while induces the apoptosis of esophageal cancer EC-1 cells
ZHOU Xiao-jian, LI Yu-hua, TANG Xiang, LYU Yu-bing, ZHOU Jia-bin
Department of Clinical Laboratory, Xinzao Hospital, Guangzhou 511436, China (ZHOU Xiao-jian, LI Yu-hua, TANG Xiang); Department of Clinical Laboratory, Panyu Center Hospital, Guangzhou 511400, China (LYU Yu-bing, ZHOU Jia-bin)
To investigate the effects of aconitine on the proliferation, invasion and apoptosis of esophageal cancer cells EC-1.
CCK8 assay and colony formation experiment were used to check the inhibitory effect of aconitine on EC-1 esophageal cancer cell growth. Effect of aconitine on apoptosis in EC-1 cells was detected by Hoechst 33258 staining assay. Transwell method was used to valuate the ability of cell invasion after aconitine treatment. Western blot was used to detect the expression of proteins related to cell invasion and apoptosis after treatment.
Aconitine significantly inhibited the proliferation of esophageal cancer cell line EC-1 in both time- and dose-dependent manner (< 0.01). The half inhibitory concentration of 48 h on EC-1 cells was 6.171 μg/ml. When compared with the normal control group, 6.25 and 12.5 μg/ml aconitine treatment could significantly reduce the colony formation and cell invasion, while induce apoptosis in the cells, and aconitine also significantly reduce the expression of MMP-9 and Bcl-2.
Aconitine has significant antitumor effect, which may be correlated with the inhibition of tumor cell proliferation and invasion as well as the induction of apoptosis.
Aconitine; Esophageal neoplasms; Cell proliferation; Neoplasm invasiveness; Apoptosis
ZHOU Xiao-jian, Email: lwtgzq@yeah.net
10.3969/j.issn.1673-713X.2019.04.008
周小剑,Email:lwtgzq@yeah.net
2019-03-29

