微卫星(SSR)标记-毛细管电泳法分析比较不同产地青稞亲缘关系
周冠炜 罗静 胥霞

摘 要:针对不同产地的11个青稞样品,采用已知的21种SSR引物进行多态性分析、毛细管电泳图谱分析和聚类分析,并构建指纹图谱。结果表明:17种引物的多态性良好,能很好的区分受试青稞品种;受试青稞品种遗传相似系数在0.6206~0.9706,不同产地的青稞品种亲缘关系远近不一;采用3对引物就可以高效的将受试品种进行鉴别,并构建指纹图谱。实验可以为鉴定青稞的植物基源和品种选育提供理伦依据。
关键词:青稞;SSR;毛细管电泳法;指纹图谱
中图分类号 S512.3 文献标识码 A 文章编号 1007-7731(2019)13-0026-07
Abstract:A total of 21 SSR primers were used for polymorphism analysis,capillary electrophoresis mapping and cluster analysis, and fingerprints were constructed for 11 samples from different habitats.The res?Lts showed that the 17 primers had good polymorphism and co?Ld distinguish the tested c?Ltivars.The genetic similarity coefficient of the tested c?Ltivars was between 0.6206 and 0.9706.The phylogenetic relationships of different c?Ltivars were different.The three pairs of primers were used.It is possible to efficiently identify the tested varieties and construct a fingerprint.This experiment can provide reference for the identification of plant source and variety breeding of barley.
Key words:Highland barley;SSR;Capillary Electrophoresis;Fingerprint
青稞是青藏高原地区特有物种,具有悠久的栽培历史,距今已有3500年。经过长达1000年的驯化、杂交以及近现代生物技术的改良,目前青稞可分为白青稞、黑青稞、红青稞等不同类型,多达近100个品种,分布于我国西藏、青海、四川的甘孜州和阿坝州、云南、贵州等地。近年来,随着人们对食品安全、营养的重视,以青稞为主要原料、辅料的食品开始逐渐走入人们的日常饮食中。不同品种的青稞果实的营养成分和口感差异较大,而不同产地的青稞性状表达差异较大,难以通过肉眼准确鉴别。因此,有必要通过分子生物学手段对青稞亲缘关系进行鉴别。
微卫星即简单重复序列(Simple Sequence Repeat,SSR)技术是常用的分子标记技术之一,具有基因组分布广泛、数量丰富、多态性高、重复性好等优点[1],在小麦、青稞等作物上早已有相关的研究报道[2-4]。SSR标记研究大多采用聚丙烯酰胺凝胶电泳(SDS-PAGE),该方法制胶难度较大、步骤多且操作繁琐。毛细管電泳法相对于聚丙烯酰胺凝胶电泳,其优势在于样品用量少、灵敏度高、分离度高和操作简单便捷的特性;现已广泛用于医学临床,药品和食品安全检测等方面[5],也可以用于蛋白质和核酸的检测及分子标记中[6]。本研究根据Grain genes网站上已知的SSR标记,采用多种不同引物,结合毛细管电泳法对四川、西藏、云南、青海等产地的几种常见青稞品种亲缘关系的鉴定进行了初步探究,以期为青稞的植物基源和品种选育奠定基础。
1 材料与方法
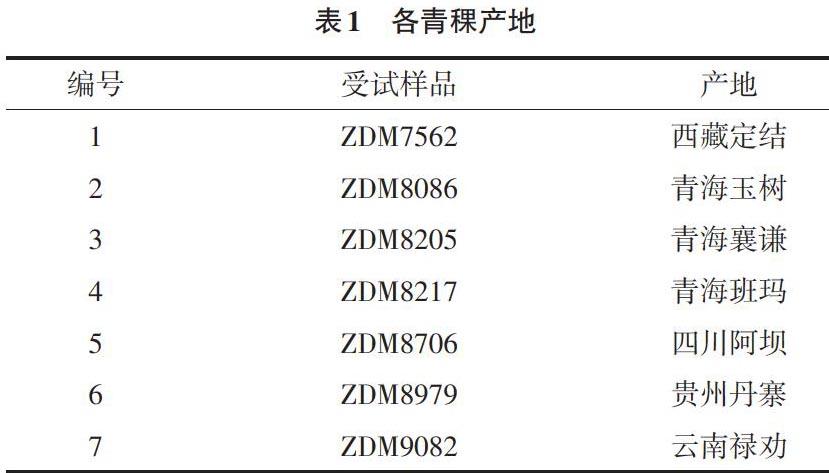
1.1 实验材料 已知品种的青稞材料均由中国农业科学院种子库提供,其余实验材料由当地种植户提供。各青稞产地信息如表1所示。
1.2 仪器、试剂
1.2.1 主要仪器 2720 thermal cycler PCR仪(Applied Biosystems公司),电泳仪、电泳槽、凝胶成像仪(北京君意东方电泳设备有限公司)
1.2.2 主要试剂 TSINGKE植物DNA提取试剂盒(通用型)、2x TSINGKE Master Mix、DL2000 Marker、高纯度低电渗琼脂糖、实验所用引物(北京擎科新业生物技术有限公司),无水乙醇(成都市科龙化工试剂厂)。
1.3 实验方法
1.3.1 基因组提取 使用TSINGKE植物DNA提取试剂盒(通用型)进行提取。具体步骤如下:(1)将核酸纯化柱(Spin Column)置于Collection Tube中,加入250?L Buffer BL,12000 r/min离心1min活化硅胶膜。(2)分别称取不同来源青稞新鲜组织100g左右,加入液氮充分研磨。研磨后置于1.5mL离心管中,加入400?L缓冲液gP1,涡旋振荡1min,65℃水浴10~30min,期间可取出颠倒混匀以充分裂解。(3)加入150?L缓冲液gP2,涡旋振荡1min,冰浴5min,然后12000 r/min离心5min,取上清液转移至新的离心管中。(4)加入与上清等体积的无水乙醇,立即充分振荡混匀,液体全部转入Spin Column中,12000 r/min离心30s,弃废液。(5)向Spin Column中加入500?L缓冲液Pw(使用前已加入无水乙醇),12000 r/min离心30s,弃废液。(6)向Spin Column中加入500?L漂洗缓冲液(使用前已加入无水乙醇),12000 r/min离心30s,弃废液。然后再重复加入500?L漂洗缓冲液(使用前已加入无水乙醇),12000 r/min离心30s,弃废液。(7)将Spin Column放回Collection Tube中,12000 r/min离心2min,开盖晾干1min。(8)取出纯化柱,放入1个干净的离心管中,在吸附膜的中央处加50~100TE缓冲液(65℃预热TE Buffer),20~25℃放置2min,12000 r/min离心2min。
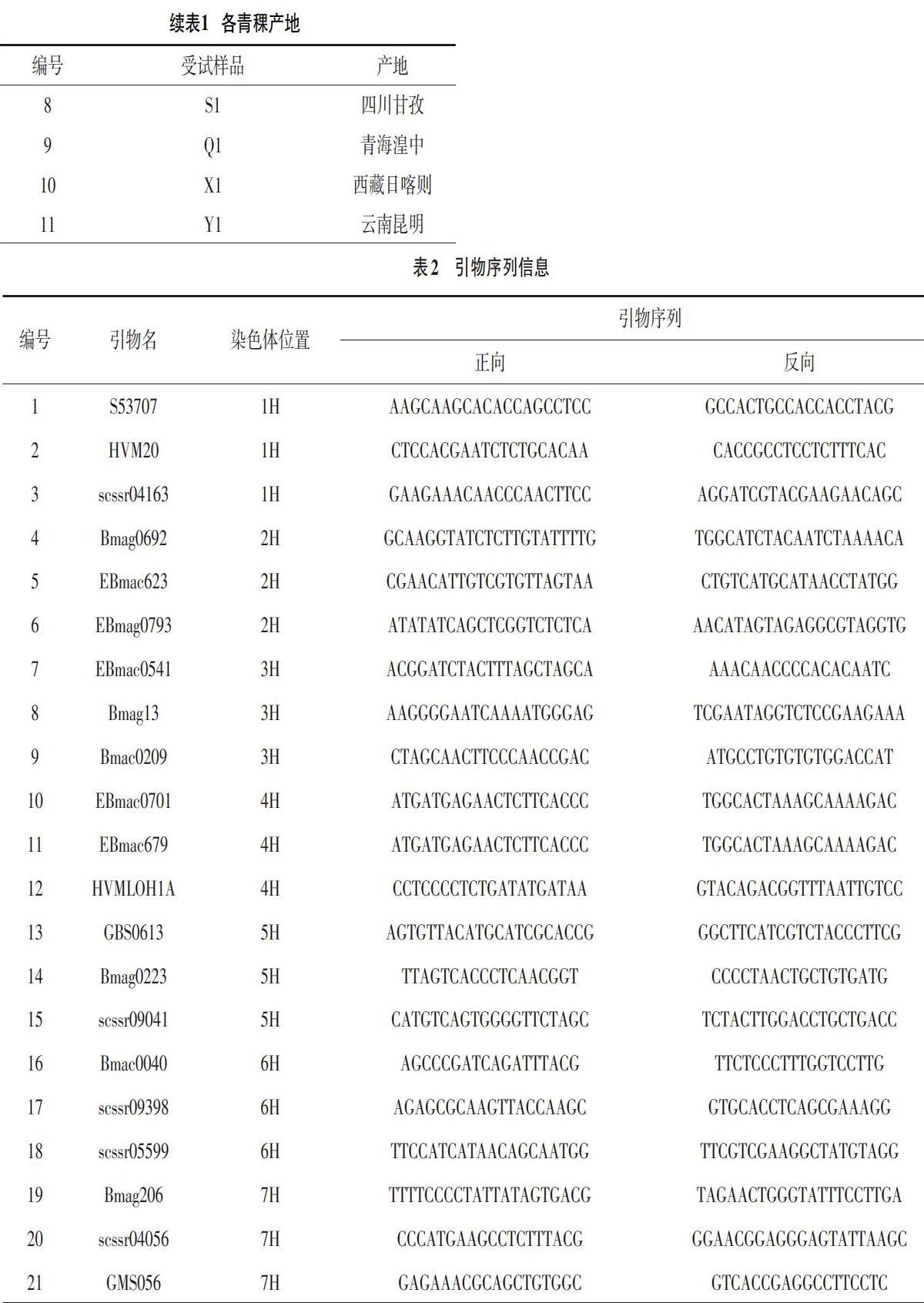
1.3.2 SSR引物选择 根据Grain genes网站上已知的SSR标记,随机挑选均匀分布于7条青稞染色体的21对多态性较好的SSR引物,所用引物均由北京擎科新业生物技术有限公司提供,各引物序列见表2。
1.3.3 PCR扩增 扩增体系:PCR反应总体积15?L,其中基因组DNA 1?L,2x TSINGKE Master Mix 7.5?L,10?mol/L的正向和反向引物各1?L,超纯水4.5?L。扩增程序:在2720 thermal cycler PCR仪上扩增。94℃预变性5min后,94℃变性30s,退火30s,72℃延伸30s为1个循环,30个循环后在72℃延伸5min,在4℃下放置保存。
1.3.4 DNA完整性校验 采用琼脂糖凝胶电泳对8个青稞样品进行基因组完整性检测。
1.3.5 毛细管电泳 将高度去离子甲酰胺与500bp的LIZ-500内标按130∶1混合,配成混合物。接着用国产96孔反应板进行分装,每个孔中加入10?L混合物。对应在96孔板中加入0.5?L样品模板,离心到4000后停止。上样3730测序仪进行毛线管电泳,结束后获取下机结果并用软件Genemapper 4.1进行数据分析。
2 结果与分析
2.1 DNA完整性检验分析 采用琼脂糖凝胶电泳对不同产地11种青稞进行基因组完整性检测,得到如图1和图2的电泳图(DL2000 DNA Marker)。由图1和图2可知,所有供试样品均为单一条带,清晰度高,完整没有拖尾和非特异性扩增条带,所选取的引物扩增出来的谱带也非常完整,没有杂带,因而可以说明11个样品中基因组完整性好,能够进一步做SSR标记分析。
2.2 SSR位点多态性分析 在选取的21对引物中,有17对引物的毛细管电泳结果检测到了多态性位点,占所筛选引物的80.95%。用Popgene32软件分析得到不同引物的有效等位基因数(Na)、Shannon′s指数(Shannon′s Information Index)和多态信息含量(Polymorphismc Information Content,PIC)见表3。由表3可知,各位点检测到的等位基因在2~13个,共检测到了82个等位基因,平均每个位点4.82个,片段长度在143~388bp。其中,位于染色体7H上的Bmag206引物检测到的等位基因最多,有13个,而位于染色体6H上的Bmac0040引物检测到的等位基因最少,只有2个。有效等位基因在1.3297~8.3333,平均有效等位基因有2.8827个,Shannon′s指数在0.5481~2.3593,平均值为1.1146,其中Shannon′s指数最低的是EBmac0541标记引物,最高的是Bmag206引物。多态信息含量能够一定程度上反映某一引物在群体内的检测能力,根据Bostein等提出的对PIC值的划分理论,高度多态性位点PIC值>0.5,中度多态性位点0.5≥PIC值≥0.25,而低度多态性位点PIC值<0.25[8]。在本实验结果中,所有位点的PIC值在0.2389~0.8702,17个标记当中只有1个低度多态性位点,中度多态性位点有7个,而高度多态性位点有9个,占标记总量的52.94%,充分说明所选的17个标記引物在试验青稞品种中有着丰富的多态性。
2.3 毛细管电泳图谱分析 用Genemapper 4.1软件对毛细管电泳结果进行分析,分析每个样品每个位点的等位基因扩增片段大小,当样品间差异位点数≥2时,判定为不同;当样品间差异位点数=1时,判定为近似;当样品间差异位点数=0时,判定极近似或相同[7]。其中,引物Bmag206的电泳图谱如图3~13所示,荧光强度为纵坐标,片段长度为横坐标。
由图3~13的毛细管电泳图分析可知,引物Bmag206在8个不同产地青稞当中具有较多的差异位点,具体等位基因如图中标签所示。同时,可以看到图4、图9、图13都具有明显的非特异性特征峰,可能是由于引物不适用及PCR反应循环条件不佳[9]。图中特异性峰的旁边一般有大小不一的滑移峰紧密挨着,这是特异性主峰的判定依据,这些峰通常比主峰多1个(几个)或少1个或几个重复单位,也叫stutter峰,主要是因为常规的PCR扩增体系和扩增程序使大的DNA片段不能得到充分的延伸,造成检测的谱带会出现几个连续的低峰[10]。图中还可以看到少量杂峰,但并不影响主峰的判读,并且所有的青稞样品图谱都是二倍体,没有其他多倍体出现。
2.4 SSR聚类分析 根据毛细管电泳最终结果,对数据进行标记,有位点标记为1,无标记为0,组成由1,0构成的矩阵,然后经过NTSYSpc 2.1聚类分析得到如图14的树状聚类图。
通过对不同产地青稞材料的SSR标记数据进行统计分析,得到遗传相似系数在0.6206~0.9706,遗传距离能够反映材料的遗传差异情况。在遗传相似系数为0.6206时,材料被分成了2大类,产地为云南昆明的Y1单独分成了第Ⅰ大类。第Ⅱ大类划分为2类,其中产地为四川阿坝的S1单独成一类;在遗传距离0.817附近,材料又划分为2类,其中产地为青海湟中的Q1青稞单独成一类。
从遗传距离来看,产地为西藏日喀则的X1与产地为西藏定结的ZDM7562遗传相似度非常高,产地为青海班玛的ZDM8217和产地为贵州丹寨的ZDM8979遗传相似度也非常高。
通常遗传背景相似,来源相近的品种其亲缘关系也会更近[11]。但产地为四川阿坝的ZDM8706在遗传距离上与同为四川产地的S1相去甚远,反而与产地为西藏的2个品种X1、ZDM7562相近;说明尽管来自相近或相同的产地,其品种间的差异也不一定更小,来自不同产地的青稞品种亲缘关系也可能更近。
综上所述,17对SSR标记引物能很好的将11个不同产地青稞品种分别开来,结果表明不同来源的品种亲缘关系远近不一,4个农家品种与已鉴定的青稞品种在种质资源上有着不同的遗传背景,可以作为种质选育和品种利用的有效依据。
2.5 不同产地青稞指纹图谱的构建 根据毛细管电泳结果,以SSR标记引物名为第1部分,以标记在不同样品的扩增位点为第2部分,2个部分共同构成青稞品种的编号,按照引物分析结果对其进行排序,根据组合的代码形成不同青稞品种的SSR指纹图谱,见表4。
根据标记引物和位点的排序结果,最终可以筛选出3对SSR引物就可以将11种不同产地青稞品种区别开来。仅引物Bmag206就可以区分ZDM8086、ZDM8205、ZDM8217等9个品种。而Q1则需要用引物GBS0613来进行区分,ZDM7562则需要用引物S53707来进行区分。仅3对引物就可以高效的将试验采用的农家种与已鉴定品种进行鉴别,为青稞品种的鉴定提供一定参考。
3 结论
SSR位点多态性分析显示,针对本次实验的8个青稞样品,21种引物中有17种引物多态性良好,检出等位基因数2~13个不等,共测得82个等位基因,平均每个位点4.82个;PIC值在0.2389~0.8702,平均PIC值为0.5178。表明青稞样品具有丰富的遗传多样性,样本间遗传差异较大,是较为理想的实验对象。
毛细管电泳结果经软件处理后具有明显的特征峰,尽管由于DNA片段延伸不完全造成的stutter峰和非特异性特征峰,但并不影响主峰的判读。
聚类分析结果显示,遗传相似系数在0.6206~0.9706,在遗传相似系数为0.6206时,材料被分成了2大类,产地为云南昆明的农家种Y1单独被分成了一类,其余材料归为另一类。17对SSR引物能很好的将11个不同产地青稞品种分别开来,且不同产地的青稞品种亲缘关系远近不一,来源于不同产地的青稞品种也可能具有更近的亲缘关系。
指纹图谱构建显示,仅3对引物就可以高效的将试验采用的农家种与已鉴定品种进行鉴别。通过构建指纹图谱,可以为青稞的植物基源和品种选育提供参考。
参考文献
[1]EL RABEY H,KHAN J A,AL-MALKI A L et al.Synteny (co-linearity) in some cereal crops genomes as revealed by amplifed fragment length polymorphisms (AFLP),simple sequence repeats (SSR) and inter simple sequence repeats (ISSR) markers[J].African Journal of Biotechnology,2012,11(88):15387-15397.
[2]SAGAHI-MAROOF M A S,BIYASHEV R M,YANG G P,et al.Extraordinary polymorphic microstatellite.DNA in barley-species diversity,chromosomal locations,and pop?Lation dynamics[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91:5446-5470.
[3]馮宗云,张义正,张立立,等.应用微卫星标记研究西藏野生二棱大麦的遗传多样性及地理分化[J].高技术通讯,2003,10:46-53.
[4]潘志芬,邹弈星,邓光兵,等.青藏高原栽培青稞标记遗传多样性研究[J].中山大学学报(自然科学版),2007,46(2):82-86.
[5]孙淼,李林森,朱超,等.2017年毛细管电泳技术年度回顾[J].色谱,2018,36(04):327-333.
[6]原红军,曾兴权,徐其君,等.青稞种质资源遗传多样性分析与核心种质群体的构建[J].麦类作物学报,2018,38(08):922-928.
[7]孙淼,李林森,朱超,等.2017年毛细管电泳技术年度回顾[J].色谱,2018,36(04):327-333.
[8]高素伟,张连海,赵新宇.毛细管电泳在玉米品种真实性鉴定中的应用[J/OL].中国种业,2019(03):1-2[2019-03-31].
[9]Botstein D,White RL,Skolnick M,Davis RW.Construction of a genetic linkage map in man using restriction fragment length polymorphisms.American journal of human genetics.1980;32(3):314–331.
[10]潘菲,宋坤,盛弘强,等.多重荧光PCR-毛细管电泳进行微卫星不稳定性分析中的常见问题[J].临床与实验病理学杂志,2008(05):619-624.
[11]王凤格,易红梅,赵久然,等.毛细管电泳荧光检测中的异常电泳类型及原因分析[J].分子植物育种,2007(06):890-894.
(责编:张宏民)

