SiO2-PEG药物洗脱支架涂层的左旋多巴改性研究
林燕喃,陈文平,颜佳佳
(1. 福建卫生职业技术学院药学系, 福建 福州 350101; 2. 福州大学材料科学与工程学院, 福建 福州 350108)
0 引言
心血管堵塞引起的冠心病已成为全球死亡率最高的疾病之一[1]. 在冠心病的治疗方法中,支架术因其微创性、 高效性与疗效显著等特点,已成为主要治疗手段之一[2]. 药物洗脱支架是将药物负载在金属支架表面包被的涂层上,支架植入到血管的狭窄处后,药物逐渐洗脱出来,释放至心血管壁发挥疗效. 其释放药物可起到抗凝、 抗增生等作用,抑制支架内再狭窄的发生,逐渐成为支架术植入疗法的首选器械[3-6].
阿司匹林在防治血栓栓塞性心血管疾病方面有着十分广泛的应用,可显著降低高危患者心血管疾病事件的发生率[7]. 将阿司匹林以各种方式装载至洗脱支架的聚合物涂层基质中并研究其释放行为,是近年来生物医药材料及器件领域关注的热点[8]. 但是,聚合物基质的微结构难以调控,而基于溶胶-凝胶湿化学工艺制备的有机-无机复合材料具有微结构可调的特点,使其在控制药物释放方面有潜在应用[9].
基于此,本文以正硅酸四乙酯(TEOS)和聚乙二醇(PEG)为前驱体,辅以左旋多巴的黏结性和自交联性能,用溶胶-凝胶法制备左旋多巴改性的SiO2-PEG药物洗脱支架涂层,并进而装载阿司匹林. 考察不同配方以及制备工艺制得的涂层中阿司匹林的体外释放行为,研究影响阿司匹林释放性能的因素.
1 材料与方法
1.1 仪器与试剂
立式金相显微镜(XJL-03,重庆麦克光电仪器公司); 台式恒温震荡器(TH2-312,上海精宏实验设备公司); 紫外可见分光光度计(UV-2450,日本岛津).
316L不锈钢片购自上海伊夏不锈钢制品有限公司; 聚乙二醇6000(PEG6000,CP)、 正硅酸四乙酯(TEOS,AR)、 左旋多巴(L-DOPA)、 磷酸氢二钠和磷酸二氢钠购自Sigma Aldrich; 3-氨丙基三乙氧基硅(APTES,98%)购自Alfa Aesar.
1.2 载药涂层的制备
将大小为20 mm×20 mm×0.2 mm的316L不锈钢片置于异丙醇溶液中超声波清洗2 h,取出,水洗、 干燥后置于质量分数为65%~68%浓硝酸溶液中,密闭浸泡6 h,取出,水洗、 干燥. 将不锈钢片浸入0.05 mol APTES的乙醇溶液中,浸泡0.5 h,取出,室温晾干.
表1为制备L-DOPA改性的SiO2-PEG载药涂层的配方及工艺. 分别量取44.6 mL TEOS、 70 mL乙醇和21.6 mL H2O,混合搅拌3 h后,滴加盐酸调节pH值为3,继续搅拌2 h. 加入3.6 g PEG6000,按照表1的配方,在不同温度下继续搅拌24 h,滴加APTES调节溶液pH值至中性. 按配方加入L-DOPA,继续搅拌120 h,冷却. 量取20 mL 溶液,加入阿司匹林,搅拌均匀后采用提拉法在预处理后的不锈钢片表面镀膜,干燥,即制得载药涂层样品. 采用立式金相显微镜观察制备的SiO2-PEG体系涂层的表面形貌.
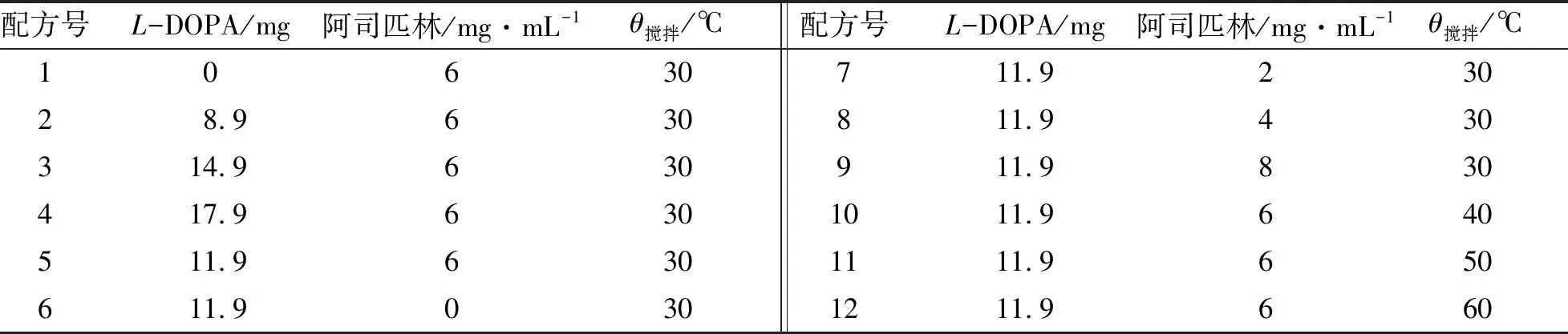
表1 L-DOPA改性的SiO2-PEG载药涂层的制备
1.3 药物释放试验
磷酸盐缓冲液(PBS)的配制: 分别称取30.8 g磷酸氢二钠和15.6 g磷酸二氢钠,溶于1 000 mL蒸馏水中,制得0.1 mol的PBS(pH=7.4).
将载药涂层样品放入密闭容器中,加入10 mL PBS缓冲液作为释放介质,置于恒温振荡箱中,温度设定为37 ℃,振荡频率为120 r·min-1. 在特定的时间点取出10 mL PBS, 添加同体积的新鲜释放介质, 用紫外-可见吸收光谱法对取出的PBS溶液进行测试,由在296 nm处阿司匹林的特征吸收峰强,根据标准曲线,计算并绘图得到阿司匹林的体外释放曲线.
2 结果与讨论
2.1 L-DOPA改性SiO2-PEG载药涂层的形成机理
TEOS在溶液中会逐渐水解并发生缩聚反应,最后生成SiO2, 详见图1中结构式(1)~(4)所示. 当反应进行到一定程度时,加入PEG,其羟基与TEOS反应过程中硅酸的Si-OH形成氢键, 构成三维骨架[10],如结构式(5)所示. 有机-无机杂化体的形成,可限制单个无机颗粒长大; 同时,PEG对缩聚后的颗粒具有交联和包覆作用,形成环状有序的网络结构特征,使簇团粒度逐渐增大,成膜性显著提高. 但在某些使用场合,SiO2-PEG涂层仍会出现开裂现象,并且与基体的黏结性较差[8].
L-DOPA在溶液中会发生一系列的氧化、 交联反应,如结构式(6)所示,反应产物富含酚羟基. 仿生学研究表明,L-DOPA具有良好的生物黏结性,这种黏结性主要来源于丰富的酚羟基[11-13]. 此外,L-DOPA的苯酚基团还可与金属材料螯合形成不可逆的有机金属螯合物. Lee 等[14]发现,归功于L-DOPA的高亲和力和化学多功能性,其与潮湿的金属氧化物表面之间存在良好的非共价结合的亲和力,可实现有机物与金属等不同材料之间的表面黏附功能. 本文中,L-DOPA的引入有利于提高SiO2-PEG涂层的内聚力,增强涂层强度,降低涂层脆性,改善其黏结力.
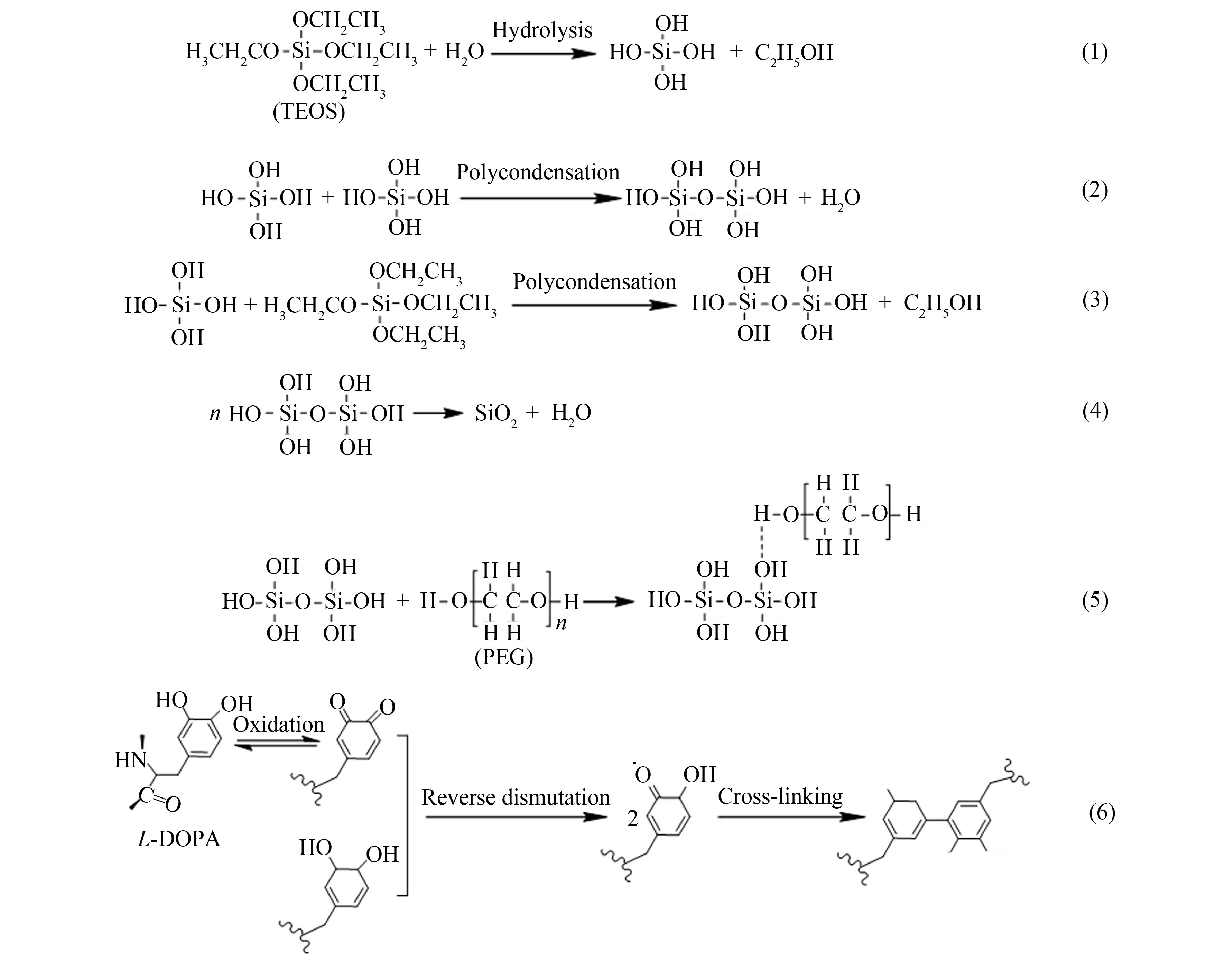
图1 L-DOPA改性SiO2-PEG载药涂层的形成机理示意图Fig.1 Forming mechanism of L-DOPA modified SiO2-PEG coatings
2.2 L-DOPA添加量对载药涂层释放性能的影响
根据表1配方1~5号,在SiO2-PEG涂层溶液中分别加入不同含量的L-DOPA,考察L-DOPA添加量对涂层中阿司匹林释放性能的影响. 图2是添加不同L-DOPA含量的SiO2-PEG涂层的三维立体显微形貌.

图2 不同L-DOPA添加量的涂层表面金相显微图Fig.2 Surface morphology of coatings with different L-DOPA contents
从图中可看出,加入阿司匹林后,涂层表面出现不同程度的析晶现象. 未添加L-DOPA的涂层,过饱和的阿司匹林晶体一部分析出在涂层表面,另有一部分析出在涂层表层; 随着L-DOPA添加量不断增大,表面析出的阿司匹林晶体不断增多. 添加17.9 mgL-DOPA的样品出现多层致密的阿司匹林晶体,说明L-DOPA加入越多,涂层内部的孔道数量越少,阿司匹林的饱和装载浓度也就越低.

图3 不同L-DOPA添加量的涂层中阿司匹林释放曲线Fig.3 Aspirin release profiles from coatings with different L-DOPA contents
图3是不同L-DOPA添加量的药物涂层中阿司匹林释放曲线. 由图可知,L-DOPA的添加量低于11.9 mg时,药物释放相对缓慢,大于11.9 mg后,L-DOPA加入越多,药物释放越快. 从总体上看,L-DOPA添加量为11.9 mg时,药物释放最缓慢. 这主要是由于前驱体水解缩聚形成SiO2网络结构,加入PEG后在SiO2骨架中形成相互联通的孔道,阿司匹林分散在孔道中,可有效控制药物的扩散释放[10]. 此外,在水溶液中,L-DOPA易发生氧化反应,生成多巴醌.L-DOPA和多巴醌进一步发生反歧化反应导致其交联聚合,除了在涂层中起到强化涂层机械性能、 增加粘结性的作用以外,同时导致涂层的孔径减小,进一步降低阿司匹林的扩散速率[15].
2.3 阿司匹林浓度对载药涂层释放性能的影响
根据表1的配方5~9号,在SiO2-PEG涂层溶液中分别加入不同浓度的阿司匹林,考察载药浓度对涂层中阿司匹林释放性能的影响. 图4是装载不同浓度阿司匹林的涂层三维立体显微形貌. 由图可见,未装载药物的涂层表面平整光滑. 载药浓度为2 mg·mL-1的涂层表面无阿司匹林晶体析出,但出现许多细小的凸起,并有群聚的现象,其中带有少量的白色斑片. 载药浓度为4 mg·mL-1的涂层表面光滑,未见任何阿司匹林晶体析出,但表层下面有明显的阿司匹林柱状晶体析出. 当所添加的药物超过了涂层溶液的饱和装载浓度后,药物相继在涂层表层和涂层表面析出晶体. 当浓度增加到6 mg·mL-1之后,涂层表面析出少量的细条状晶体,浓度继续增加到8 mg·mL-1后,涂层表面析出的阿司匹林晶体越来越多.

图4 装载不同浓度阿司匹林的涂层表面金相显微图Fig.4 Surface morphology of coatings loaded with different aspirin
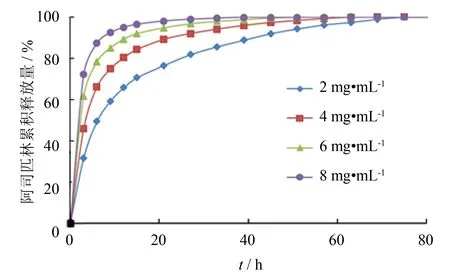
图5 装载不同浓度阿司匹林的涂层中药物释放曲线Fig.5 Drug release profiles from coatings loaded with different concentrations of aspirin
图5是装载不同浓度阿司匹林的药物涂层释放曲线. 由图可知,浓度越低,药物释放越缓慢,其中2 mg·mL-1样品释放最为缓慢,3 h内释放了总释放量的31.8%,到51 h时释放了总量的94%,出现严重的突释现象. 由释放曲线可知,药物浓度越高,突释现象越明显,这一方面与药物装载量过多有关,另一方面也与阿司匹林本身的酸性有关系. 阿司匹林加入涂层溶液中,其酸性会影响SiO2前驱体TEOS的水解缩聚,阿司匹林浓度太高不利于缩聚过程,形成的SiO2网络结构相对疏松,不利于药物的装载[16],涂层的载药能力有限,超过涂层装载量的阿司匹林停留在涂层表面或表层,导致释放时该部分药物直接溶解在PBS,产生严重的突释现象.
2.4 涂层制备工艺对载药涂层释放性能的影响
根据表1的配方10~12号,在制备SiO2-PEG涂层溶液时采用不同的搅拌温度,考察搅拌温度对载药涂层中阿司匹林释放性能的影响. 图6是不同温度下搅拌24 h各涂层三维立体显微形貌. 由图可见,在40 ℃下搅拌24 h后制备的样品表面光滑平整,无晶体析出. 50 ℃涂层表面也相对平整光滑,但可观察到少量的点状阿司匹林晶体,而60 ℃下的涂层表面未观察到晶体析出,但涂层内部表层可见部分柱状阿司匹林晶体.

图6 不同温度下搅拌24 h的药物涂层表面金相显微图Fig.6 Surface morphology of coatings prepared under different stirring temperatures for 24 h
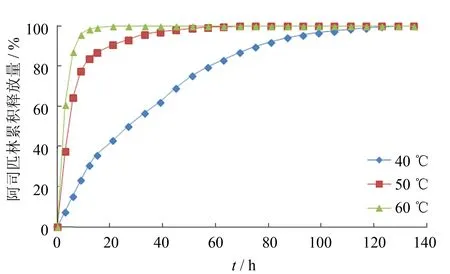
图7 在不同温度下搅拌24 h的涂层中阿司匹林的释放曲线Fig.7 Aspirin release profiles from coatings prepared under different stirring temperatures for 24 h
图7是在不同温度下搅拌24 h后制备的涂层药物释放曲线,由图可见,随着搅拌温度的升高,药物释放速率显著加快. 40 ℃条件下搅拌24 h后制备的释药速率最为缓慢,60 ℃条件下,药物涂层出现明显的突释现象,9 h内释放了总释放量的95.8%,后续仅释放微量的药物. 可见随着搅拌温度的升高,涂层的装载能力下降,析出阿司匹林晶体. 可能原因是加入L-DOPA时,SiO2前驱体TEOS仍处于水解缩聚状态,温度的改变对水解缩聚过程会产生很大的影响,温度越高,乙醇挥发越快,TEOS未完全水解就进入凝胶状态,导致溶液粘度变大,药物在涂层中的扩散变得缓慢,从而出现涂层内部析晶[17]. 释药时,析出的药物晶体迅速释放至PBS中,导致药物的突释现象.
3 结语
实验制备左旋多巴改性的SiO2-PEG药物洗脱支架涂层,以阿司匹林为模型药物,考察不同配方以及制备工艺制得的载药涂层中阿司匹林的体外释放行为,研究影响阿司匹林释放性能的因素. 实验结果表明,添加L-DOPA可延缓阿司匹林的释放,但L-DOPA加入过多可导致药物释放速度加快. 涂层中阿司匹林的释放速率随着其装载浓度的增加而加快. 制备涂层时的搅拌温度可影响涂层溶剂挥发的速度,进而改变涂层结构,影响阿司匹林的释放速率.

