PARP1调控黑素瘤细胞中lncRNA表达谱的分析
葛 睿 张 键 穆 欣 王丽娟 田 琼 高田原 梁 艳 孙 靓 牟宽厚
黑素瘤具有高度侵袭性是皮肤肿瘤造成死亡的主要病因[1]。近年来黑素瘤的发生率逐年提高[2]。早期黑素瘤经手术切除后5年生存率可达90%以上,然而中晚期黑素瘤5年生存率仅为16%[3,4]。虽然免疫及靶向治疗的发展大大的提高了黑素瘤的治疗效果,然而治疗过程易发生耐药,依然极大的限制了黑素瘤的治疗[5,6]。因此,探寻黑素瘤的发病机制,在此基础上积极寻找新的治疗靶点对黑素瘤患者具有极大的意义。
聚二磷酸腺苷核糖多聚酶1[poly(adenosine diphosphate-ribose) polymerase 1,PARP1]作为DNA损伤修复中的关键分子,其可通过调节染色质结构参与调控基因的表达[7]。已有研究证实PARP1与黑素瘤的发生、发展密切相关,然而其具体机制尚未完全阐明[8,9]。早期研究为探索PARP1的可能作用机制,对其调控的基因表达谱进行了检测,该研究发现PARP1除了可调控基因表达水平变化之外,还可引起包括H19在内的长链非编码RNA(long noncoding RNA, lncRNA)表达水平变化,提示PARP1可通过调节lncRNA表达水平参与疾病的发生[10]。那么PARP1是否可通过异常调控lncRNA表达水平并进一步参与黑素瘤发病目前尚未有相关报道。本研究拟在既往研究的基础上通过lncRNA芯片筛查由PARP1调控的差异性lncRNA,为进一步探讨PARP1参与黑素瘤发病的机制提供线索及实验依据。
材料与方法
1.细胞系与主要试剂:人恶性黑色素瘤细胞A2058购自美国模式培养物集存库(American typeculture collection,ATCC);DMEM/F12培养基、胎牛血清、Trizol购自美国Invitrogen公司;Lipofectamine 3000购自美国Thermo Fisher公司;干涉片段购自中国Genepharma公司;β-actin引物购自生工生物;反转录试剂盒、SYBR Green试剂盒购自日本TaKaRa公司。
2.细胞培养与转染:细胞用含10%胎牛血清的DMEM/F12培养基,5%CO2,37℃培养。细胞系为贴壁生长,待生长融合度达80%时,用2.5%的胰蛋白酶消化传代,取对数生长期的细胞用于后续实验。取适量A2058细胞接种于6孔板中至融合率达70%~90%,将合成的PARP1及对照干涉片段经Lipofectamine 3000介导转入A2058细胞中,具体操作见脂质体试剂说明。
3.总RNA的抽提:采用Trizol试剂进行总RNA的抽提。每毫升Trizol中加入200μl的氯仿萃取,将无色上清液转移带一个新的离心管中,加入等体积的异丙醇沉淀并以12000r/min的速率离心10min,并用75%乙醇洗涤。弃上清液,室温干燥RNA沉淀,用DEPC处理过的水溶解沉淀,定量备用。
4.寡核苷酸芯片杂交:每样品取100~500ng总RNA,用以T7-Oligo(dT)Promoter引物反转录cDNA。以cDNA为模板,在T7 Enzyme Mix反应下,经体外转录合成生物素标记cRNA。以cRNA为模板,Random Primer为引物,在CbcScriptⅡ酶条件下进行反转录。以反转录的cDNA产物为模板,Random Primer为引物,用Klenow Fragment酶合成cDNA互补链并掺入带有荧光基团的dNTP。带有荧光基团的DNA与博奥晶典长链非编码 RNA 芯片杂交。杂交后芯片清洗染色,采用Agilent 芯片扫描仪(G2565CA)扫描信号。
5.RT-PCR检测:每样品取1μg总RNA,采用TaKaRa公司一步法反转录试剂盒反转录为cDNA备用。(1)PCR反应体系:正向引物及反向引物各1μl,SYBR 10μl,RNA模板2μl,去离子水6μl。振荡后,短暂离心。(2)反应条件:95℃预变性30s,(95℃ PCR反应5s,60℃退火延伸30s,72℃延伸30s)×40个循环。(3)lnc-TSPAN14-2:3上游引物:5′-TGCTGAGGCTCCAGAAGT-3′,下游引物:5′-ACCTAATGGGACCCTTTC-3′,lnc-KCNH5-1:1上游引物:5′-TACCAGAGCCATCGGGAGT-3′,下游引物:5′-AAACTGTGACACGAACGGGA-3′,GAS1RR:7上游引物:5′-TAGTGGTTGCTTTAGGGTTT-3′,下游引物:5′-AGGAGGTCATTAACACGC-3′,BANCR上游引物:5′-TTCCTTAGGGTCAGGGGTCT-3′,下游引物:5′-GATTGGGACCCTTTTCTGGT-3′。
6.统计学方法:利用SPSS 22.0统计学软件对数据进行统计分析,两组数据采用t检验,以P<0.05为差异有统计学意义。
结 果
1.PARP1干涉效率检测:将PARP1干涉片段或对照片段顺时转染A2058细胞,Western blot法及RT-PCR检测PARP1的干涉效率。结果可见PARP1干涉片段转染后48h可显著抑制A2058细胞内PARP1蛋白及mRNA表达水平(图1)。

图1 Western blot法及RT-PCR
检测PARP1干涉效率
A.Western blot法检测PARP1干涉后PARP1蛋白表达水平;B.RT-PCR检测PARP1干涉后PARP1 mRNA表达水平
2.芯片杂交结果:将PARP1干涉组及对照组A2058黑素瘤细胞提取总RNA进行lncRNA芯片杂交,PARP1干涉组与对照组比较,差异>2倍的lncRNA共123条,包括升高的55条及降低的68条(表1)。
3.RT-PCR验证差异性表达的lncRNA:笔者随机选取了3个表达差异明显的lncRNA进行RT-PCR验证。其lncRNA ID号分别TCONS_00018255、ENST00000554921.1及TCONS_00016044, 应用LNCipedia数据库获得其对应的转录本名称分别为:lnc-TSPAN14-2:3、lnc-KCNH5-1:1、GAS1RR:7。与对照组比较lnc-TSPAN14-2:3 在PARP1干涉细胞中表达上调,而lnc-KCNH5-1:1及GAS1RR:7 在PARP1干涉细胞中表达下调(图2)。该检测结果与芯片检测结果基本一致。说明芯片结果如实反映了PAPR1干涉后A2058细胞lncRNA表达的变化情况。
4.RT-PCR检测黑素瘤相关lncRNA的表达:在差异性表达的lncRNA中笔者发现存在已证实与黑素瘤恶性表型相关的lncRNA ID TCONS_00016342 即目前已知的lncRNA BANCR并对其进行RT-PCR验证。与对照组比较,PARP1干涉组可显著抑制BANCR表达(图3)。证实PARP1可促进黑素瘤相关lncRNA BANCR的表达。
讨 论
lncRNA是一群长度大于200bp的非编码RNA分子[11]。研究表明lncRNA具有保守的二级结构,并可通过染色质修饰、转录调控、RNA编辑、microRNA吸附、翻译调节等多种作用机制参与调控基因表达[12]。因此,lncRNA的表达或功能异常与肿瘤发病密切相关[13,14]。大量研究证实lncRNA的异常表达可促进黑素瘤的恶性转化。研究发现与原发黑素瘤相比,淋巴结转移灶中的黑素瘤高表达lncRNA HOTAIR[15]。进一步机制研究发现敲降HOTAIR表达可抑制黑素瘤细胞侵袭及转移能力[16]。最近的研究中发现MALAT1亦在黑素瘤组织中高表达并具有促进黑素瘤细胞侵袭的作用[17,18]。Flockhart等[19]研究发现lncRNA BANCR在黑素瘤组织中高表达并可促进黑素瘤细胞迁移。此外进一步的研究发现BANCR还可通过活化MAPK通路促进黑素瘤细胞的增殖及小鼠体内成瘤作用[20]。笔者的研究证实干涉PARP1水平可显著抑制黑素瘤细胞内BANCR的表达,说明PARP1可通过促进BANCR表达介导黑素瘤的恶性转化。此外,通过lncRNA芯片还筛选出大量由PARP1调控的lncRNA分子并通过RT-PCR对部分结果进行验证。结果证实PARP1可促进lnc-KCNH5-1:1及GAS1RR:7表达并抑制lnc-TSPAN14-2:3的表达水平。目前对于lnc-TSPAN14-2:3、lnc-KCNH5-1:1及GAS1RR:7的具体作用及其与肿瘤的关系还未见相关报道,对这些分子及其他由PARP1调控的lncRNA分子进行深入研究有望为黑素瘤的治疗提供新的靶点。
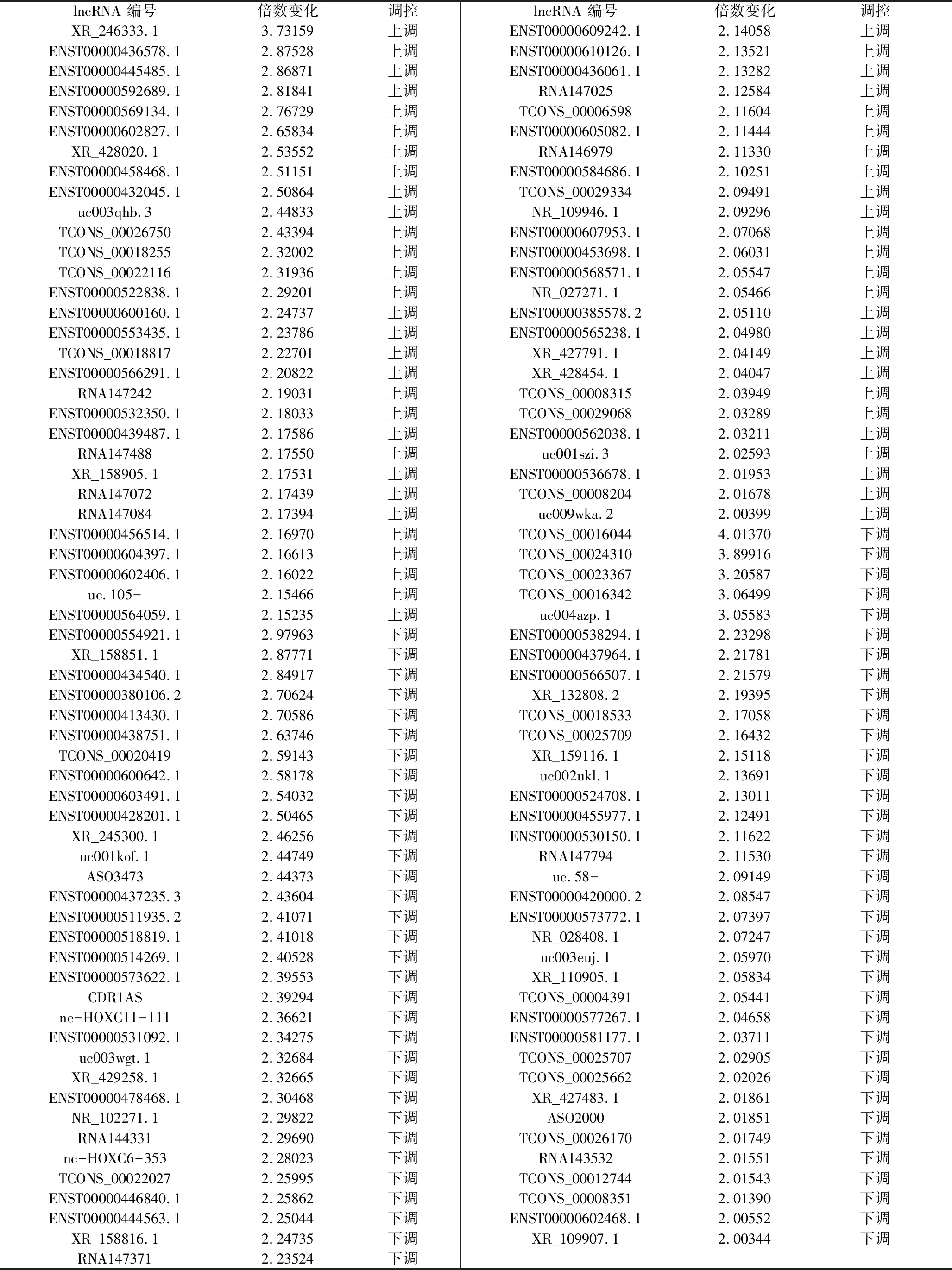
表1 PARP1调控的差异性表达lncRNA

图2 RT-PCR验证差异性表达lncRNA

图3 RT-PCR检测BANCR表达
与mRNA类似lncRNA的表达同样也受到转录机制的调控[21]。比如,DNA甲基转移酶(DNA methyltransferases,DNMT)可通过甲基化lncRNA MEG3的启动子区从而抑制MEG3的表达水平[22]。在低氧条件下,组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3)可使lncRNA LET分子启动子区H3及H4去乙酰化进一步抑制LET的表达水平[23]。此外,一些lncRNA的表达还受到转录因子的调控。研究发现lncRNA AK019103分子启动子区存在转录因子NF-κB结合位点,而抑制NF-κB活性也证实可抑制AK019103表达[24]。Dinger等发现从胚胎干细胞多潜能分化到细胞增殖等多种生物学活动中均存在转录因子包括p53、NF-κB、Sox2、Pou5f1等介导的lncRNA的表达。笔者研究发现PARP1可调控一系列lncRNA的表达水平,然而其具体机制尚不明确。鉴于PARP1具有催化核糖二磷酸腺苷(adenosine diphosphate ribose,ADPR)共价结合至自身或其他受体蛋白上形成多聚核糖二磷酸腺苷(poly ADP-ribose,PAR)的功能。研究发现PARP1可通过PAR基化修饰p53、NF-κB等转录因子及其他转录调控分子从而参与调控多种基因表达[25]。提示PARP1可能通过类似机制调控lncRNA的表达。综上所述,笔者研究发现在黑素瘤细胞中存在大量受PARP1调控的lncRNA分子,PARP1可能通过调控BANCR及其他lncRNA的表达参与介导黑素瘤的恶性转化。

