10-姜酚对ABL1影响的分子模拟及实验研究
张竞之,邓波,江小梨,张双伟,蔡敏,邓穗晖,陈瑞雪,刘彬
1.广州医科大学附属第二医院中医科,广东 广州 510260;2.广州医科大学中西结合研究所,广东 广州 510260
肝癌是我国最常见的消化系统肿瘤,发病率高、死亡率高,目前针对肝癌治疗的药物效果有限,探索新型有效的抗肝癌药物的研发具有重要意义[1]。10-姜酚(10-Gingerol,10-G)是生姜的主要成分之一。研究表明生姜中的姜酚类化合物具有抗肿瘤、抗炎、止呕、抗氧化、免疫调节等作用,姜酚类成分抗肿瘤作用及其机制一直是研究的热点[2]。原癌基因酪氨酸激酶ABL1(Protooncogene tyrosine-protein kinase ABL1,ABL1)属于非受体苏氨酸蛋白激酶家族,是调控肿瘤的血管生成、发展以及转移的关键蛋白,在多种肿瘤的发生、发展中发挥着重要作用,包括有慢性粒细胞白血病、乳腺癌、胃癌、肝癌等[3]。本研究将采用分子对接、分子动力学模拟技术以及细胞实验研究10-G对ABL1蛋白激活的影响。
1 材料和方法
1.1 主要材料
中药对照品10-姜酚购自成都曼思特生物科技有限公司(纯度>99.04%,货号:MUST-17033004,批号:23513-15-7)。胎牛血清购自BI公司。DMEM培养基、胰蛋白酶购自Gibco公司。BCA蛋白定量试剂盒、ECL显影剂购自美国Thermo公司。抗p-ABL1、ABL-1抗体购自美国Affinity公司,抗GAPDH抗体购自美国CST公司。
1.2 细胞培养
人肝癌细胞株HepG2购自中国科学院细胞库。用含10%胎牛血清、青霉素(100 U/mL)、链霉素(100 mg/mL)的DMEM培养基培养,在37℃,5%CO2以及饱和湿度条件下的细胞培养箱中培养。倒置显微镜下观察细胞生长状态,细胞生长呈80%-90%融合状态时,以0.25%胰蛋白酶消化传代,隔日换液,每2~3 d传代一次。
1.3 分子对接与分子动力学模拟
使用AutoDock软件分析10-G与ABL1之间的关系。从PDB数据库获得ABL1(PDB ID:2HZI)的空间结构。从ZINC数据库取得10-G(ZINC ID:ZINC43009609)的3D分子结构。采用分子对接软件Autodock VINA进行分子对接模拟。用ABL1与已知的ABL1抑制剂PD180970的结合位点预测10-G与ABL1之间的关系。将10-G与ABL1进行分子对接,采用结合力评估结合能力的大小。采用Pymol 2.7软件进行3D作图。采用YASARA进行分子动力学模拟,将ABL1与10-G之间的最佳构象作为初始构象。在AMBER03力场中进行模拟。将蛋白结构置于立方体中,立方体边缘与蛋白质最小距离为5 Å,以0.9%的NaCl作为溶剂。在分子动力学模拟之前,对每个体系进行能量最小化,采用2 000步的最小化法和2 000步的共轭梯度法。然后利用Berendsen热浴控制每个分子的温度。最后,进行100 ns,步长为2 fs的分子动力学模拟。
1.4 Wesltern Blot检测
Western blot法检测相关蛋白的表达。60 mm培养皿培养细胞,PBS漂洗后收集细胞,RIPA裂解液裂解,提取总蛋白用BCA蛋白定量试剂盒定量,加入上样缓冲液,10%SDS-PAGE电泳,转膜,脱脂奶粉封闭1 h,加入一抗4℃孵育过夜,1×TBST液洗涤3次,每次7分钟,加入二抗,37℃孵育1h,1×TBST液洗涤3次,每次7分钟。ECL化学发光试剂盒显色,胶片曝光。
1.5 统计学处理
采用SPSS 19.0统计软件进行分析,实验数据采用均数±标准差(Mean±SD),重复测量数据比较采用重复测量方差分析(Repeated measures data of ANOVA),多组比较采用单因素方差(One-Way ANOVA),若方差齐性,各组间多重比较采用LSD法(Least-significant difference test),若方差不齐时,采用Welch稳健估计,再采用Dunnett's T3方法两两比较。P<0.05被认为差异具有统计学意义。
2 结果
2.1 10-G与ABL1的分子对接
采用分子对接方法评价ABL1与10-G之间的关系。ABL1与10-G的结合力为-7.96 kcal/mol。ABL1与10-G的结合构象见图1,10-G与ABL1的氨基酸残基GLU-305形成氢键连接,氢键的长度为2.1 Å。
2.2 10-G与ABL1复合物的分子动力学模拟
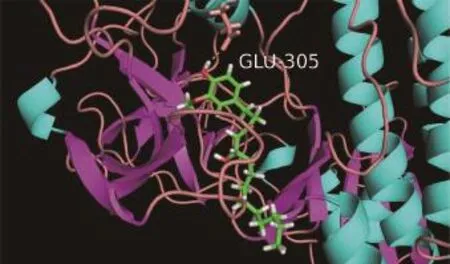
图1 10-G与ABL1分子对接模拟Figure 1 Molecular docking simulation investigated the interaction between 10-G and ABL1
我们进一步采用分子动力学技术探索ABL1与10-G结合的稳定性。ABL1-10-G复合物的表面模拟模型见图2A-B,图2A为0ns时的结合构象,图2B为第100 ns的结合模型。经过100 ns的分子动力学模拟,10-G仍位于ABL1的抑制剂结合位点。图2C展示了重原子均方根偏差(Root-meansquare deviation,RMSD)的变化轨迹。ABL1-10-G复合物的RMSD围绕2 Å波动,非结合状态ABL1在前60 ns上升至4.5 Å后,逐渐降低并波动在3.9 Å。图2D展示了非结合状态ABL1以及ABL1-10-G复合物势能的变化轨迹,ABL1-10-G复合物的势能高于非结合状态的ABL1。
2.3 10-姜酚抑制肝癌细胞ABL1磷酸化水平
我们将10-G(10、20、30μM)处理肝癌HepG2细胞24小时后,Western blot检测p-ABL1、ABL1、GAPDH的表达。结果见图3,低、中、高的10-G显著降低肝癌细胞p-ABL1的表达,与对照组比较差异有统计学意义(P均<0.001)。
3 讨论

图2 ABL1-10-G复合物的分子动力学模拟Figure 2 Molecular dynamics simulation of ABL1-10-G complex
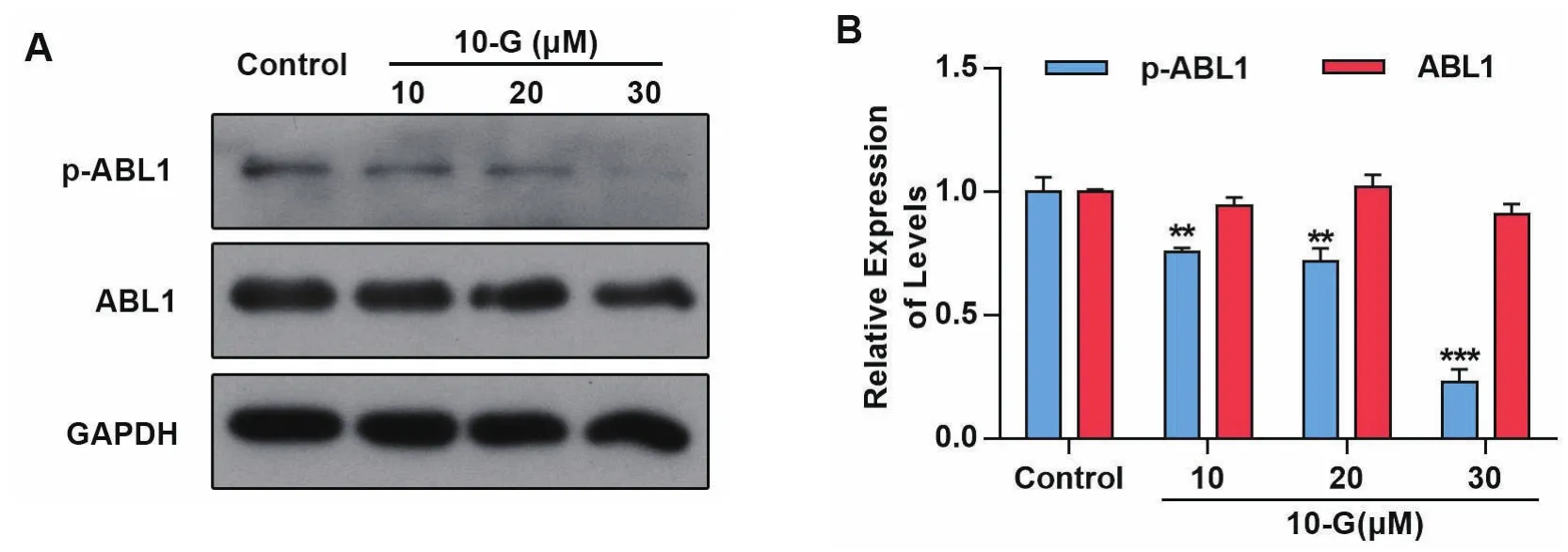
图3 10-G抑制HepG2细胞中ABL1的激活Figure 3 10-G inhibited the activation of ABL1
10-G属于姜酚类化合物,现代药物药理学研究发现,姜酚具有抗肿瘤、降血糖、抗氧化、抗炎等作用[4]。本课题组前期研究发现10-G具有抗黑色素瘤的作用[5]。此外,还有研究发现10-G能抑制肝癌HepG2细胞的增殖[6],诱导乳腺癌MDAMB-231细胞[7]以及结肠癌HCT116细胞[8]的凋亡。然而,10-G抗肿瘤的机制尚不完全清楚,本研究对10-G的抗肿瘤机理进行探索。
ABL1是一种非受体酪氨酸激酶,存在于细胞质及细胞核中,具有调节肿瘤生长、转移及血管新生的作用[9]。研究发现ABL1能调控有丝分裂激酶调节器PLK1的磷酸化,从而抑制PLK1的泛素化与降解,进而调控肿瘤的增殖[10]。有研究发现,ABL1具有调控PDGF诱导的肿瘤的迁移的作用,其机制可能于调控αvβ3整合素有关[11]。此外,还有研究发现ABL1能介导碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的肿瘤血管新生[12]。因此,ABL1是肿瘤研究的重要靶点之一,针对ABL1抑制剂具有良好的开发前景。
近年来,分子对接及分子动力学模拟技术广泛应用于药物研发及筛选中,可以显著的提高药物开发的精准度和效率。本研究通过分子对接技术预测10-G与ABL1进行对接来预测复合物模型,分析表明10-G与ABL1之间具有较强的结合活性。我们还进一步采用了分子动力学技术对10-G与ABL1结合的稳定性进行评价,结果显示10-G与ABL1的结合是稳定的。为了进一步验证10-G与ABL1之间的关系,我们观察了10-G对肝癌HepG2细胞ABL1激活的影响。结果显示,10-G能显著抑制ABL1的激活。此外,ABL1已被证实在白血病、乳腺癌、结肠癌中起了重要作用[9]。这提示10-G可能具有防治这些肿瘤的潜力。
在本研究中,我们发现10-G可能是一个潜在ABL1抑制剂,其抗肿瘤作用与抑制ABL1密切相关。本次研究结果提示抑制ABL1可能是10-G及姜酚抗肝癌的新靶点。

