Bobath疗法联合Vojta疗法在小儿脑损伤综合征早期康复中的应用
鲁欣
脑损伤综合征(BDS)是出生前至出生后1个月内各类因素导致非进行性脑损伤及并发中枢神经系统症状的一组综合征[1],由于未明确达到脑瘫诊断标准,通常被定义为中枢神经系统损害的高危儿过渡性诊断结论,可避免漏诊与过度诊断[2],有助于避免病情进展,把握治疗时机。随着婴幼儿保健医学的蓬勃发展,早期体检与筛查令BDS确诊已不再困难,且临床多推荐借助该阶段小儿神经系统极强可塑性与可修复性[3],及时开展康复治疗以期改善其预后。目前神经发育疗法仍是儿童康复科的最核心的治疗举措,其中Bobath疗法在脑损伤早期干预中应用尤为广泛,能促通运动感觉功能,重建正确行为模式与肢体协调性,但出于疗法限制,单独应用可存在一定的局限性,近年来也发现其结合运用神经营养药物、中医针刺等治疗措施可获得更大收益[4-5]。本研究旨在将Bobath疗法联合以新型诱导模式著称的Vojta疗法治疗小儿BDS,现将取得成果报告如下。
1 资料与方法
1.1 一般资料 选取2016年10月至2018年9月于我院接受康复治疗的126例BDS患儿为研究对象,按照随机数表分为观察组与对照组各63例。纳入标准:①临床表现、脑电图及头颅影像学检查结果均符合BDS相关诊断标准[6]。②月龄为1~6个月。③分组经医院伦理委员会批准,家长自愿签署知情同意书。排除标准:①明确诊断为脑部发育畸形、癫痫或先天性、遗传性、代谢性疾病而引发神经功能异常。②体表存在皮损或感染。③合并中、重度营养不良。④伴有急慢性传染病。⑤治疗时间<3个月。观察组男37例,女26例;平均月龄(6.26±1.49)个月;胎龄为34~41 周,平均胎龄(37.16±2.51)周;平均出生体质量为(2.82±0.63)kg;缺血缺氧性脑损伤37例、围生期感染性脑损伤20例、产伤性脑损伤6例。对照组男39例,女24例;平均月龄(6.38±1.45)个月;胎龄为34~41周,平均胎龄(36.94±2.35)周;平均出生体质量为(2.88±0.61)kg;缺血缺氧性脑损伤39例、围生期感染性脑损伤19例、产伤性脑损伤5例。两组患儿一般临床资料差异无统计学意义(均P>0.05),后续指标观察具有可比性。
1.2 方法 两组患儿均实施Bobath疗法,以抑制异常运动模式、促进正常运动模式为主要原则,控制运动关键点的内容涵盖头颈部协调(包括颈直立反射、俯仰卧抬头、肘支撑抬头/转头等)、上半身协调(包括肘/手支撑、俯仰卧位转换)、坐位训练(包括直立坐位、撑手坐位、独自坐位等)、爬跪训练(包括四爬训练、四点跪位、姿势转换等)内容,2 h/次,2次/d,6 d/周,持续治疗3个月后观察疗效。观察组在上述基础上予以Vojta疗法,以特定诱发区域压迫刺激为主要治疗原则,进行如下康复训练:①反射性腹爬。患儿取俯卧位,头颈线在躯干中线延长线30°~45°范围回旋屈曲,保持颈部肌肉伸展及左右肩胛、盆骨水平;颜面侧上肢外展使肩关节呈135°,肘关节屈曲至40°,上肢置于面部前方,并使腕部位于肩部延长线上;后头侧肩部内旋,手半握拳;双下肢髋、膝轻度屈曲外展,跟骨位于脊柱平行的坐骨延长线;主导诱发将侧肱骨内侧髁推向同侧肩胛骨,使桡骨末端与上肢外展、向前移动对抗,股骨头向髋臼方向压迫,跟骨在足背屈与跖屈中间位由后上方向床面压迫;辅助诱发将肩胛骨内侧缘下角向同侧肘关节方向压迫,肩峰向背侧压迫,使髂前上棘向背侧压迫,臀中肌向膝方向压迫,令下颌与后头部向头部活动对抗方向施力。②反射性翻身。患儿取仰卧位,头部向一侧回旋90°,颈部肌肉伸张,额面部略微前屈;颜面侧上肢与下肢伸展,后头侧上肢与下肢屈曲,保持非对称性紧张性颈反射肢位;主导诱发将乳头下二横指第6~7、第7~8肋间向外推移,拇指位于由腹部下方,向对侧肩峰方向压迫;辅助诱发将对侧肩峰、下颌骨、后头部及对侧肩胛骨下角向相反方向压迫;该疗法持续0.5 h/次,2次/d,6 d/周,于Bobath疗法完成后患儿休息30~60 min进行,持续治疗3个月后观察疗效。
1.3 观察指标 于治疗前及治疗3个月后,根据粗大运动功能测试(GMFM)评估患儿运动功能[7],原量表通过对仰卧与翻身(17个条目)、坐位(20个条目)、爬和跪(14个条目)、站立位(13个条目)、行走/跑/跳(24个条目)5个维度共88个条目进行评价,每项评分标准0分:不能完成行为;1分:仅有始动行为,动作完整度<10%;2分:部分完成行为,动作完整度为10%~90%;3分:基本顺利完成行为,动作完整度为>90%。受本研究对象月龄限制,需去除站立位及行走/跑/跳维度评估,分数越高表示该维度运动功能越强。参考Gesell发育量表(GDS)评估患儿发育情况[8],分别根据与月龄对应的大运动、适应性、精细动作、语言、个人-社交发育状态评分标准给予评价,每个维度评分转化为百分制,以76~85分为发育障碍临界范围,56~75分为轻度发育障碍,36~55分为中度发育障碍,21~35分为重度发育障碍,≤20分为极度发育障碍。采用飞利浦IU22彩色多普勒超声诊断仪,探头频率为5.5~7.5 MHz,经前囟与侧囟做颅脑冠状面、矢状面与横切面扫查,转为脉冲多普勒血流显像模式,获取大脑中动脉(MCA)平均血流速度(Vm)、搏动指数(PI)、阻力指数(RI)等参数。于治疗后3个月时,参照改良Ashworth肌张力量表(MAS)评估患儿肌张力[9],0级:未见肌张力异常增加;1级:肌张力轻微增加,抓握被动屈伸末期存在较小阻力;1+级:肌张力轻微增加,抓握被动屈伸中期,活动度(ROM)过半时有轻微阻力增加;2级:肌张力在多数ROM中存在阻力增加,但肢体被动活动仍然可行;3级:肌张力明显增加,被动活动较为困难;4级:被动活动基本丢失,受累肢体强直性屈曲或伸直。
1.4 统计学方法 所得数据资料均在统计学软件SPSS 20.0中进行分析,分类变量以例数、百分率表示,无序分类变量组间比较采用Pearson卡方检验,有序分类变量组间比较采用Mann-Whitney秩和检验;连续变量先实施Shapiro-Wilk正态性检验,均确认近似服从正态分布后,以()表示,组间同期比较采用独立样本t检验,组内不同时间比较采用配对样本t检验;双侧检验水准α=0.05,故以P<0.05提示为检验结果差异有统计学意义。
2 结果
2.1 两组患儿治疗前后GMFM评分结果比较(表1)治疗3个月后,两组患儿GMFM各项评分均较治疗前有显著提升,且观察组明显高于同期对照组(均P<0.05)。
2.2 两组患儿治疗前后GDS评分结果比较(表2)治疗3个月后,两组患儿GDS各项评分均较治疗前有显著提升,且观察组明显高于同期对照组(均P<0.05)。
表1 两组患儿治疗前后GMFM评分结果比较() 单位:分

表1 两组患儿治疗前后GMFM评分结果比较() 单位:分
注:与本组治疗前比较,aP<0.05
量表维度 时间 观察组(n=63) 对照组(n=63) t值 P值仰卧与翻身 治疗前 24.75±8.61 25.26±8.36 0.337 0.736治疗3个月 43.26±11.20a 37.36±10.94a 2.991 0.003坐位 治疗前 28.71±9.14 27.05±8.86 1.035 0.303治疗3个月 42.10±12.52a 36.95±13.27a 2.241 0.027爬和跪 治疗前 20.53±6.46 19.47±6.34 0.930 0.354治疗3个月 29.62±8.15a 25.15±7.21a 3.261 0.001
表2 两组患儿治疗前后GDS 评分结果比较() 单位:分
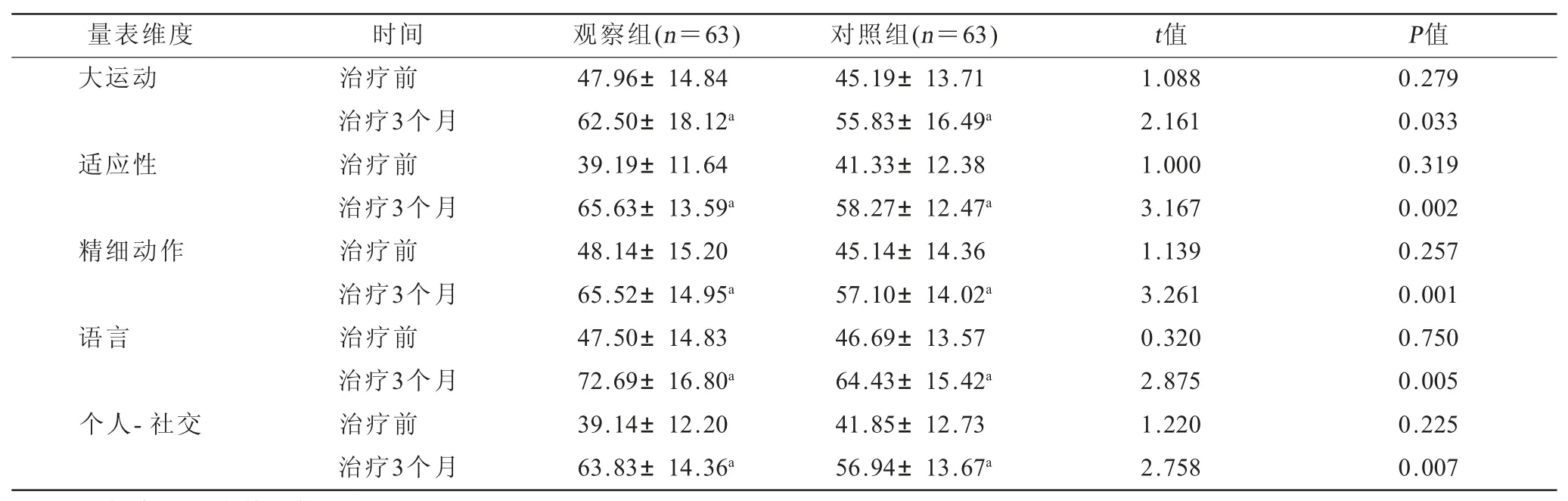
表2 两组患儿治疗前后GDS 评分结果比较() 单位:分
注:与本组治疗前比较,aP<0.05
量表维度 时间 观察组(n=63) 对照组(n=63) t值 P值大运动 治疗前 47.96±14.84 45.19±13.71 1.088 0.279治疗3个月 62.50±18.12a 55.83±16.49a 2.161 0.033适应性 治疗前 39.19±11.64 41.33±12.38 1.000 0.319治疗3个月 65.63±13.59a 58.27±12.47a 3.167 0.002精细动作 治疗前 48.14±15.20 45.14±14.36 1.139 0.257治疗3个月 65.52±14.95a 57.10±14.02a 3.261 0.001语言 治疗前 47.50±14.83 46.69±13.57 0.320 0.750治疗3个月 72.69±16.80a 64.43±15.42a 2.875 0.005个人-社交 治疗前 39.14±12.20 41.85±12.73 1.220 0.225治疗3个月 63.83±14.36a 56.94±13.67a 2.758 0.007
2.3 两组患儿治疗前后MCA Vm、PI、RI水平比较(表3) 治疗3个月后,两组患儿MCA Vm水平均较治疗前有显著提升,且观察组明显高于同期对照组(均P<0.05);两组患儿MCA PI、RI水平均较治疗前有显著下降,且观察组明显低于同期对照组(均P<0.05)。
2.4 两组患儿治疗后MAS评级结果比较(表4)治疗3个月后,观察组患儿肌张力MAS评级明显低于对照组,差异有高度统计学意义(Z=4.313,P<0.001)。
表3 两组患儿治疗前后MCA Vm、PI、RI水平比较()
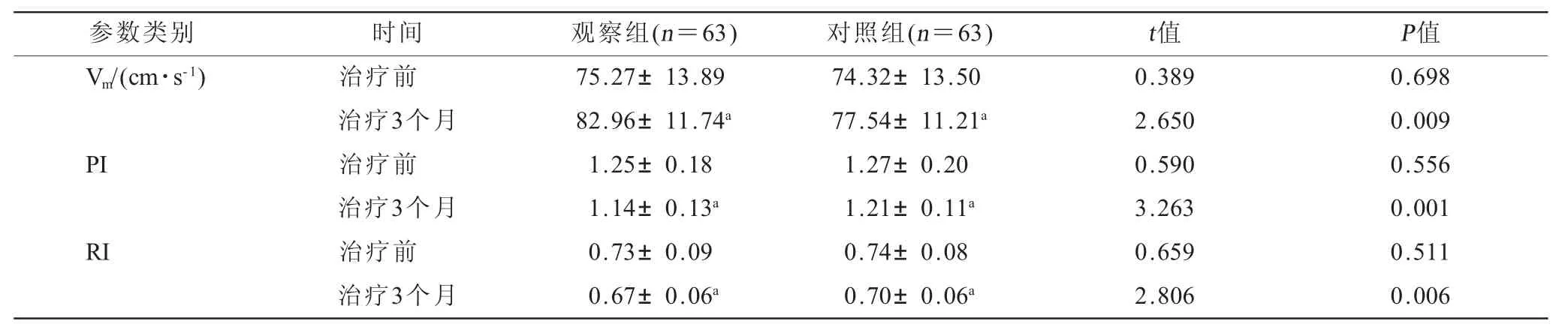
表3 两组患儿治疗前后MCA Vm、PI、RI水平比较()
注:与本组治疗前比较,aP<0.05
参数类别 时间 观察组(n=63) 对照组(n=63) t值 P值Vm/(cm·s-1) 治疗前 75.27±13.89 74.32±13.50 0.389 0.698治疗3个月 82.96±11.74a 77.54±11.21a 2.650 0.009 PI 治疗前 1.25±0.18 1.27±0.20 0.590 0.556治疗3个月 1.14±0.13a 1.21±0.11a 3.263 0.001 RI 治疗前 0.73±0.09 0.74±0.08 0.659 0.511治疗3个月 0.67±0.06a 0.70±0.06a 2.806 0.006

表4 两组患儿治疗后MAS 评级结果比较[n(%)]
3 讨论
BDS多由宫内窘迫与产程过长等缺血缺氧因素、母体病原体垂直传播、助产士手卫生不良等围生期感染因素、难产与产钳助产等产伤因素所引起[10],致病原因较为复杂,临床预防工作开展相对困难。由于BDS患儿表现出癫痫发作、视听功能损害、行为异常等严重中枢神经损伤症状[11],且有进一步发展为脑瘫的潜力,可对其预后生长发育造成极其恶劣影响,为家庭及社会带来沉重负担。据相关文献报道,由于早期受损神经元并未完全凋亡,且已凋亡中枢神经细胞突触仍具有再生能力[12],异常姿势尚未固定成为习惯,介入时间越早,可利用的神经系统代偿性越强,因此理论上排除极个别严重患儿,多数脑损伤患儿均可通过早期康复治疗获得临床治愈与正常化发育。本研究结果显示,两组治疗后运动功能与MCA血流动力学参数均获得显著改善,其中观察组改善效果明显更佳,这表明与Vojta疗法联合后,Bobath疗法改善BDS患儿临床症状效果得以增强,BDS患儿粗大运动功能与神经细胞代谢能力均获益颇多,初步猜测认为,Vojta疗法可通过患儿在特定姿势下施加压迫,诱导该部位及全身产生协调化运动模式,因此疗程内持续不断刺激下,间接代偿性促进树突芽生与轴突阈值改变,进而重新形成功能性细胞集合网络系统,恢复其能量代谢并减低局部组织坏死风险,真正实现中枢神经系统功能重组,故对皮质职能正常行使与神经电信号远处传导有重要意义。有专家提出,Vojta疗法只能对运动功能进行改善,而无法对存在语言障碍、智力障碍患儿产生干预性影响,因此尤其适宜于月龄较小婴儿的康复治疗策略,而月龄较大患儿的治疗效果仍有待进一步验证[13]。
Vojta 疗法得名于德国小儿神经科学学者Vaclav Vojta博士,主要根据神经支配原理,通过诱发带刺激,与诱发运动给予抵抗刺激,反馈调节重新建立,对运动与姿势异常产生强效纠正作用[14]。本研究体会该疗法操作手法相对简单、因地制宜且经济适用,无特殊设备与环境要求,在治疗过程可对家长进行培训,便于家庭康复工作的开展。有关研究表明,移动运动作为周期性、协调性的运动机能,通常由多组骨骼肌参与其中并发挥时间与工件交互作用,以保障运动正常完成,Vojta疗法借以诱发反射性腹爬与反射性翻身两种移动运动,由姿势变化对全身反应性适应能力产生正性作用,因行为不具备目的性,可无视顺应性,对固有感受器产生深层刺激[15],恢复运动学基础构成,改善运动行为与姿势发育。本研究中,两组经过治疗后发育情况均获得明显优化,且观察组优化幅度较大,而肌张力水平更低,提示Vojta疗法能通过不断诱发反射性移动运动,促进肌肉感受器活性增强,肌张力有所降低,异常姿势得以缓解,且运动神经在多次训练下形成正常信号通路,有助于大脑皮层统辖支配,以协调肢体各部位感觉与运动功能,BDS患儿可回归正常发育进程。张敏等[16]认为,反射性腹爬与反射性翻身疗法并非以腹爬、翻身为治疗目标,但却是由婴儿自出生到学会步行必须掌握协调中轴器官及四肢的正确运动模式,因此尽早把握始动结构、支持性、相运动能的移动运动三要素,形成围绕支撑点的垂直、前方、侧方的三维运动体系,可较大程度逆转脑损伤所带来的发育障碍。
综上所述,Vojta疗法能有效改善BDS患儿运动功能、发育情况、MCA血流动力学参数及肌张力水平,对其心身健康可产生积极影响。

