人神经干细胞源施万样细胞微囊泡促进大鼠神经元轴突生长
叶开,余佳红,陈天琰,高建一,张磊,胡嘉波
(江苏大学医学院,江苏镇江212013)
在周围神经系统损伤中,神经元不可再生,轴突再生是神经功能恢复的基础过程[1]。施万细胞是周围神经系统中的神经胶质细胞,沿着神经元轴突分布,参与周围神经系统中神经纤维的构成,分泌多种神经营养因子以维持受损的神经元存活并促进轴突生长而达到外周神经再生的目的[2]。微囊泡是来源于亲本细胞的微小膜性细胞器,其在细胞之间转移胞质内容物,包括蛋白质、脂质和RNA等[3]。生长相关蛋白 43(growth associated protein 43,GAP43)是神经元发育和轴突再生过程中的一种重要蛋白质,参与神经突向外生长和神经元生长,对突起发育形成起重要调控作用[4]。施万细胞微囊泡可能对神经再生,尤其是对轴突再生[5]具有重要意义,但临床上人神经干细胞源施万样细胞(以下简称施万样细胞)来源受限[6],且对轴突的再生作用尚不清楚。因此,本研究从SD大鼠乳鼠提取背根神经节(dorsal root ganglion,DRG),试用施万样细胞分泌的微囊泡刺激DRG神经元及神经元样N2a细胞株,观察施万样细胞微囊泡对神经轴突生长及GAP43 mRNA的影响。
1 材料与方法
1.1 材料
SPF级SD雄性大鼠1只,出生4~5 d,由江苏大学动物实验中心提供,合格证号:201822045。N2a细胞系购于中国科学院干细胞库;人源神经干细胞由课题组先前实验所得[7]。
DMEM(美国Gibco公司);DRG神经元培养基:Neurohasal培养基+2%B27添加剂(美国Gibco公司)+100μg/L神经营养因子+2 mmol/L L-谷氨酰胺(美国Sigma公司);抗有丝分裂DRG神经元培养基:DRG神经元培养基+10μmol·L-1阿糖胞苷(上海源叶公司);施万样细胞诱导培养基:DMEM/F12+10%无微囊泡胎牛血清(4℃行100 000×g离心12 h获得,美国Gibco公司)+5μg/L血小板衍生因子-BB+10μg/L重组人碱性成纤维细胞生长因子+200μg/LHeregulin-1β(HRG-1β)+5μmol/L弗斯可林(美国 PeproTech公司);基质胶(美国Coring公司);Ⅰ型胶原酶(上海源叶公司);35μg/L全反式维甲酸、神经营养因子、胰酶、乙二胺四乙酸、细胞膜染剂PKH67试剂盒、牛血清白蛋白、曲拉通100(美国 Sigma公司);S100β一抗(1∶50)、DAPI(武汉博士德公司);βⅢ-微管蛋白一抗(1∶300,镇江爱必梦生物技术公司);BCA试剂盒(上海碧云天生物技术公司);Cy3TM-荧光二抗(1∶500,美国Jackson ImmunoResearch公司);过碘酸-雪夫染色试剂盒(上海太阳生物技术有限公司);cDNA合成试剂盒(北京全式金生物公司);荧光定量PCR试剂盒、荧光定量PCR仪(美国Bio-Rad公司);多维全景流式细胞仪(Flow Sight,美国 Merck Millipore公司);倒置荧光显微镜(日本Olympus公司);纳米颗粒跟踪分析仪(英国NanoSight公司)。
1.2 施万样细胞免疫荧光染色和N2a细胞培养
施万样细胞由人源神经干细胞诱导分化而来,参考Zheng等[8]方法。将人源神经干细胞培养于施万样细胞诱导培养基,37℃、5%CO2条件下诱导分化2周,获得施万样细胞;行S100β免疫荧光染色:4%低聚甲醛固定细胞20 min;于37℃用2%牛血清白蛋白和0.1%曲拉通100透化封闭1 h;加入抗S100β,4℃孵育过夜;弃一抗,避光加入Cy3TM_荧光二抗,37℃温育2 h;弃二抗,PBS冲洗3遍;加入DAPI常温放置10min;甘油封片;用倒置荧光显微镜捕获图。
DMEM+10%胎牛血清培养基中维持N2a细胞状态。
1.3 DRG神经元原代培养及纯化
参考文献[9]实验方法,如图1所示,从SD大鼠乳鼠脊髓与坐骨神经交界的膨大处摘取DRG,转移至离心管,4℃900 r/min离心5 min;弃上清液,加入3 g/LⅠ型胶原酶2 mL,37℃孵育30 min;4℃900 r/min离心5 min;弃上清液,加入0.25%胰酶+乙二胺四乙酸2 mL,37℃孵育20 min;加入数滴胎牛血清终止消化,4℃ 900 r/min离心5 min;取沉淀,接种于预先已包被基质胶的培养皿,加入抗有丝分裂DRG神经元培养基纯化48 h;更换为DRG神经元培养基,每3 d换液1次,倒置显微镜下观察细胞形态。
图1 DRG原位观察
1.4 微囊泡的分离及其纳米颗粒跟踪分析
参考Ji等[10]方法,将施万样细胞的条件培养基于4℃行2 000×g离心20 min,以除去细胞碎片和杂质;然后,4℃行100 000×g离心70 min;弃上清液,用PBS洗涤沉淀;以相同方式进行第2次超离心并重复2次;弃上清液,加入100μL PBS重悬沉淀。BCA法检测施万样细胞微囊泡的蛋白质含量(浓度为1 mg·mL-1)。将微囊泡注入仪器样品室并通过纳米颗粒跟踪分析软件分析(Version 2.3 Build 0006 BETA2)。
1.5 DRG神经元βⅢ-微管蛋白检测
取“1.3”中DRG神经元,分2组,PBS组:加40μL PBS,用DRG神经元培养基补至2 mL;微囊泡组:加1 mg·mL-1施万样细胞微囊泡40μL,用DRG神经元培养基补至2 mL(终浓度:20μg/mL);37℃、5%CO2条件下培养36 h;行βⅢ-微管蛋白免疫荧光染色(方法同“1.2”),倒置显微镜下获取图像,Image J 1.48软件计算轴突长度。
1.6 荧光定量PCR检测N2a细胞GAP43 mRNA表达水平
计数1×105个N2a细胞,接种于6孔板,撤离血清饥饿12 h;分别加入1 mg/mL施万样细胞微囊泡 0、10、40、80μL,用 Neurohasal培养基+20 ng/L神经营养因子补齐至2 mL(终浓度为0、5、20、40 mg/L),每组设3个复孔,刺激19 h;按照RNA提取步骤提取N2a细胞RNA,DNA酶处理后以25℃5 min,42℃30 min,85℃5 min反转录合成cDNA。取2μL cDNA以20μL体系进行扩增,反应条件为95℃初始酶活化2 min,95℃变性15 s,58℃退火15 s,72℃延伸30 s,共40个扩增循环。以GAPDH为内参基因,计算每个样品的2-△△Ct,获得相对表达强度,每次实验取3次平均值。相关特异性引物见表1。
表1 寡核苷酸引物序列
1.7 施万样细胞微囊泡PKH67标记和检测
将20μL施万样细胞微囊泡与PKH67染料按试剂说明书溶于1 000μL PBS,37℃温育30 min;加1%牛血清白蛋白溶液终止反应,4℃行10 000×g离心70 min;弃上清液,PBS清洗2~3遍。PKH67标记的施万样细胞微囊泡与N2a细胞孵育48 h;PBS洗涤3遍,流式细胞仪检测N2a细胞内荧光表达情况。
1.8 N2a细胞过碘酸-雪夫染色
计数1×105个N2a细胞,接种于6孔板,撤离血清饥饿12 h;分别加入1 mg/mL施万样细胞微囊泡0、40、80μL,用Neurohasal培养基+20 ng/L神经营养因子补齐至 2 mL(终浓度为0、20、40 mg/L),每组设3个复孔,刺激48 h;行过碘酸-雪夫染色:固定液固定10min;PBS冲洗3遍;滴加试剂A(过碘酸溶液)覆盖培养皿底部即可、避光室温放置5~8 min;PBS冲洗3遍;滴加等量试剂B(品红醛),避光室温放置10~20 min;PBS冲洗3遍;滴加等量试剂 C(苏木素染色液),染色1~2 min;滴加等量试剂D(酸性乙醇分化液)2~3 s;PBS冲洗3遍,直至液体颜色变浅;75%乙醇脱色至无色。倒置显微镜下观察细胞染色及形态,并获取图像,Image J 1.48软件计算N2a细胞突起长度。突起增长率:(刺激后细胞突起长度-刺激前细胞突起长度)/刺激前细胞突起长度×100%;细胞阳性率:阳性细胞数/细胞总数×100%(每组计数50个细胞)。
1.9 统计学分析
实验数据应用SPSS 17.0软件统计分析,计量资料用均数±标准差(±s)表示,两组数据比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 施万样细胞形态及DRG神经元的生长
倒置显微镜下观察显示,施万样细胞呈现典型两极或三极梭状,S100β免疫荧光染色呈阳性;DRG神经元12 h内贴壁,用DRG神经元培养基培养3 d后,可见大量轴突从神经元团块中延伸出,见图2。
图2 施万样细胞S100β染色和DRG神经元生长状态(×40)
2.2 微囊泡的形态及粒径分析
在纳米颗粒跟踪分析系统下,施万样细胞微囊泡的形态为不同大小的粒子,其直径分布为50~1 000 nm范围内,其中以100~300 nm居多,见图3。
2.3 微囊泡促进DRG神经元βⅢ-微管蛋白表达
免疫荧光染色结果表明,DRG神经元轴突的βⅢ-微管蛋白表达阳性,与PBS组比较,施万样细胞微囊泡作用后的DRG神经元新生轴突长度明显增加(t=9.794,P<0.05)。见图4。
2.4 微囊泡上调N2a细胞GAP43表达
与0 mg/L组相比,5 mg/L组GAP43 mRNA差异无统计学意义(q=0.700 3,P>0.05),20 mg/L组及40 mg/L组GAP43 mRNA表达明显增加(q=5.374,16.820,P均<0.05),且呈一定的浓度依赖效应。见图5。
图3 施万样细胞微囊泡的形态及粒径分析

图4 DRG神经元βⅢ-微管蛋白免疫荧光染色(×40)
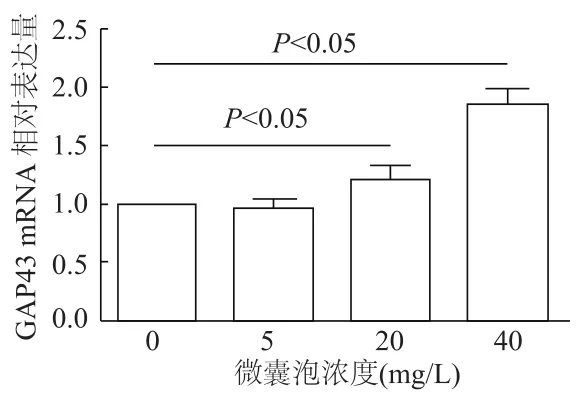
图5 qRT-PCR检测各组N2a细胞GAP43 mRNA的表达
2.5 N2a细胞吞噬微囊泡
PKH67标记的施万样细胞微囊泡与N2a细胞孵育后,在N2a细胞胞体中可见PKH67绿色荧光。见图6。

图6 流式细胞仪检测N2a细胞内荧光
2.6 微囊泡促进N2a细胞突起生长及糖原生成
与0 mg/L组相比,20、40 mg/L组 N2a细胞突起增长率均明显增加(q=5.229,17.580,P均<0.05),其过碘酸-雪夫染色后的阳性细胞也随之明显增多(q=5.666,20.10,P均<0.05)。见图7和图8。
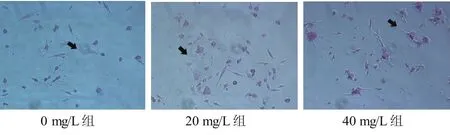
图7 各组N2a细胞过碘酸-雪夫染色(×200)
3 讨论
大量证据表明,神经胶质细胞通过不同的细胞间通讯机制支持轴突再生,除了细胞间信号传导的经典机制外,通过细胞外微囊泡的细胞间通讯已成为一种新的形式[11]。人神经干细胞的微囊泡对坐骨神经的修复有促进作用。施万细胞是外周神经系统中主要的神经胶质细胞,与神经元生长发育紧密联系[12]。本实验表明,人神经干细胞源施万细胞通过分泌微囊泡对神经的再生,尤其是神经元轴突的再生有促进作用。
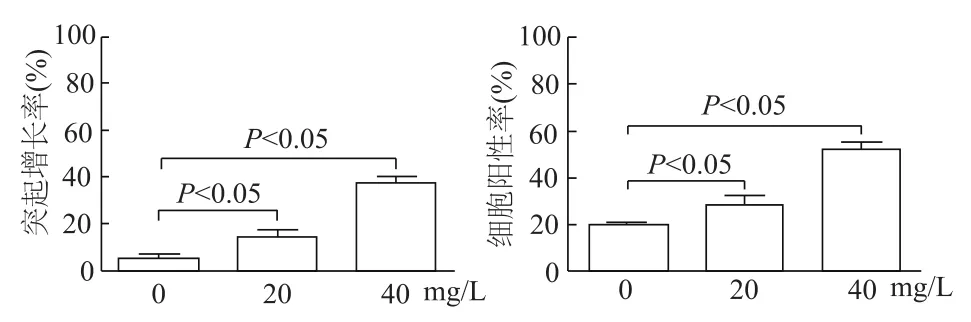
图8 各组N2a细胞突起增长率和过碘酸-雪夫染色细胞阳性率比较
我们的前期实验参考Zheng等[8]方法已成功获取施万样细胞,其具有传统施万细胞的形态特征,并在体外可至少存活18代;S100β蛋白是主要存在于外周神经系统施万细胞中的特异性蛋白质[13]。结果显示,S100β蛋白在施万样细胞中几乎均为阳性,并表达施万细胞多种特异性蛋白(数据未显示)。
DRG主要由周围神经系统感觉神经元构成,结构简单经典,广泛应用于神经组织工程、干细胞治疗等方面[14]。DRG的取材来自于各个年龄段的大鼠,包括胎鼠、乳鼠及成年大鼠。成年大鼠的DRG神经元相对成熟且活性较低,胎鼠取材难度相对较大且耗时长。考虑实验的可行性和方便性,我们采用方便操作、DRG活性较高的出生4~5 d乳鼠作为实验对象,取材过程在4℃、30 min内完成,保证DRG神经元在体外的活性[15]。βⅢ-微管蛋白是神经元发育和轴突再生过程中的特异性骨架蛋白,通过检测其表达可观测神经元轴突的生长和再生情况[16]。由于轴突密度数量较大,难以实现定量统计,而本研究免疫荧光结果可鉴定体外培养的DRG神经元,同时对轴突的平均长度进行定量分析,施万样细胞微囊泡刺激后的DRG神经元轴突长度更长,说明施万样细胞微囊泡可促进轴突生长。
神经元细胞原代培养的影响因素诸多,例如,不同批次的大鼠DRG的活性,取材手法的差异等,都是实验研究的不稳定因素。因此,以神经元样细胞株N2a为对象进行后续实验,同时也证明N2a神经元胞体及轴突可吞噬内化微囊泡[17]。本研究结果显示,施万样细胞微囊泡同样可以进入神经元样N2a细胞内,由于细胞膜染料PKH67荧光信号的检测会有放散效果,所以荧光信号的形状大小并不能完全代表微囊泡的实际大小,可基本判断N2a细胞中的绿色荧光即为PKH67标记的施万样细胞微囊泡。施万样细胞微囊泡刺激N2a细胞19 h时,N2a细胞GAP43 mRNA表达量明显增加。施万样细胞微囊泡浓度在5 mg/L时未促进N2a细胞GAP43 mRNA表达增加,而浓度为20、40 mg/L时促进GAP43 mRNA表达增加,由此说明低浓度微囊泡可能对N2a细胞突起的形成无明显效果,故后续N2a细胞突起形成实验和过碘酸-雪夫染色中,微囊泡浓度均用 0、20、40 mg/L。过碘酸-雪夫染色用于检测细胞内糖原[18]。本实验N2a细胞的过碘酸 雪夫染色结果表明,施万样细胞微囊泡可促进N2a细胞内糖原生成。糖原代谢对神经元的发育过程起重要作用,糖原在神经系统中用于产生乳酸,在神经系统受损期间维持神经元存活及神经修复[19]。现已证明施万细胞的微囊泡可作为载体,降低轴突生长锥中GTP酶RhoA活性,促进神经损伤后的轴突再生[4]。本实验证实人源的施万样细胞微囊泡促进轴突生长的同时,也可促进神经元内糖原的生成,而神经元的糖原代谢与轴突生长间的具体联系尚不清楚,以及施万样细胞微囊泡是否通过促进神经元的糖原代谢而促进轴突再生,还有待进一步研究。

